Содержание
- 2. ПЛАН ЛЕКЦИИ
- 3. Реакции обменного разложения солей водой Гидролиз – результат поляризационного взаимодействия ионов соли с их гидратной (Н2О)
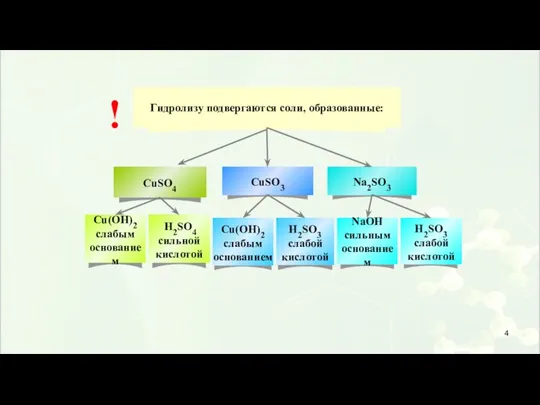
- 4. !
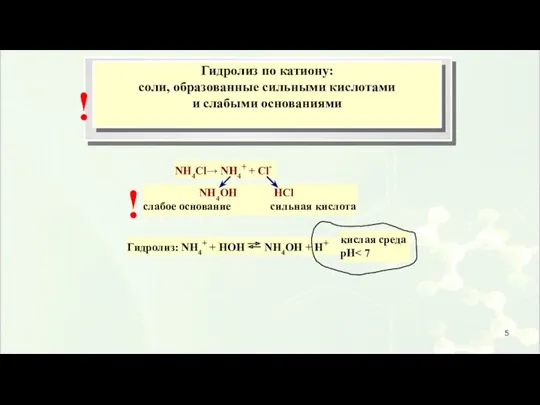
- 5. Гидролиз: NH4+ + НОН NH4ОН + Н+ кислая среда рН ! !
- 6. Гидролиз по аниону: соли, образованные слабыми кислотами и сильными основаниями Гидролиз по ступеням: 1 cтупень: S2-
- 7. Соли, образованные сильной кислотой и сильным основанием, гидролизу не подвергаются. ! !
- 8. Изменение окраски индикаторов в зависимости от рН среды Аl2(SO4)3 Na2CO3 сильное основание слабая кислота слабое основание
- 10. Лекция 13 Национальный исследовательский университет МЭИ Кафедра Химии и электрохимической энергетики Электрохимические процессы. Электродные потенциалы
- 11. ПЛАН ЛЕКЦИИ
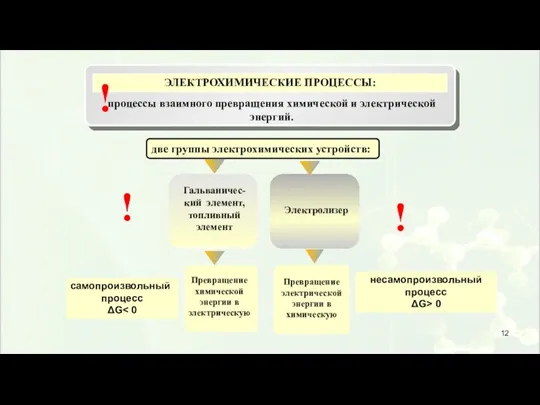
- 12. Превращение химической энергии в электрическую Гальваничес-кий элемент, топливный элемент Электролизер две группы электрохимических устройств: Превращение электрической
- 13. Общее: окислительно-восстановительная реакция - электрохимическая реакция; пространственная локализация электронных переходов; процессы восстановления и окисления разделены.
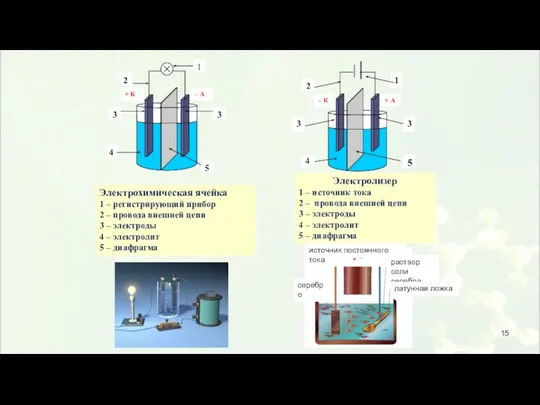
- 14. Электрохимическая система состоит: металлические проводники, измерительные приборы, потребители внешняя цепь: два электрода, ионный проводник внутренняя цепь:
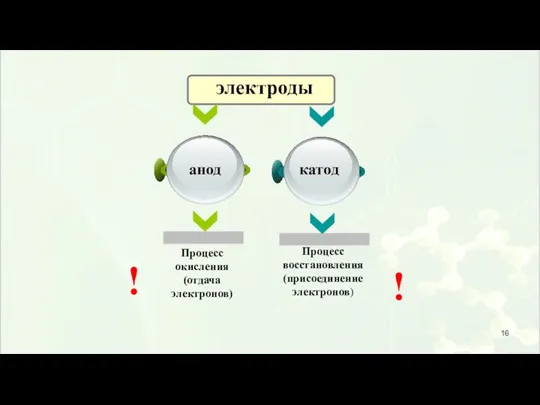
- 16. электроды ! !
- 17. ЗАКОНЫ ФАРАДЕЯ 1. Масса или количество вещества, претерпевшего превращение на электроде при протекании постоянного тока, прямо
- 18. 2. При прохождении через различные электролиты одного и того же количества электричества, массы веществ, участвующих в
- 19. На любое электрохимическое превращение 1 моль эквивалента вещества требуется одинаковое количество электричества, равное 96484 Кл (А
- 20. Для расчета массы вещества: МЭ =М/n – молярная масса эквивалента вещества, г/моль; n – число электронов,
- 21. для расчета объема газообразных веществ: VЭ = Vm / n – объем моль эквивалента газа, л/моль;
- 22. На границе раздела электрод - ионный проводник: Ме: Меn+ ⋅ nе Меn+ + nе При погружении
- 23. 2) диффузия Меn+ в раствор; 3) образование двойного электрического слоя на Ме (–), в растворе (+);
- 24. 5) устанавливается равновесие: Ме + mН2О Меn+⋅ (Н2О)m+ ne Возникает равновесный электродный потенциал: ЕРМеn+/ Ме ⮀
- 25. Случаи возникновения разности потенциалов на границе Ме – раствор: 3) Благородные металлы (Ме - Au, Pt)
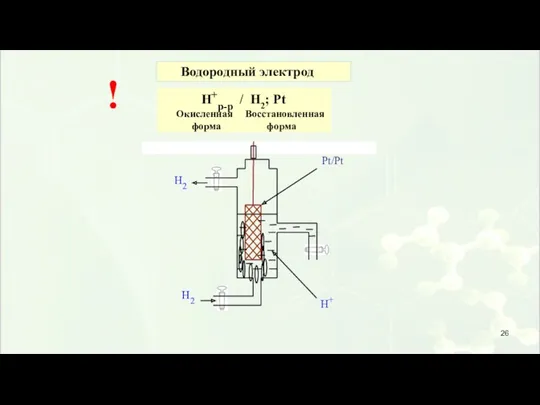
- 26. Водородный электрод Н+р-р / Н2; Pt Окисленная Восстановленная форма форма !
- 27. Роль платины: 1. адсорбция Н2 на Pt 2. Pt хороший катализатор реакции Н2 → 2Н Если
- 28. Кислородный электрод окисленная восстановленная форма форма О2, Pt / ОН-р-р !
- 29. При протекании электрического тока электродный потенциал отличается от равновесного - Индекс Ox/Red обозначает окисленная (Ox) и
- 30. Измеряют относительные значения электродных потенциалов: относительно электрода сравнения, потенциал которого известен. Абсолютное значение электродного потенциала определить
- 31. Измеряют относительные значения электродных потенциалов: относительно электрода сравнения, потенциал которого известен. Абсолютное значение электродного потенциала определить
- 32. Стандартные электродные потенциалы – табулированы. В таблице стандартных электродных потенциалов потенциалы расположены в порядке возрастания, что
- 34. Скачать презентацию

























 Хімічний склад жувальної гумки
Хімічний склад жувальної гумки Cross-section sample preparation using focused ion beam system (FIB) for transmission electron microscopy (TEM)
Cross-section sample preparation using focused ion beam system (FIB) for transmission electron microscopy (TEM) Введение в токсикологическую химию. Объекты химико-токсикологического исследования
Введение в токсикологическую химию. Объекты химико-токсикологического исследования Розв’язування задач на приготування розчинів із кристалогідратів
Розв’язування задач на приготування розчинів із кристалогідратів Предмет и задачи физической химии
Предмет и задачи физической химии Хімічний зв’язок. Ковалентний, йонний, металічний, водневий зв’язки, механізми їх утворення
Хімічний зв’язок. Ковалентний, йонний, металічний, водневий зв’язки, механізми їх утворення Коррозия металлов. Способы защиты металлов от коррозии
Коррозия металлов. Способы защиты металлов от коррозии Карбоновые кислоты. (Лекция 6.3)
Карбоновые кислоты. (Лекция 6.3) Ізогіпсичні перетворення функціональних груп. Реакції заміщення та елімінування
Ізогіпсичні перетворення функціональних груп. Реакції заміщення та елімінування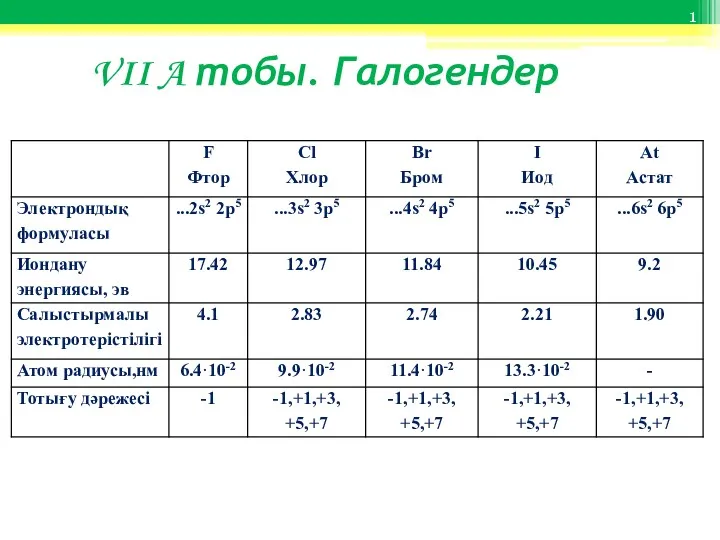 VII A тобы. Галогендер
VII A тобы. Галогендер Скорость химических реакций
Скорость химических реакций Аллотропные модификации алмаза
Аллотропные модификации алмаза Способы выражения концентрации растворов
Способы выражения концентрации растворов Спирты (алканолы)
Спирты (алканолы) Строение атома. 10 ен
Строение атома. 10 ен Строение и функции биополимеров
Строение и функции биополимеров Соли аммония
Соли аммония Обмен липидов. Классификация липидов
Обмен липидов. Классификация липидов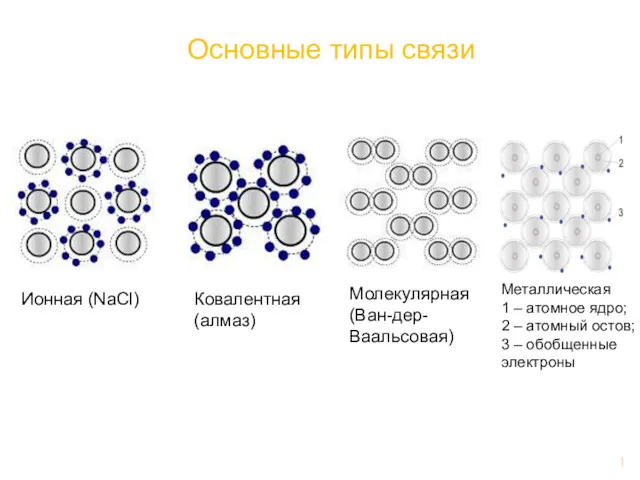 Основные типы связи
Основные типы связи Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Шкала не Мооса
Шкала не Мооса Поняття про багатоатомні спирти на прикладі гліцеролу, його хімічні властивості
Поняття про багатоатомні спирти на прикладі гліцеролу, його хімічні властивості Обратимость химических реакций. Химическое равновесие
Обратимость химических реакций. Химическое равновесие Взрывчатые вещества, их история и применение
Взрывчатые вещества, их история и применение Оттекті органикалық қосылыстар тақырыбын пәнаралық байланыс арқылы оқыту әдістемесі
Оттекті органикалық қосылыстар тақырыбын пәнаралық байланыс арқылы оқыту әдістемесі Растворы. Способы выражения концентраций. Сильные и слабые электролиты. Закон разведения Оствальда. Лекция 02-1
Растворы. Способы выражения концентраций. Сильные и слабые электролиты. Закон разведения Оствальда. Лекция 02-1 Липиды, биологическая роль, классификация
Липиды, биологическая роль, классификация Щёлочноземельные металлы
Щёлочноземельные металлы