Содержание
- 2. Ученые древности о строении вещества Древнегреческий ученый Демокрит 2500 лет назад считал, что любое вещество состоит
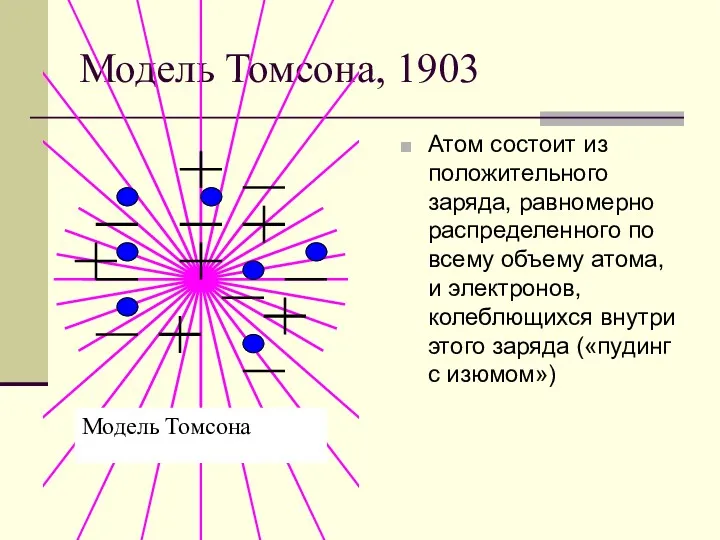
- 3. Модель Томсона, 1903 Атом состоит из положительного заряда, равномерно распределенного по всему объему атома, и электронов,
- 4. Несоответствия модели Томсона Экспериментально обнаружено, что подавляющая часть атомного пространства не содержит тяжелых частиц, т.е. в
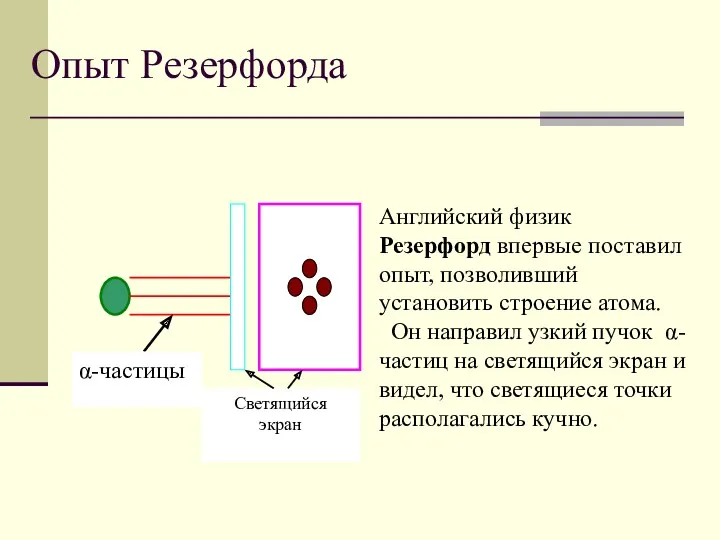
- 5. Опыт Резерфорда Английский физик Резерфорд впервые поставил опыт, позволивший установить строение атома. Он направил узкий пучок
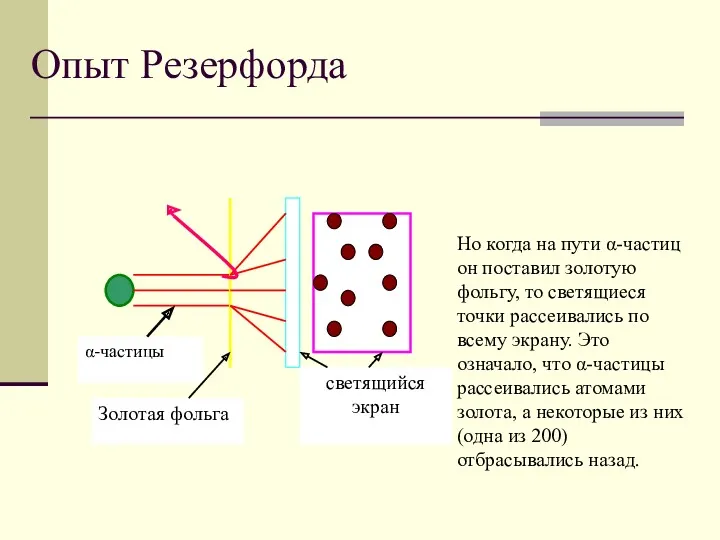
- 6. Опыт Резерфорда Но когда на пути α-частиц он поставил золотую фольгу, то светящиеся точки рассеивались по
- 7. Причины рассеивания α-частиц Электрон, входящий в состав атома нет мог рассеивать α-частиц так как масса α-частицы
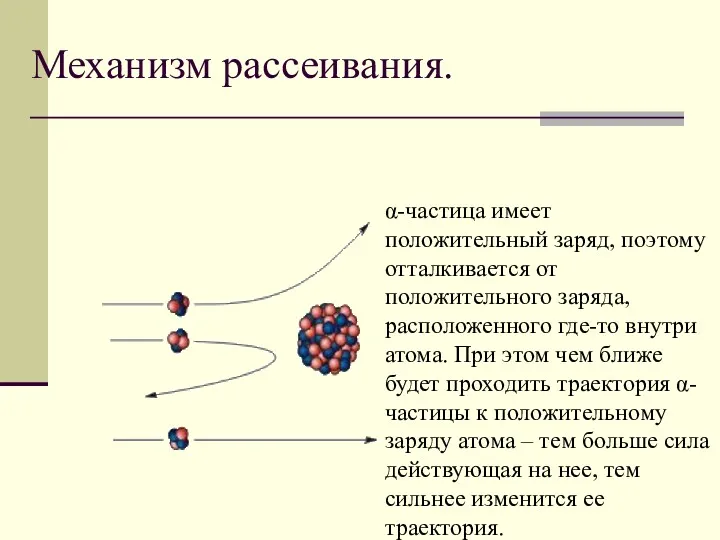
- 8. Механизм рассеивания. α-частица имеет положительный заряд, поэтому отталкивается от положительного заряда, расположенного где-то внутри атома. При
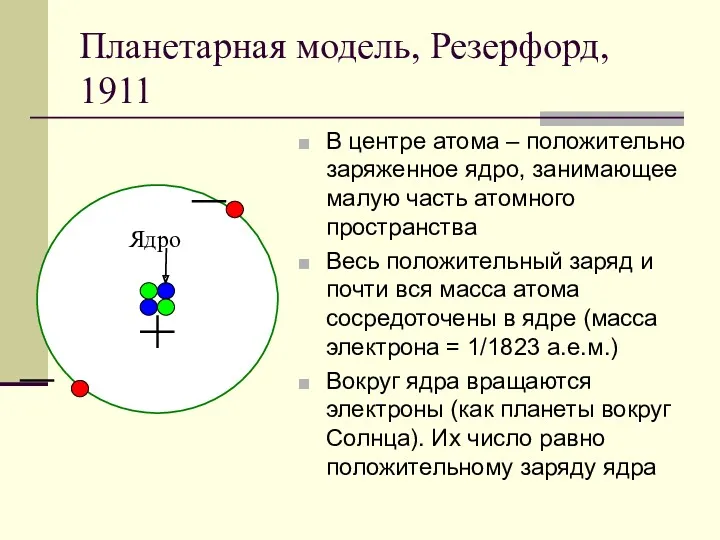
- 9. Планетарная модель, Резерфорд, 1911 В центре атома – положительно заряженное ядро, занимающее малую часть атомного пространства
- 10. Недостатки планетарной модели Электрон, двигаясь вокруг ядра с ускорением (действие центробежной силы), должен был бы непрерывно
- 11. Теория Н.Бора, 1913 Электрон может вращаться вокруг ядра по строго определенным (стационарным) круговым орбитам mvr =
- 12. Плюсы теории Бора Объясняла физическую природу атомных спектров, как результата перехода атомных электронов с одних стационарных
- 13. Недостатки модели Бора Для более тяжелых атомов теория не помогала в расчете спектров, которые бы согласовывались
- 14. Элементарные частицы Электрон – заряд = -1, m = 0,00055 а.е.м. Протон – заряд = 1,
- 15. Современная теория строения атома Электрон имеет двойственную (корпускулярно-волновую) природу: имеет массу и заряд как частица и
- 16. Современная теория строения атома Для электрона невозможно одновременно точно измерить координату и скорость (принцип неопределенности) Чем
- 17. Современная теория строения атома Электрон в атоме не двигается по определенным траекториям, а может находиться в
- 18. Современная теория строения атома Ядра атомов состоят из протонов и нейтронов (нуклонов) Число протонов = порядковому
- 19. Современная теория строения атома Нуклиды – различные виды атомов Характеристики нуклидов: А – массовое число, Z
- 20. Современная теория строения атома Квантовая механика – уравнение Шредингера (ψ – волновая функция, описывающая состояние электрона
- 21. Главное квантовое число(n) n - 1, 2, 3,…∞, определяет энергию электрона в атоме Энергетический уровень -
- 22. Орбитальное квантовое число (l) харак-ет форму электронного облака l = 0, 1, 2, 3….n-1 Подуровень: s,
- 23. Магнитное квантовое число (ml) характеризует ориентацию электронных облаков в пространстве ml меняется от –l до +l,
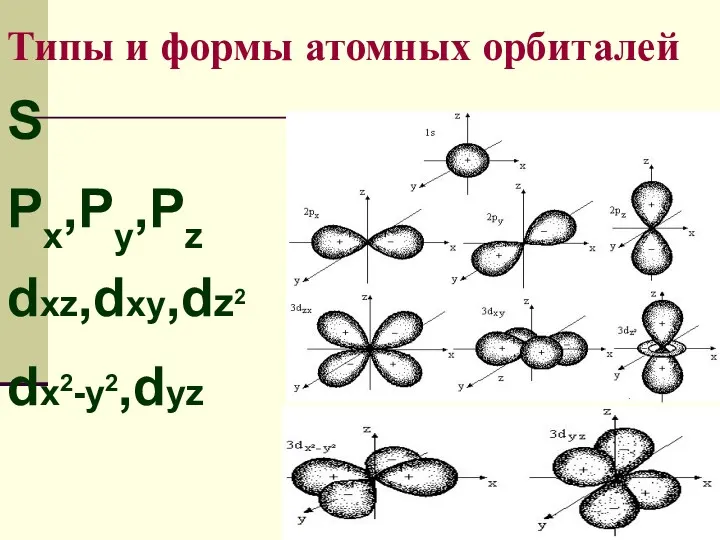
- 24. Типы и формы атомных орбиталей S Px,Py,Pz dxz,dxy,dz2 dx2-y2,dyz
- 25. Спиновое квантовое число (ms) характеризует собственный магнитный момент электрона, который или совпадает с ориентацией орбитального момента,
- 26. Атомная орбиталь (АО) это состояние электрона в атоме, которое описывается волновой функцией с набором из трех
- 27. Закономерности формирования электронных структур Принцип наименьшей энергии: электрон размещается на АО c min энергией (зависит от
- 28. Закономерности формирования электронных структур Принцип наименьшей энергии: электрон размещается на АО c min энергией Принцип Паули:
- 29. Последовательность заполнения АО по правилам Клечковского 1sι 2s2pι 3s3pι 4s3d4pι 5s4d5pι ⇒6s4f5d6pι 7s5f6d7p
- 30. Способы изображения электронных структур Электронная формула Графическая структура Энергетическая диаграмма
- 31. Примеры электронных структур Полная электронная формула Se - 1s22s22p63s23p64s23d104p4 Краткая формула Se - 4s24p4 Электроно-графическая формула
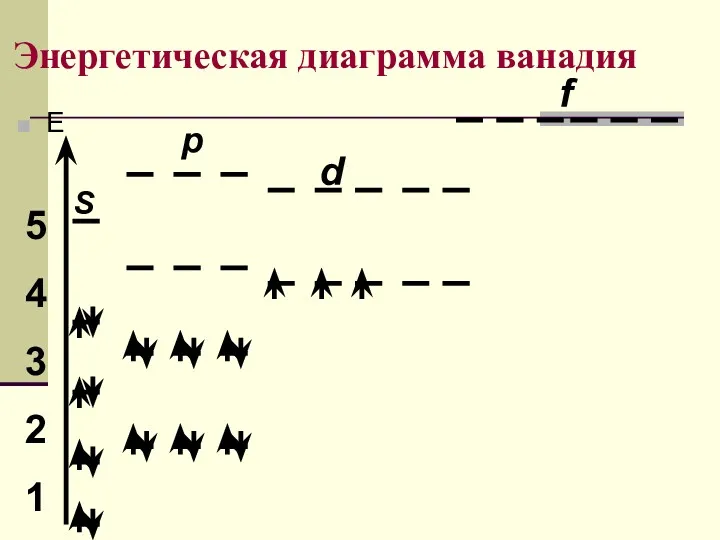
- 32. Энергетическая диаграмма ванадия Е 5 4 3 2 1 S p d f
- 33. Maксимальная емкость подуровня: 2(2l+1)e Максимальная емкость уровня: 2n2е
- 34. «Провал электрона» Пример: z = 24; Cr Ожидаемая: 1s22s22p63s23p64s23d4 Действительная: 1s22s22p63s23p64s13d5
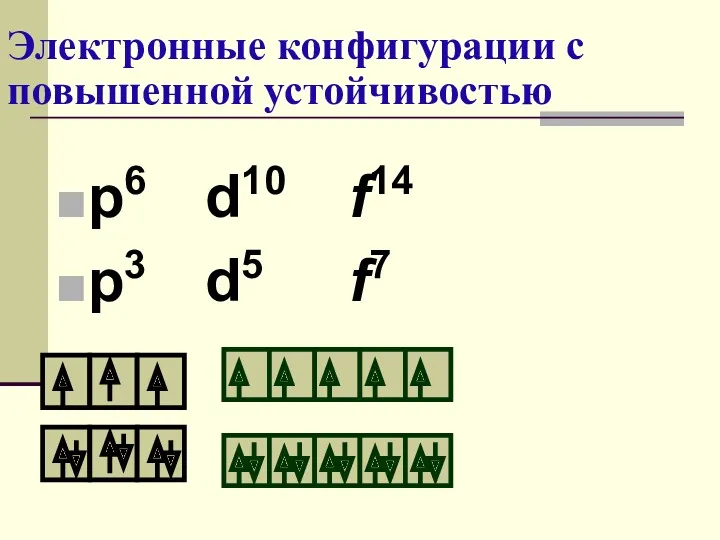
- 35. Электронные конфигурации с повышенной устойчивостью p6 d10 f14 p3 d5 f7
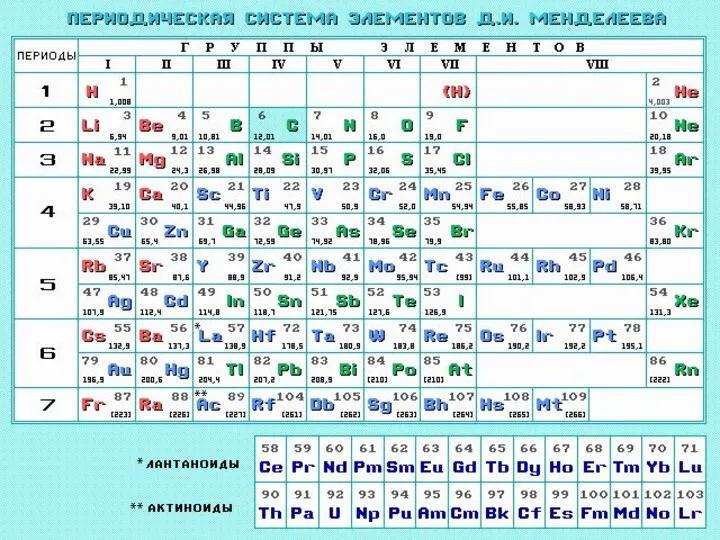
- 36. Периодическая система элементов Д.И. Менделеева (1869г.) Свойства элементов, а также формы и свойства их соединений находятся
- 37. Неясные моменты В чем причина периодичности? Почему элементы одной группы имеют одинаковую валентность и образуют одинаковые
- 38. Периодический закон Свойства элементов, а также формы и свойства их соединений находятся в периодической зависимости от
- 39. Причина периодичности Определенная последовательность формирования электронных оболочек (принципы и правила Паули, Хунда, Клечковского) Периодическое повторение сходных
- 40. Короткие периоды 1 период (n=1): (2n2) 2 элемента (1s2) 2 период (n=2): (2n2) 8 элементов (2s22p6)
- 41. Длинные периоды 4 период (n=4): (2n2 -2*7) 18 элементов (4s23d104p6) 5 период (n=5): (2n2 -2(7 +
- 42. Период - горизонтальная последовательность эл-тов, атомы которых имеют равное число энергетических уровней, частично или полностью заполненных
- 43. Группа - вертикальная последовательность элементов с однотипной электронной конфигурацией атомов, равным числом внешних эл-нов, одинаковой max
- 45. Периодичность свойств элементов атомные и ионные радиусы энергия ионизации сродство к электрону электроотрицательность валентность элементов
- 46. Периодичность свойств простых веществ и соединений температура плавления и кипения длина химической связи энергия химической связи
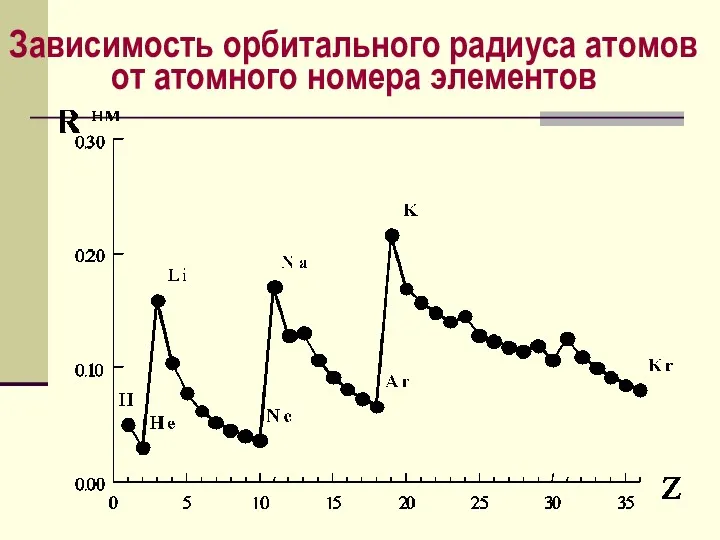
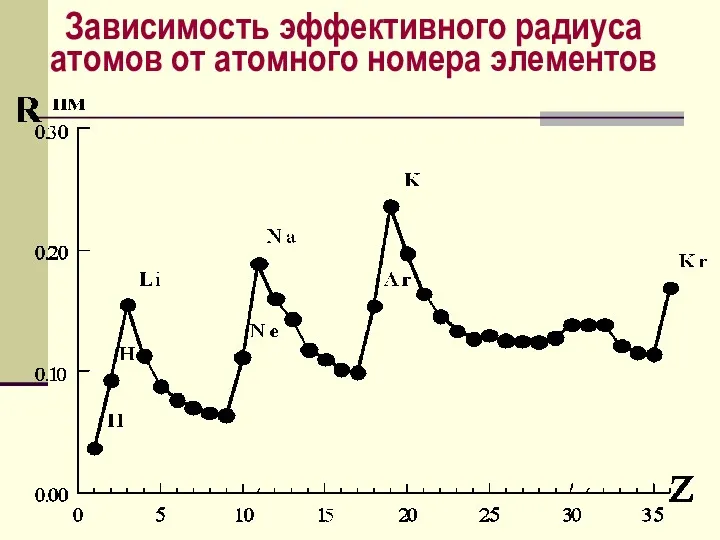
- 47. Атомные и ионные радиусы химических элементов Орбитальный радиус атома (иона) – это расстояние от ядра до
- 48. Радиус ум-ся р а с т е т
- 49. Радиусы катионов и анионов Превращение атома в катион - резкое ум-ие орбитального радиуса Превращение атома в
- 50. Зависимость орбитального радиуса атомов от атомного номера элементов
- 51. Зависимость эффективного радиуса атомов от атомного номера элементов
- 52. Эффективные радиусы атомов и ионов определяют по межъядерным расст-ям в молекулах и кристаллах, предполагая, что атомы
- 53. Ковалентные радиусы - это эффективные радиусы, определяемые по межъядерным расстояниям в ковалентных молекулах Металлические радиусы -
- 54. Энергия и потенциал ионизации атомов Энергия ионизации – это энергия, необходимая для отрыва электрона от атома
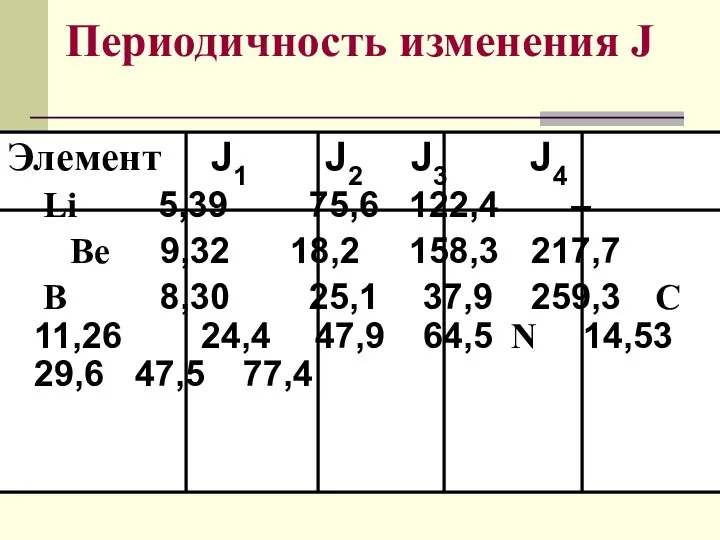
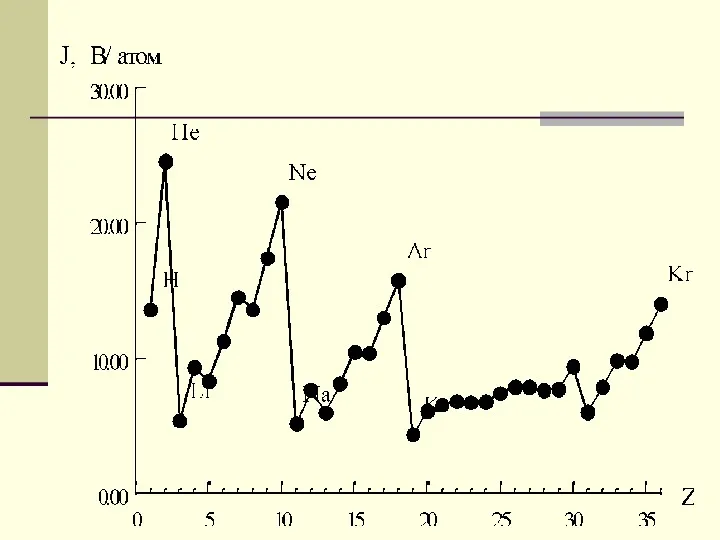
- 55. 1-й, 2-й, ….i потенциал ионизации Энергия отрыва каждого последующего электрона больше, чем предыдущего J1 Резкое увеличение
- 56. Периодичность изменения J Элемент J1 J2 J3 J4 Li 5,39 75,6 122,4 – Be 9,32 18,2
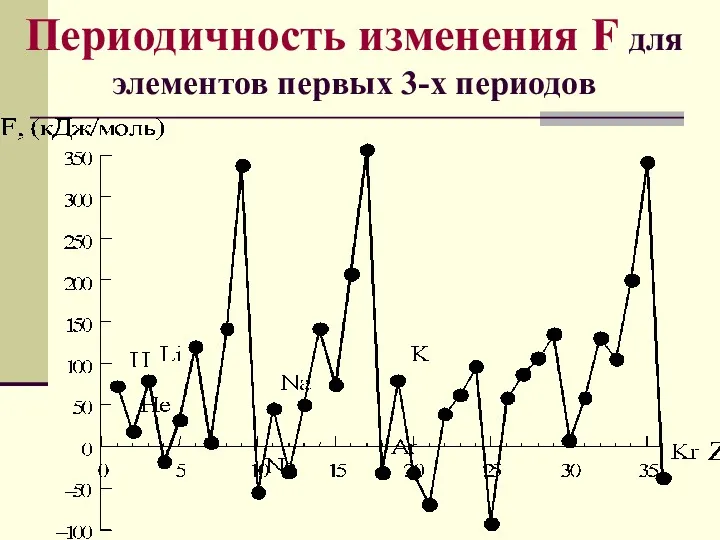
- 58. Сродство к электрону это энергия, выделяющаяся или поглощающаяся при захвате электрона атомом или энергия, необходимая для
- 59. Периодичность изменения F для элементов первых 3-х периодов
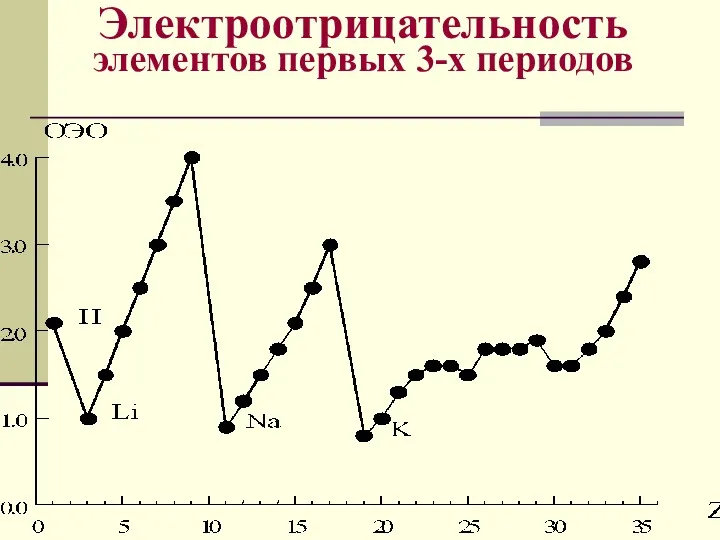
- 60. Электроотрицательность - свойство атома притягивать электроны от других атомов, с которыми он образует химическую связь в
- 61. Электроотрицательность элементов первых 3-х периодов
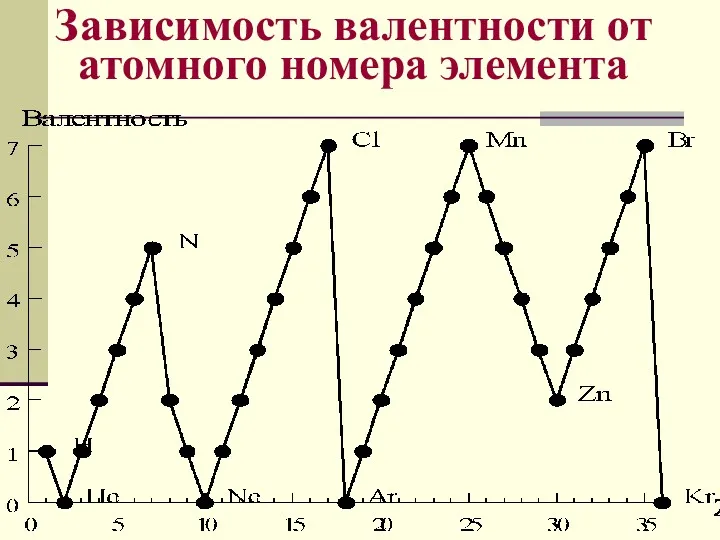
- 62. Валентность Валентность определяется электронами внешнего уровня, поэтому высшая валентность элементов главных подгрупп равна номеру группы
- 63. Зависимость валентности от атомного номера элемента
- 64. Периодические свойства соединений основно-кислотные свойства оксидов и гидроксидов: в периодах ум-ся основные свойства, но ув-ся кислотные
- 65. Периодичность кислотно-основных свойств Группа s-эл-ты H p-эл-ты Основ. d-эл-ты Кислотные Основые оксиды кисл.-осн. св-ва оксиды для
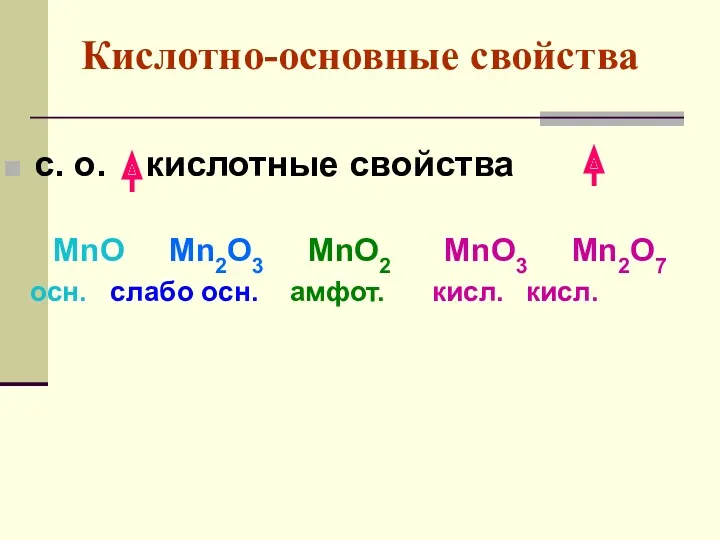
- 66. Кислотно-основные свойства с. о. кислотные свойства MnO Mn2O3 MnO2 MnO3 Mn2O7 осн. слабо осн. амфот. кисл.
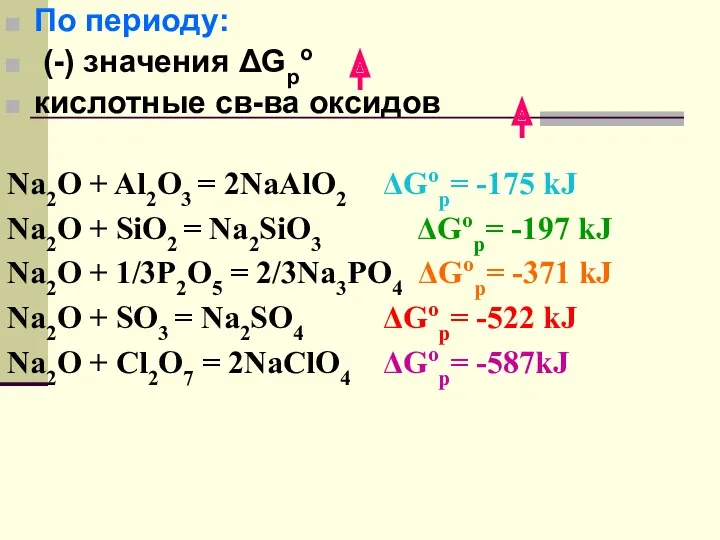
- 67. По периоду: (-) значения ΔGрo кислотные св-ва оксидов Na2O + Al2O3 = 2NaAlO2 ΔGoр= -175 kJ
- 68. Окислительная способность простых веществ и однотипных соединений: в периодах увеличивается в группах уменьшается
- 69. Окислительная способность простых веществ и однотипных соединений: в периодах увеличивается в группах уменьшается
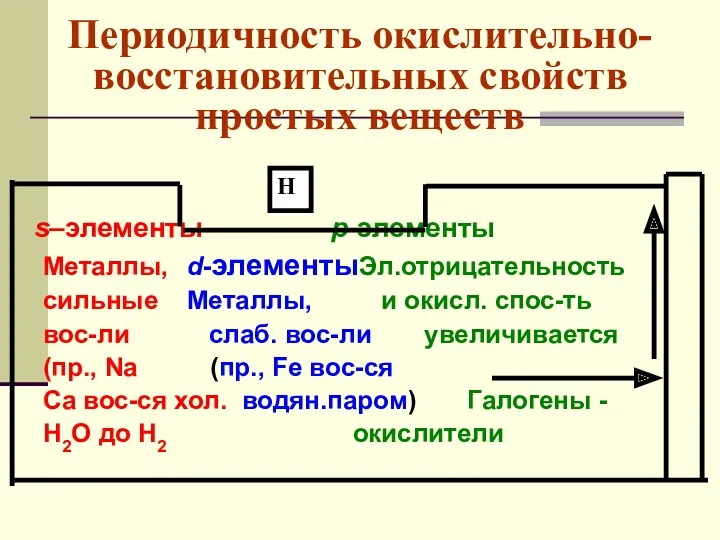
- 70. Периодичность окислительно-восстановительных свойств простых веществ s–элементы p-элементы Металлы, d-элементыЭл.отрицательность сильные Металлы, и окисл. спос-ть вос-ли слаб.
- 72. Скачать презентацию


















































 Кристаллическое строение и кристаллизация металлов
Кристаллическое строение и кристаллизация металлов Бережём планету вместе. Нефть
Бережём планету вместе. Нефть Органіка. Органічні речовини
Органіка. Органічні речовини Благородные газы
Благородные газы Растворы и свойства растворов. Лекция 3
Растворы и свойства растворов. Лекция 3 Типы химических реакций
Типы химических реакций Ионное произведение воды. Водородный показатель воды
Ионное произведение воды. Водородный показатель воды Новинки СН старт: июль 2016 Профессиональная химия PRO service
Новинки СН старт: июль 2016 Профессиональная химия PRO service Вклад М.В. Ломоносова в развитие науки химия
Вклад М.В. Ломоносова в развитие науки химия Сложные углеводы. Олигосахариды и полисахариды
Сложные углеводы. Олигосахариды и полисахариды Состояние атмосферного воздуха в Ярославской области
Состояние атмосферного воздуха в Ярославской области Драгоценные камни
Драгоценные камни Натрий алкилсульфонаттарын алу. №4 лекция
Натрий алкилсульфонаттарын алу. №4 лекция CaSO4 кристаллының ас жазықтығына проекциясының құрылымдық моделі
CaSO4 кристаллының ас жазықтығына проекциясының құрылымдық моделі Алкадиены. Циклоалканы. Лекция № 5
Алкадиены. Циклоалканы. Лекция № 5 Химический тренажер. Химические элементы
Химический тренажер. Химические элементы Осадительное титрование. (Лекция 27)
Осадительное титрование. (Лекция 27) Объёмная доля компонента смеси
Объёмная доля компонента смеси Роль воды в химических реакциях
Роль воды в химических реакциях Термокаталитические процессы. Каталитический крекинг. Классификация и основные факторы процесса
Термокаталитические процессы. Каталитический крекинг. Классификация и основные факторы процесса Предмет и задачи химии. Вещества и их свойства. (Продолжение)
Предмет и задачи химии. Вещества и их свойства. (Продолжение) Углеводы. (Лекция 7)
Углеводы. (Лекция 7) Показатели жесткости воды
Показатели жесткости воды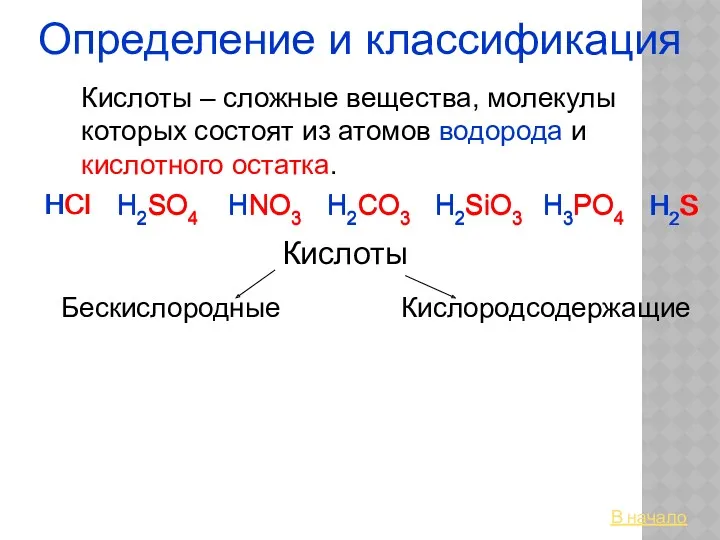 Кислоты. Определение и классификация
Кислоты. Определение и классификация Приёмы обращения с лабораторным оборудованием
Приёмы обращения с лабораторным оборудованием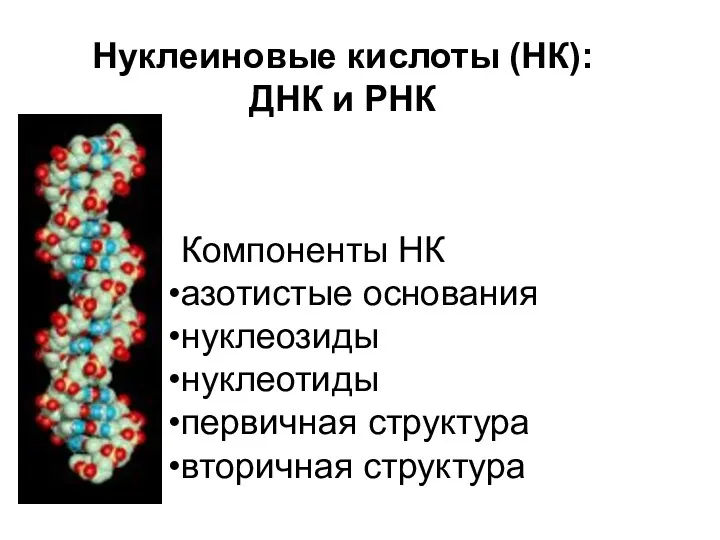 Нуклеиновые кислоты
Нуклеиновые кислоты Радиохимия
Радиохимия Элементы химической термодинамики. 1 и 2 законы термодинамики. Химическое равновесие
Элементы химической термодинамики. 1 и 2 законы термодинамики. Химическое равновесие