Содержание
- 2. План 1. Сущность и классификация методов осадительного титрования. 2. Кривые титрования и их анализ. 3. Индикаторы
- 3. 1. Сущность и классификация методов осадительного титрования. Осадительное титрование - метод титриметрического анализа, основанный на применении
- 4. Требования к реакциям и определяемым веществам: Определяемое вещество должно хорошо растворятся в воде и давать ион,
- 5. Классификация методов осадительного титрования по используемому титранту: Аргентометрия (АgNО3) Меркурометрия (Нg2(NОз)2) Тиоцианатометрия (КNСS или NH4NCS) Сульфатометрия
- 6. Способы (приемы) проведения осадительного титрования В осадительном титровании применяют прямое и обратное титрование. 1). Прямым аргентометрическим
- 7. 2). Способом обратного осадительного титрования можно определять бромид-ионы в бромиде калия. К анализируемому раствору, содержащему бромид-ионы,
- 8. 2. Кривые титрования, их анализ Кривая осадительного титрования – графическое изображение изменения концентрации определяемого в-ва (или
- 9. 2. Кривые титрования, их анализ Построение кривых титрования осуществляется на основании правила произведения растворимости. и соответственно
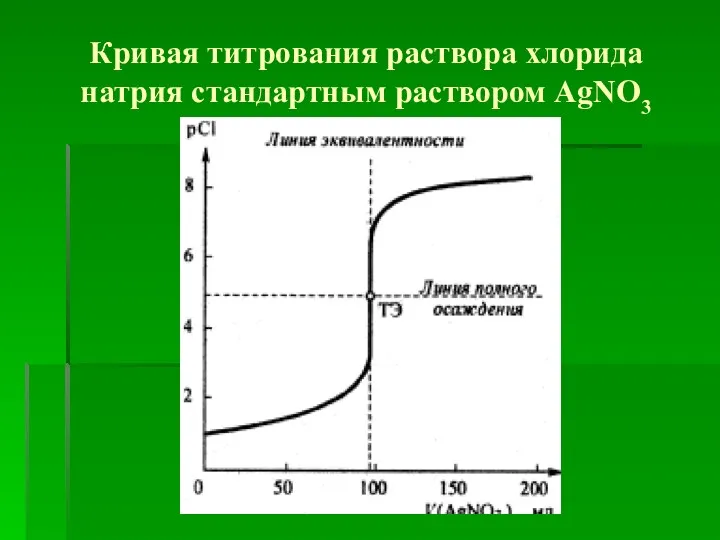
- 10. Кривая титрования раствора хлорида натрия стандартным раствором АgNО3
- 11. Линии полного осаждения соответствуетзначение рCl=4,875 в ТЭ. Скачок титрования ΔрСl лежит в интервале примерно от рCl≈3,8
- 12. Факторы, определяющие величину скачка титрования на кривых осадительного титрования концентрация растворов титранта и определяемого иона (чем
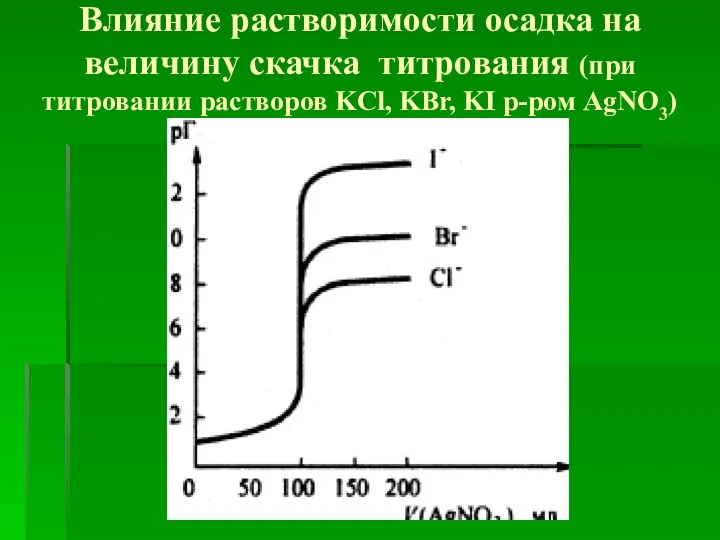
- 13. Влияние растворимости осадка на величину скачка титрования (при титровании растворов KCl, KBr, KI р-ром АgNО3)
- 15. Факторы, определяющие величину скачка титрования на кривых осадительного титрования температура (чем выше температура, тем больше растворимость
- 16. 3. Индикаторы методов осаждения ТЭ в методах осаждения может быть определена титрованием без индикатора и с
- 17. 1. Индикаторы-реагенты (хромат калия, железоаммонийные квасцы). Сущность их действия: они так же, как и анализируемое вещество,
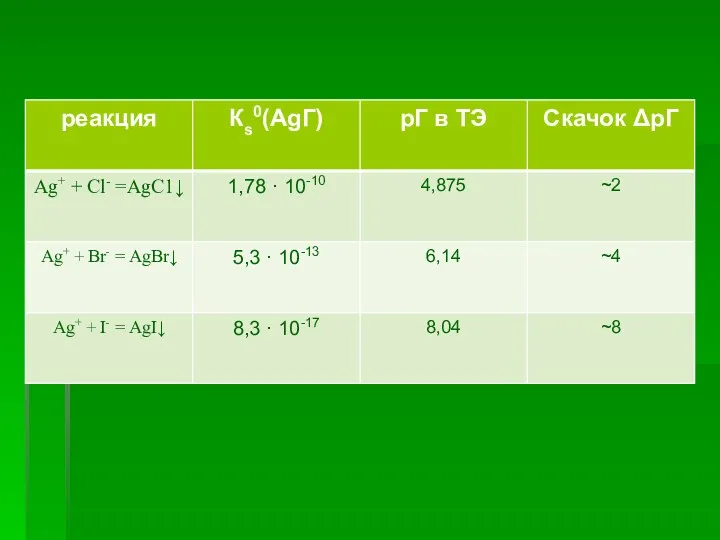
- 18. Концентрация ионов в насыщенном растворе этих соединений составит: [Ag+]=[Cl-] = √1,1.10-10 = 1,05 ·10-5 (г-ион/л) [Ag+]=[Вг-]=
- 19. 2. Адсорбционные индикаторы (флюоресцеин, эозин). Их действие основано на том, что в ТЭ индикатор адсорбируется на
- 20. 4. Аргентометрия X- + Ag+ = AgX↓ где: X- = Cl-, Br-, I-, CN-, SCN- и
- 21. В зависимости от способа проведения титрования и используемого индикатора методы аргентометрии делят на: безиндикаторные: - метод
- 22. Метод Мора Титрант: AgNO3 – втор. станд. раствор Стандартизация по перв. станд. раствору натрий хлорида NaCl
- 23. Ограничения использования метода Мора: нельзя титровать кислые растворы: 2CrO42- + 2H+ = Cr2O72- + H2O нельзя
- 24. Метод Фаянса-Фишера-Ходакова Титрант: AgNO3 – втор. станд. раствор Стандартизация по перв. станд. раствору натрий хлорида NaCl
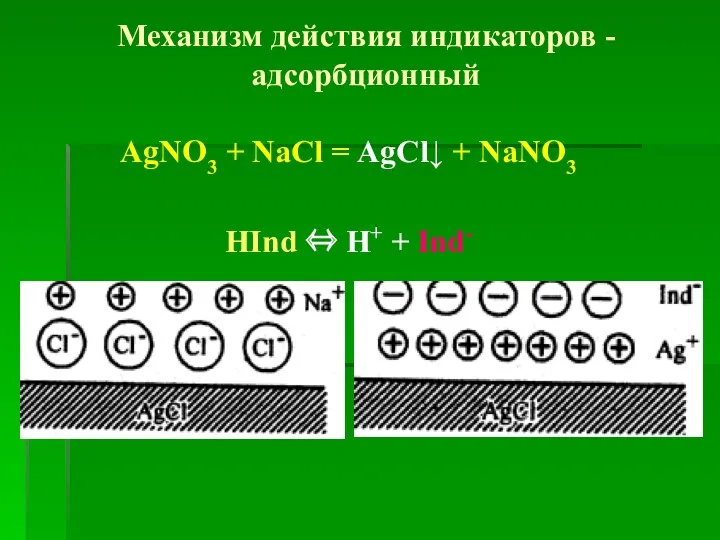
- 25. Механизм действия индикаторов - адсорбционный AgNO3 + NaCl = AgCl↓ + NaNO3 HInd ⇔ H+ +
- 26. Метод Фаянса-Фишера-Ходакова Окраска Индикатор раствор поверхность осадка Флуоресцеин зелено-желтая розовая Эозин желтовато-красная красно - фиолетовая Ряд
- 27. Метод Фаянса-Фишера-Ходакова Условия проведения титрования: кислотность растворов концентрация реагирующих растворов учет адсорбционной способности индикаторов и присутствующих
- 28. Метод Фольгарда Титранты: AgNO3, аммоний или калий тиоцианат NH4SCN, KSCN - втор. станд. растворы Стандартизация AgNO3
- 29. До ТЭ Hal- + Ag+ (избыток) = AgHal↓ Ag+(остаток) + SCN- = AgSCN↓ После ТЭ Fe3+
- 30. 5. Тиоцианатометрия Титрант: аммоний или калий тиоцианат NH4SCN, KSCN - втор. станд. растворы Стандартизация: по стандартному
- 31. 5. Тиоцианатометрия Определяемые вещества: лекарственные средства, которые содержат серебро (протаргол, колларгол, серебра нитрат). !!! При анализе
- 32. 6. Меркурометрия Меркурометрия – 2Cl- + Hg22+ = Hg2Cl2↓ ПР = 1,3⋅10-18 2I- + Hg22+ =
- 33. Меркурометрия Индикаторы: 1) раствор ферум (ІІІ) тиоцианата (от красной окраски до обесцвечивания) 2Fe(SCN)2+ + Hg22+ =
- 34. Преимущества меркурометрии по сравнению с аргентометрией: возможность титровать в очень кислых растворах титрант дешевле соли меркурия
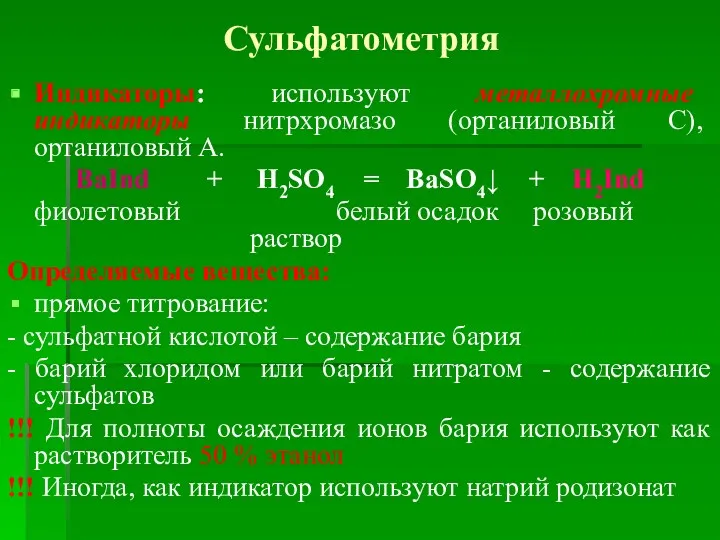
- 35. 7. Сульфатометрия Сульфатометрия – Иногда выделяют бариметрию – В основе метода: Ba2+ + SO42- = BaSO4↓
- 36. Сульфатометрия Индикаторы: используют металлохромные индикаторы нитрхромазо (ортаниловый С), ортаниловый А. BaInd + H2SO4 = BaSO4↓ +
- 37. Гексацианофератометрия Титрант: втор. станд. раств. K4[Fe(CN)6] Стандартизация: по станд. раств. KMnO4 в сульфатнокислой среде 5K4[Fe(CN)6] +
- 38. 8. Гексацианоферратометрия Индикаторы: - дифениламин в присутствии небольшого количества калий гексацианоферата (ІІІ) при определении Zn2+, Mn2+
- 40. Скачать презентацию













![Концентрация ионов в насыщенном растворе этих соединений составит: [Ag+]=[Cl-] =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/358556/slide-17.jpg)
















![Гексацианофератометрия Титрант: втор. станд. раств. K4[Fe(CN)6] Стандартизация: по станд. раств.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/358556/slide-36.jpg)

 Альдегіди. Будова молекул
Альдегіди. Будова молекул Техника безопасности в кабинете химии
Техника безопасности в кабинете химии Химические свойства основных неорганических соединений в свете ЭД и ОВР
Химические свойства основных неорганических соединений в свете ЭД и ОВР Азотсодержащие гетероциклические соединения
Азотсодержащие гетероциклические соединения Алюминий и его соединения
Алюминий и его соединения Решение заданий по теме Химические свойства основных классов неорганических веществ
Решение заданий по теме Химические свойства основных классов неорганических веществ Смеси, растворы. Тест
Смеси, растворы. Тест Энтальпия. Тепловой эффект химической реакции. 11 класс
Энтальпия. Тепловой эффект химической реакции. 11 класс Неорганические строительные материалы. Стекло
Неорганические строительные материалы. Стекло Кислородсодержащие органические вещества. Фенолы
Кислородсодержащие органические вещества. Фенолы Азотная кислота и ее соли
Азотная кислота и ее соли Коррозия металлов
Коррозия металлов Периодический закон и периодическая система Д.И. Менделеева. Вторичная периодичность. Тема №1
Периодический закон и периодическая система Д.И. Менделеева. Вторичная периодичность. Тема №1 Органічні розчинники
Органічні розчинники Смолы и бальзамы. Воски и структурообразующие вещества в косметическом производстве
Смолы и бальзамы. Воски и структурообразующие вещества в косметическом производстве Окислительно-восстановительные реакции. Урок в 11 классе
Окислительно-восстановительные реакции. Урок в 11 классе Алкины (ацетиленовые углеводороды)
Алкины (ацетиленовые углеводороды) Антибиотики пенициллинового ряда
Антибиотики пенициллинового ряда Жидкокристаллические композиты ЖКК. Керамические композиционные материалы (ККМ). Углерод-углеродные композиционные (УУКМ)
Жидкокристаллические композиты ЖКК. Керамические композиционные материалы (ККМ). Углерод-углеродные композиционные (УУКМ) История открытия химических веществ
История открытия химических веществ Защитно-декоративные покрытия
Защитно-декоративные покрытия Титриметрический метод анализа
Титриметрический метод анализа Основные классы неорганических соединений
Основные классы неорганических соединений Спроби класифікації хімічних елементів
Спроби класифікації хімічних елементів Целевой и содержательный компоненты процесса обучения химии
Целевой и содержательный компоненты процесса обучения химии Понятие биогенности химических элементов
Понятие биогенности химических элементов Биохимическая трансформация веществ (2)
Биохимическая трансформация веществ (2) Происхождение названий минералов
Происхождение названий минералов