Содержание
- 2. Задачи урока: Закрепить умения применять понятие «степень окисления» на практике. Обобщить и дополнить знания об опорных
- 3. Окислитель и восстановитель Окислителем называют реагент, который принимает электроны в ходе окислительно-восстановительной реакции. Восстановителем называют реагент,
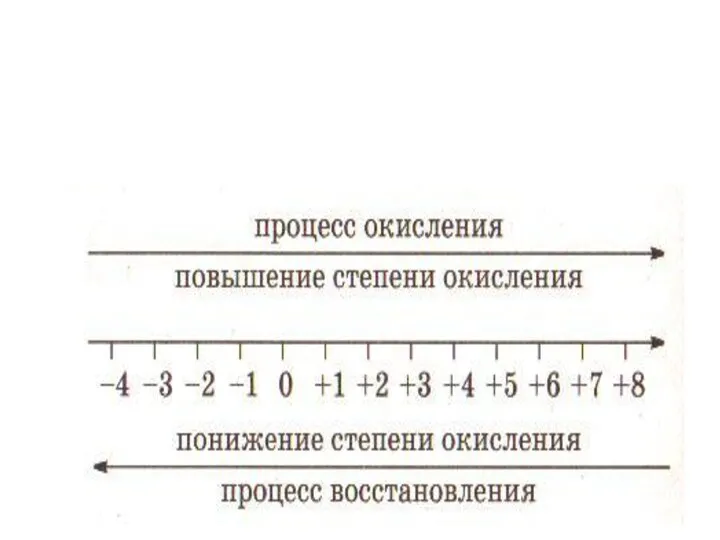
- 4. ПРОЦЕСС ОКИСЛЕНИЯ И ВОССТАНОВЛЕНИЯ Окислением называют процесс отдачи электронов атомом, молекулой или ионом, который сопровождается повышением
- 6. Какие из перечисленных ниже процессов представляют собой: окисление (0), какие – восстановление (В)?
- 8. Правила определения функции соединения в окислительно-восстановительных реакциях. 1. Если элемент проявляет в соединении высшую степень окисления,
- 9. 1.Установите соответствие между свойствами серы и уравнением ОВР, в котором она проявляет эти свойства. Свойства серы
- 10. Ответы: 1. 4312 2. 4652
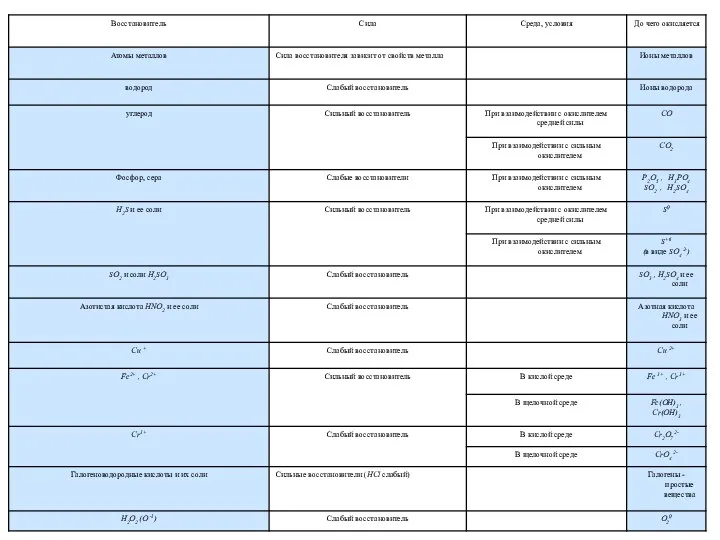
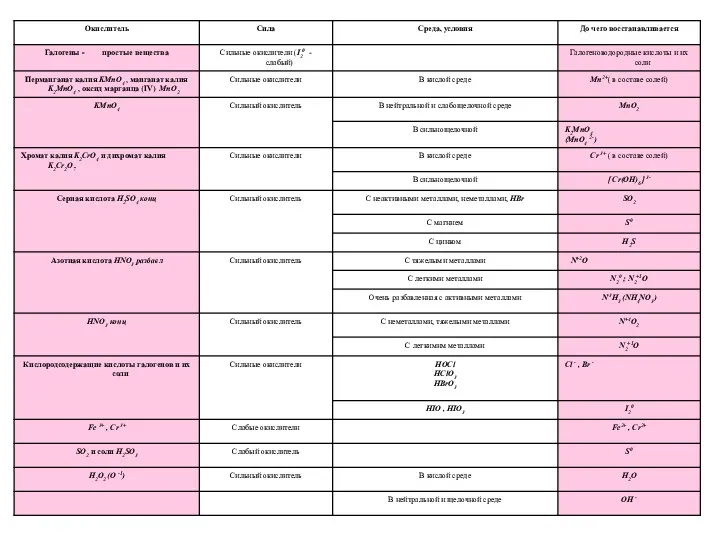
- 11. Основные окислители и восстановители
- 12. Основные окислители и восстановители
- 14. Сильным и достаточно распространенным окислителем является перманганат калия, который в различных средах восстанавливается до соединений марганца
- 15. Классификация ОВР 1 . Межмолекулярные реакции- реакции , которые идут с изменением степеней окисления атомов в
- 16. 2 . Внутримолекулярные реакции – реакции, в которых атомы, изменяющие свои степени окисления, находятся в одной
- 17. Реакции диспропорционирования (самоокисления-самовосстановления) –реакции , которые идут с изменением степени окисления атомов одного и того же
- 18. Реакции компропорционирования – те, в которых атомы одного и того же элемента в различных с.о. в
- 19. Межмолекулярные реакции: Частицы- доноры электронов (восстановители) – и частицы- акцепторы электронов (окислители) – находятся в разных
- 20. Внутримолекулярные реакции Донор электронов - восстановитель и акцептор электронов – окислитель – находятся в одном и
- 21. Реакции диспропорционирования (самоокисления-самовосстановления) Атомы одного и того же элемента в веществе выполняют одновременно функции и доноров
- 22. Составление окислительно-восстановительных реакций в заданиях ЕГЭ часть С1 Схемы с пропусками веществ 1)Ключевые вещества не пропущены
- 23. 1. Указаны формулы окислителя и восстановителя, а также формулы продуктов их восстановления и окисления. 2. Составление
- 24. Ответ: N+2 - 3ē → N+5 2 окисляется, N+2 - восстановитель Cl+1 + 2ē → Cl-1
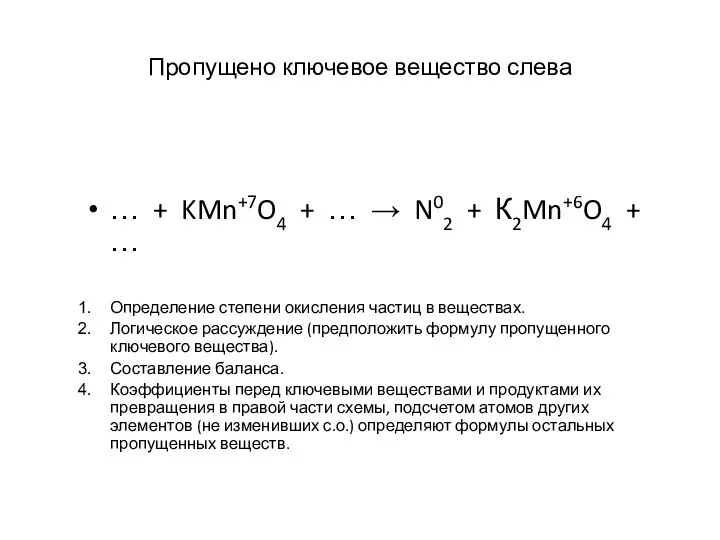
- 25. Пропущено ключевое вещество слева … + KMn+7O4 + … → N02 + К2Mn+6O4 + … Определение
- 26. Ответ: 2 N-3 - 6ē → N02 1 окисляется, N-3 - восстановитель Mn+7 + ē →
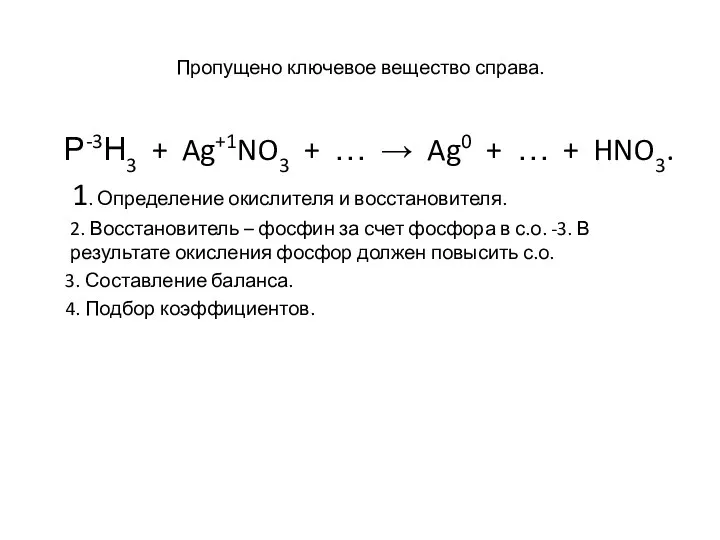
- 27. Пропущено ключевое вещество справа. Р-3Н3 + Ag+1NO3 + … → Ag0 + … + HNO3. 1.
- 28. Ответ: Р-3Н3 + Ag+1NO3 + … → Ag0 + Н3РО4 + HNO3. Р-3 - 8ē →
- 29. Задания для самостоятельной работы 1. Используя метод электронного баланса, составьте уравнение реакции: Pt + HNO3 +
- 30. Ответы: 1. Pt + HNO3 + HCl → PtCl4 + NO↑ + … 3 Pt +
- 32. Скачать презентацию
























 Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Соединения щелочных металлов
Соединения щелочных металлов Об изучении окислительно-восстановительных реакций в школьном курсе химии. Степени окисления атомов и формулы веществ
Об изучении окислительно-восстановительных реакций в школьном курсе химии. Степени окисления атомов и формулы веществ Відносна молекулярна маса речовини, її обчислення за хімічною формулою
Відносна молекулярна маса речовини, її обчислення за хімічною формулою Алканы
Алканы Химические свойства основных классов неорганических веществ
Химические свойства основных классов неорганических веществ Дистиляттағы цианидтер, алифаттық қатардағы галоген туындылары, хлороформ, хлоралгидрат, төртхлорлы көміртек
Дистиляттағы цианидтер, алифаттық қатардағы галоген туындылары, хлороформ, хлоралгидрат, төртхлорлы көміртек Углеводородное сырье: способы переработки
Углеводородное сырье: способы переработки Предельные углеводороды
Предельные углеводороды Комплесные соединения
Комплесные соединения Мұнай. Мұнайдың шығу тарихы
Мұнай. Мұнайдың шығу тарихы Лекция 1. Периодический закон и периодическая система химических элементов. Индустрия красоты
Лекция 1. Периодический закон и периодическая система химических элементов. Индустрия красоты Салыстырмалы тығыздығы мен элементтердің массалық үлестері бойынша газ күйіндегі заттардың молекулалық формулаларын табу
Салыстырмалы тығыздығы мен элементтердің массалық үлестері бойынша газ күйіндегі заттардың молекулалық формулаларын табу Алкалоидтар түсінігі. Никотин, кофеин,морфин, хинин туралы түсініктер
Алкалоидтар түсінігі. Никотин, кофеин,морфин, хинин туралы түсініктер Неметаллические материалы, используемые в машино- и приборостроении
Неметаллические материалы, используемые в машино- и приборостроении Спирти. 3агальна характеристика спиртів
Спирти. 3агальна характеристика спиртів Алюминий и его соединения
Алюминий и его соединения Метаболизм нуклеиновых кислот
Метаболизм нуклеиновых кислот Азотистые гетероциклические соединения
Азотистые гетероциклические соединения Формы минералов и их агрегатов
Формы минералов и их агрегатов Химические свойства металлов
Химические свойства металлов Що ховається за цифрами? Харчові домішки
Що ховається за цифрами? Харчові домішки Адсорбция-фазалар бөлу беттерінде жүретін бір компоненттің екінші компонентке сіңуі
Адсорбция-фазалар бөлу беттерінде жүретін бір компоненттің екінші компонентке сіңуі Угарный газ
Угарный газ Контрольная работа по дисциплине Физическая химия. Раздел: Электрохимия
Контрольная работа по дисциплине Физическая химия. Раздел: Электрохимия Адсорбция. Разделение однородных и неоднородных смесей
Адсорбция. Разделение однородных и неоднородных смесей Ферум та його сполуки
Ферум та його сполуки Аминокислоты. Белки
Аминокислоты. Белки