Содержание
- 2. Химические свойства оксидов Вспомните, с какими веществами взаимодействуют оксиды? Основные оксиды С кислотами С водой С
- 3. Химические свойства основных оксидов Взаимодействуют с кислотами +2 -2 +1 +6 -2 t +2 +6 -2
- 4. Химические свойства кислотных оксидов с растворимы основаниями (щелочами) +2 -2 +1 -2 +1 +1 +4 -2
- 5. Химические свойства кислот Вспомните, с какими веществами взаимодействуют кислоты ? с металлами с основными оксидами с
- 6. с металлами 0 +1 -1 +2 -1 0 Zn +2HCl = ZnCl2 + H2↑ - ОВР
- 7. +1 -2 -1 +1 -1 +1 -1 +1 -2 NaOH + HCl = NaCl + H2O
- 8. Химические свойства оснований Вспомните, с какими веществами взаимодействуют основания? с кислотами растворимые основания (щелочи) с солями
- 9. Химические свойства оснований с кислотами +1 -2 +1 +1 +6 -2 +1 +6 -2 +1 -2
- 10. Химические свойства оснований 3) Растворимые основания (щелочи) с кислотными оксидами +1 -2 +1 +6 -2 +1
- 11. Химическая свойства солей Вспомните, с какими веществами взаимодействуют соли? с металлами с кислотами с растворимыми основаниями
- 12. Химические свойства солей с металлами 0 +2 +6 -2 +2 +6 -2 0 Fe + CuSO4
- 13. Химические свойства солей 3) с растворимыми основаниями (щелочами) +2 -1 +1 -2 +1 +1 -1 +2
- 14. Химические свойства солей 5) с кислотными оксидами +2 +4 -2 +4 -2 t +2 +4 -2
- 16. Скачать презентацию










 Химия в быту
Химия в быту Теория кристаллического поля
Теория кристаллического поля Основні класи неорганічних сполук
Основні класи неорганічних сполук Искусственная радиоактивность. Ядерное оружие и его поражающие факторы
Искусственная радиоактивность. Ядерное оружие и его поражающие факторы Проведение лабораторных анализов образцов почвы
Проведение лабораторных анализов образцов почвы Основания. Получение и химические свойства
Основания. Получение и химические свойства Неоднородные системы, их классификация, методы разделения. Лекция 4
Неоднородные системы, их классификация, методы разделения. Лекция 4 Introduction to Periodic Table
Introduction to Periodic Table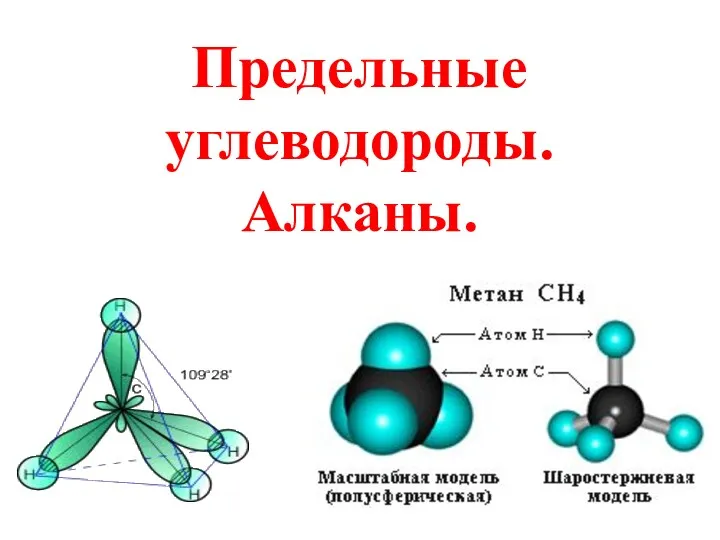 Предельные углеводороды. Алканы
Предельные углеводороды. Алканы Лекция как один из методов обучения химии на старшей ступени общего образования. Методика ее подготовки и чтения
Лекция как один из методов обучения химии на старшей ступени общего образования. Методика ее подготовки и чтения Номенклатура алканов
Номенклатура алканов Химия: основные понятия. Периодическая система химических элементов Д. И. Менделеева
Химия: основные понятия. Периодическая система химических элементов Д. И. Менделеева Кристаллическое строение и свойства металлов
Кристаллическое строение и свойства металлов Алюминий и его соединения
Алюминий и его соединения Интегрированный урок по химии и немецкому языку “Anwendung Hydrolyse von Wasser”
Интегрированный урок по химии и немецкому языку “Anwendung Hydrolyse von Wasser” Тканые армирующие материалы
Тканые армирующие материалы Щелочноземельные металлы Положение в периодической таблице
Щелочноземельные металлы Положение в периодической таблице Химические волокна (7 класс)
Химические волокна (7 класс) Многоатомные спирты
Многоатомные спирты Спирты
Спирты Типы химических реакций
Типы химических реакций Алены. Строение, изомерия, номенклатура
Алены. Строение, изомерия, номенклатура Игра по химии по теме Атомы химических элементов. Простые вещества
Игра по химии по теме Атомы химических элементов. Простые вещества Моторные масла
Моторные масла Периодическая система элементов Д. И. Менделеева. IA группа
Периодическая система элементов Д. И. Менделеева. IA группа Запобігання виникнення горіння засобами, що розбавлюють та інгібують
Запобігання виникнення горіння засобами, що розбавлюють та інгібують NaCl или поваренная соль (плюсы и минусы)
NaCl или поваренная соль (плюсы и минусы) Щелочи
Щелочи