Содержание
- 2. План презентации. Общая характеристика; Строение атома; Физические свойства; Химические свойства; Получение; Нахождение в природе; Применение. Цезий
- 3. Общая характеристика элементов. Металлы главной подгруппы первой группы - литий, натрий, калий, рубидий, цезий и франций.
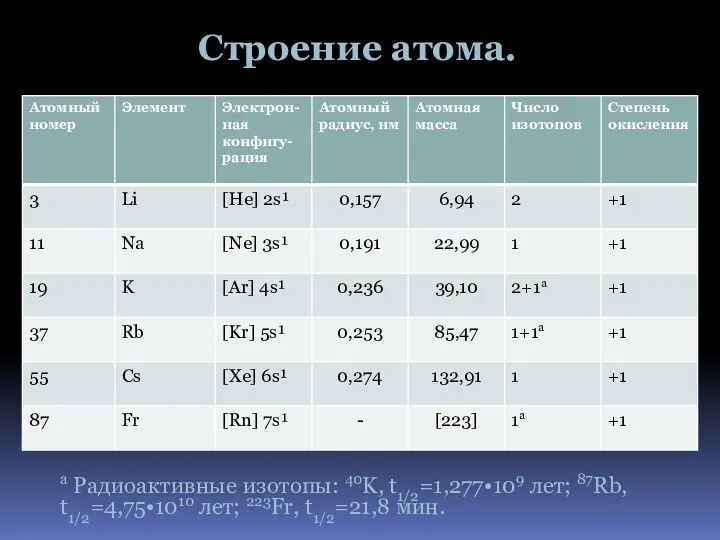
- 4. Строение атома. а Радиоактивные изотопы: 40K, t1/2=1,277•109 лет; 87Rb, t1/2=4,75•1010 лет; 223Fr, t1/2=21,8 мин.
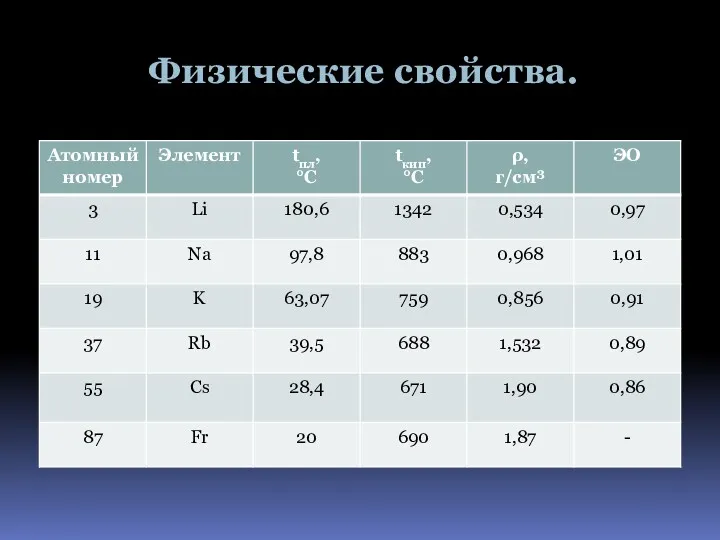
- 5. Физические свойства.
- 6. Химические свойства. Из-за высокой химической активности щелочных металлов по отношению к воде, кислороду, и иногда даже
- 7. 1.Взаимодействие с водой. Важное свойство щелочных металлов — их высокая активность по отношению к воде. Наиболее
- 8. 2.Взаимодействие с кислородом. Продукты горения щелочных металлов на воздухе имеют разный состав в зависимости от активности
- 9. Все кислородные соединения имеют различную окраску, интенсивность которой увеличивается в ряду от Li до Cs:
- 10. Оксиды щелочных металлов обладают всеми свойствами, присущими основным оксидам: они реагируют с водой, кислотными оксидами и
- 11. 3. Взаимодействие с другими веществами. Щелочные металлы реагируют со многими неметаллами. При нагревании они соединяются с
- 12. 4. Качественное определение щелочных металлов. Поскольку потенциалы ионизации щелочных металлов невелики, то при нагревании металла или
- 13. Получение. 1. Электролиз расплавов их галогенидов: 2 LiCl → 2 Li + Cl2↑ 2. Электролиз расплавов
- 14. Нахождение в природе. Ортоклаз K2[Al2Si6O16] Альбит Na2[Al2Si6O16]
- 15. Применение. По своему действию на организм соли щелочных металлов можно разделить на 2 группы: щелочные, например
- 17. Скачать презентацию










![Нахождение в природе. Ортоклаз K2[Al2Si6O16] Альбит Na2[Al2Si6O16]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/296448/slide-13.jpg)

 Многоатомные спирты
Многоатомные спирты Моторные масла
Моторные масла Обмен липидов
Обмен липидов Детонаційна стійкість бензину
Детонаційна стійкість бензину Етери та естери
Етери та естери Вода. 8 класс
Вода. 8 класс Методы определения механических свойств полимерных композиционных материалов
Методы определения механических свойств полимерных композиционных материалов Химическая связь
Химическая связь Производные хинолина и хинуклидина, производные 4-замещенных хинолина
Производные хинолина и хинуклидина, производные 4-замещенных хинолина Основные постулаты квантовой механики
Основные постулаты квантовой механики Классификация нефтей и товарных нефтепродуктов. Основные свойства нефтепродуктов
Классификация нефтей и товарных нефтепродуктов. Основные свойства нефтепродуктов Алканы нефти. Содержание алканов в нефтяных фракциях
Алканы нефти. Содержание алканов в нефтяных фракциях Углеводородное сырье для промышленности органических веществ. Лекция 1. Часть 1
Углеводородное сырье для промышленности органических веществ. Лекция 1. Часть 1 Атоми, молекули, йони, хімічні елементи, їхні назви й символи. Урок 10
Атоми, молекули, йони, хімічні елементи, їхні назви й символи. Урок 10 Полимеры
Полимеры Металлы и неметаллы
Металлы и неметаллы Амины, аминокислоты; состав, получение, значение, применение
Амины, аминокислоты; состав, получение, значение, применение Теория электролитической диссоциации (ТЭД), ионные уравнения
Теория электролитической диссоциации (ТЭД), ионные уравнения Химическая технология органических веществ
Химическая технология органических веществ Полимеры. Полимерные материалы
Полимеры. Полимерные материалы Аномальные свойства воды
Аномальные свойства воды Генетическая связь между классами неорганических соединений. Урок 1
Генетическая связь между классами неорганических соединений. Урок 1 Геохимия. Геохимическая система элементов
Геохимия. Геохимическая система элементов Минеральные удобрения
Минеральные удобрения Чистые вещества и смеси
Чистые вещества и смеси Амины. Анилин
Амины. Анилин Кислотно-основное титрование
Кислотно-основное титрование Азот и его соединения
Азот и его соединения