Содержание
- 2. Нахождение аминов в природе Амины широко распространены в природе, так как образуются при гниении живых организмов.
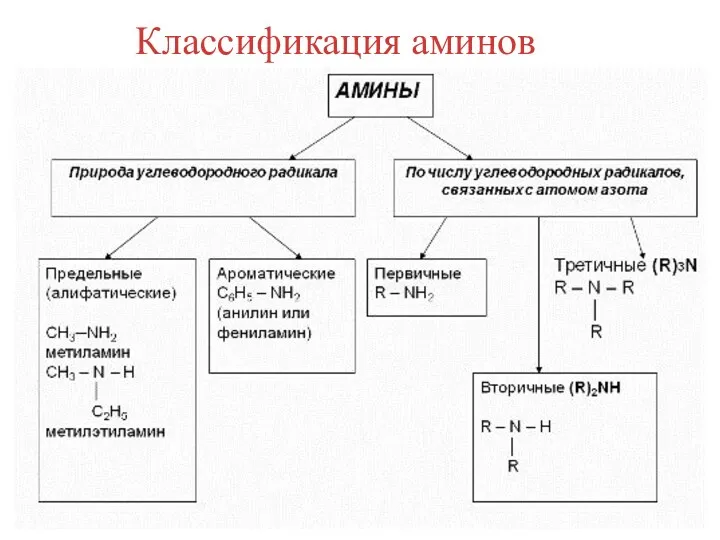
- 3. Классификация аминов
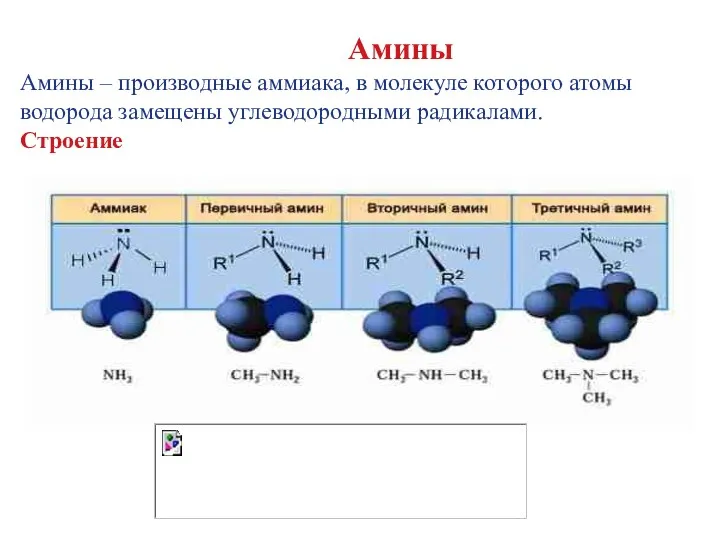
- 4. Амины Амины – производные аммиака, в молекуле которого атомы водорода замещены углеводородными радикалами. Строение
- 5. Номенклатура
- 6. Изомерия 1. Углеродного скелета. 2. Положения аминогруппы. 3. Первичные, вторичные и третичные изомерны друг другу в
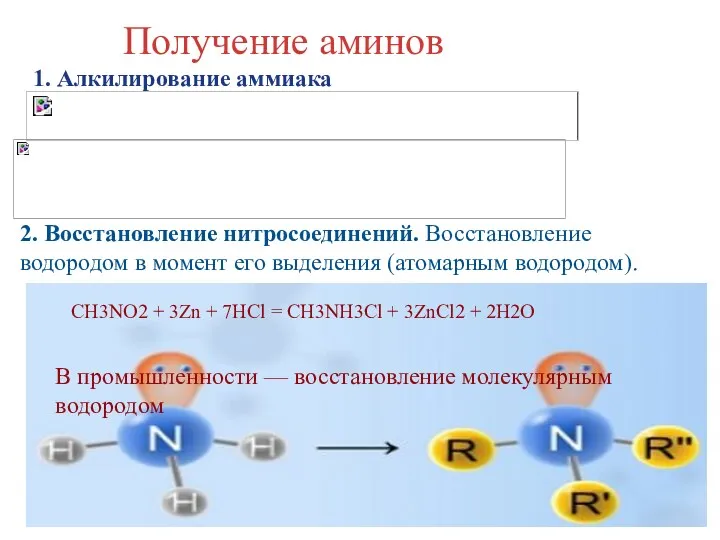
- 7. Получение аминов 1. Алкилирование аммиака 2. Восстановление нитросоединений. Восстановление водородом в момент его выделения (атомарным водородом).
- 8. 3. Аммонолиз спиртов, промышленный способ 4. Воздействие щелочами на соли аминов
- 9. Химические свойства аминов Амины проявляют основные свойства 1. С водой 2. С галогеналканами
- 10. 3. С кислотами. По аналогии с аммиаком. С2Н5NH2 + HCl = C2H5NH3Cl (хлорид этиламмония) 4. С
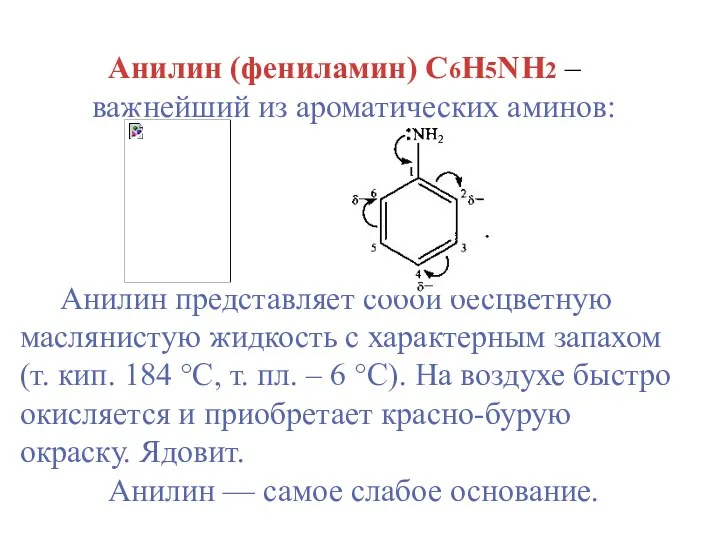
- 11. Анилин (фениламин) С6H5NH2 – важнейший из ароматических аминов: Анилин представляет собой бесцветную маслянистую жидкость с характерным
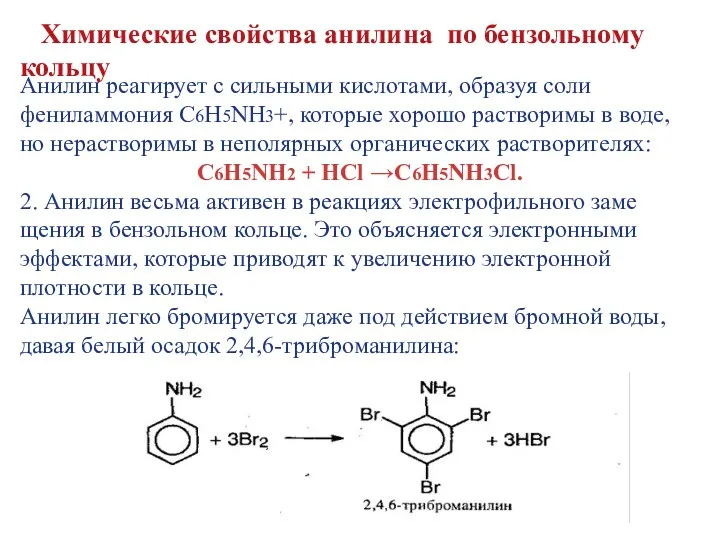
- 12. Анилин реагирует с сильными кислотами, образуя соли фениламмония C6H5NH3+, которые хорошо растворимы в воде, но нерастворимы
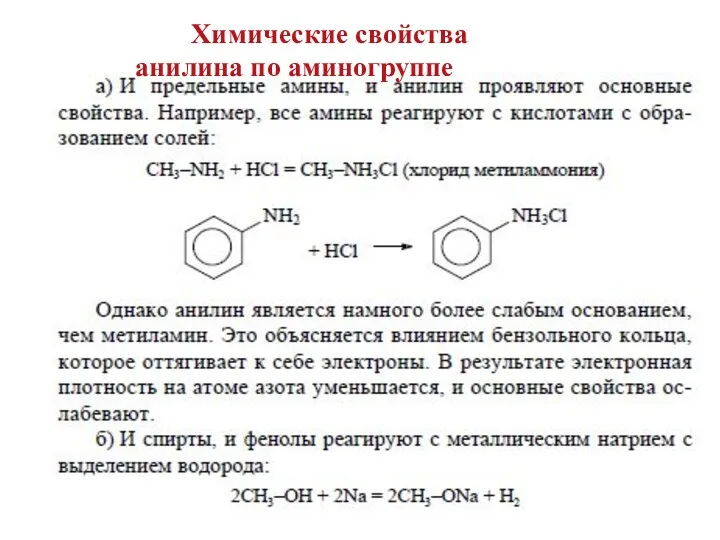
- 13. Химические свойства анилина по аминогруппе
- 14. Производство и применение Изначально анилин получали восстановлением нитробензола молекулярным водородом; практический выход анилина не превышал 15
- 15. В мире основная часть производимого анилина используется для производства метилдиизоцианатов, используемых затем для производства полиуретанов. Анилин
- 16. Токсичные свойства Анилин оказывает негативное воздействие на центральную нервную систему. Вызывает кислородное голодание организма за счёт
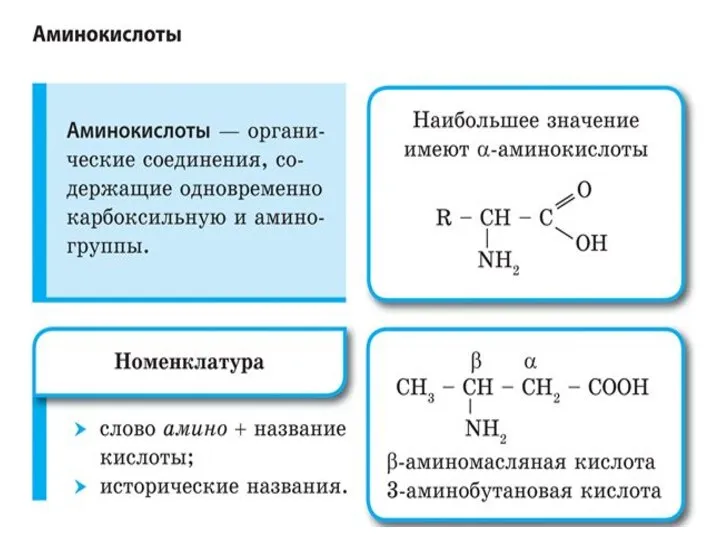
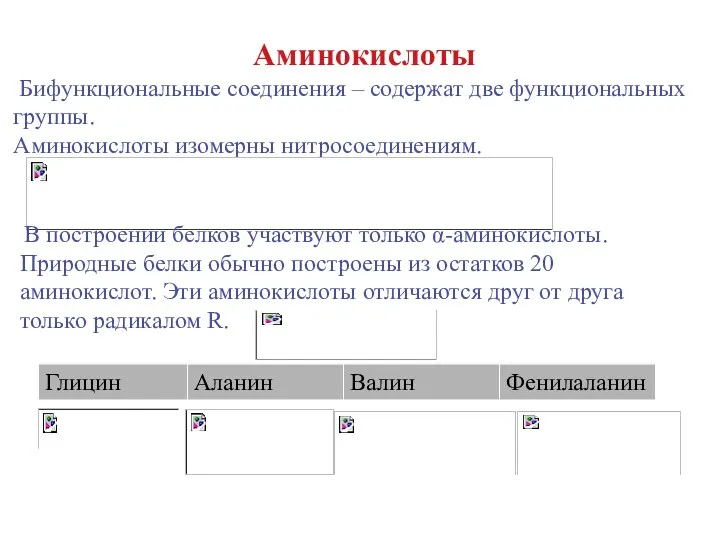
- 18. Аминокислоты Бифункциональные соединения – содержат две функциональных группы. Аминокислоты изомерны нитросоединениям. В построении белков участвуют только
- 19. Получение 1. Гидролиз природных белков. 2. Синтетический способ.
- 20. Химические свойства Аминокислоты – амфотерные соединения, проявляют как кислотные, так и основные свойства. Свойства карбоксильной группы
- 21. 5. Со спиртами Свойства аминогруппы – основные свойства С кислотами Особые свойства Поликонденсация. Взаимодействие друг с
- 22. Применение 1) аминокислоты широко распространены в природе; 2) молекулы аминокислот – это те кирпичики, из которых
- 23. В первую очередь, аминокислоты необходимы для того, чтобы из них синтезировались белки, входящие в состав органов
- 24. Кроме этого, аминокислоты необходимы для полноценной работы головного мозга, являясь предшественниками нейромедиаторов, или даже выполняя их
- 27. Скачать презентацию














 Стронций
Стронций Аминокислоты, как структурные компоненты белков
Аминокислоты, как структурные компоненты белков Свойства растворов и гетерогенных систем
Свойства растворов и гетерогенных систем Феноли (бензенол)
Феноли (бензенол) Номенклатура органических веществ
Номенклатура органических веществ Подгруппа углерода
Подгруппа углерода Физико-химические процессы переработки нефти. Термические процессы
Физико-химические процессы переработки нефти. Термические процессы Основания - свойства ТЭД
Основания - свойства ТЭД Растворы. Способы выражения концентрации растворенного вещества
Растворы. Способы выражения концентрации растворенного вещества Благородные металлы
Благородные металлы Титанның химиялық элементі
Титанның химиялық элементі Основные физико-химические свойства нефти и нефтепродуктов
Основные физико-химические свойства нефти и нефтепродуктов Золь-гель технология. Прорыв XXI века
Золь-гель технология. Прорыв XXI века Химическое равновесие. Смещение химического равновесия
Химическое равновесие. Смещение химического равновесия Період як особлива синтаксична конструкція
Період як особлива синтаксична конструкція Переохлажденные жидкости и их применение. Процесс кристаллизации
Переохлажденные жидкости и их применение. Процесс кристаллизации Макро- и микроэлементы
Макро- и микроэлементы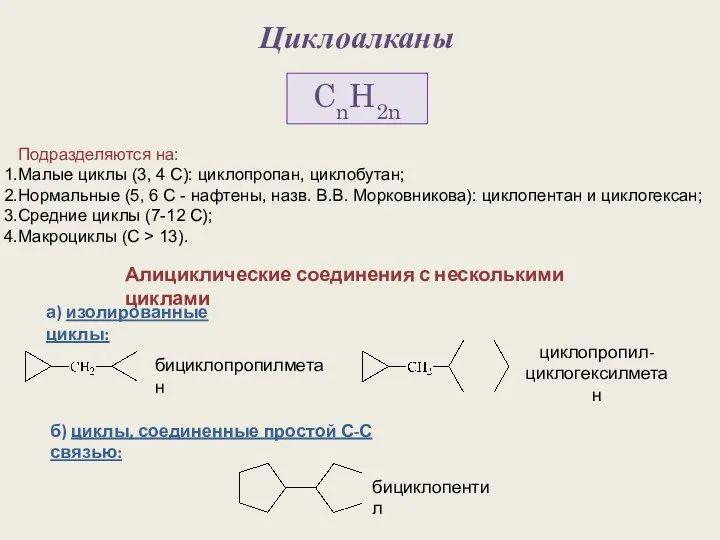 Циклоалканы. Строение алициклов
Циклоалканы. Строение алициклов Периодическая система Д.И. Менделеева и строение атома
Периодическая система Д.И. Менделеева и строение атома Кислородные соединения азота
Кислородные соединения азота Кислородсодержащие органические соединения. Лабораторная работа
Кислородсодержащие органические соединения. Лабораторная работа Аминокислоты и белки. 9 класс
Аминокислоты и белки. 9 класс Катионы IV, V, VI аналитических групп
Катионы IV, V, VI аналитических групп Физико-химические свойства поливинилового спирта и поливинилформаля
Физико-химические свойства поливинилового спирта и поливинилформаля Определение нефтепродуктов в воде с использованием Флюората-02-5М
Определение нефтепродуктов в воде с использованием Флюората-02-5М Поверхностно-активные вещества и их роль
Поверхностно-активные вещества и их роль Способи очищення води
Способи очищення води Щелочи
Щелочи