Содержание
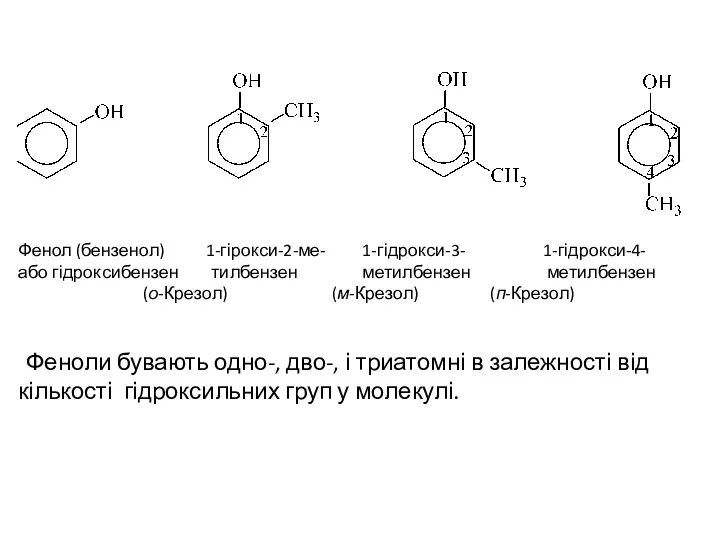
- 2. Фенол (бензенол) 1-гірокси-2-ме- 1-гідрокси-3- 1-гідрокси-4- або гідроксибензен тилбензен метилбензен метилбензен (о-Крезол) (м-Крезол) (п-Крезол) Феноли бувають одно-,
- 3. ОДНОАТОМНІ ФЕНОЛИ СПОСОБИ ОДЕРЖАННЯ 1. Виділення з продуктів коксування кам'яного вугілля. При коксуванні кам'яного вугілля утворюється
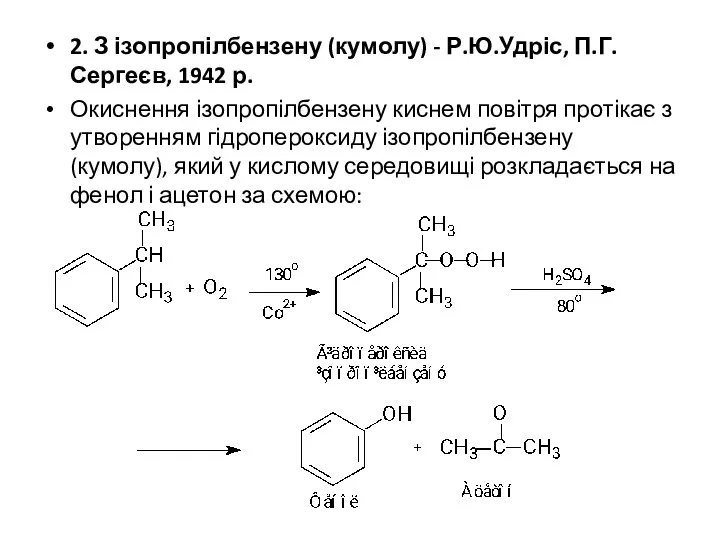
- 4. 2. З ізопропілбензену (кумолу) - Р.Ю.Удріс, П.Г.Сергеєв, 1942 р. Окиснення ізопропілбензену киснем повітря протікає з утворенням
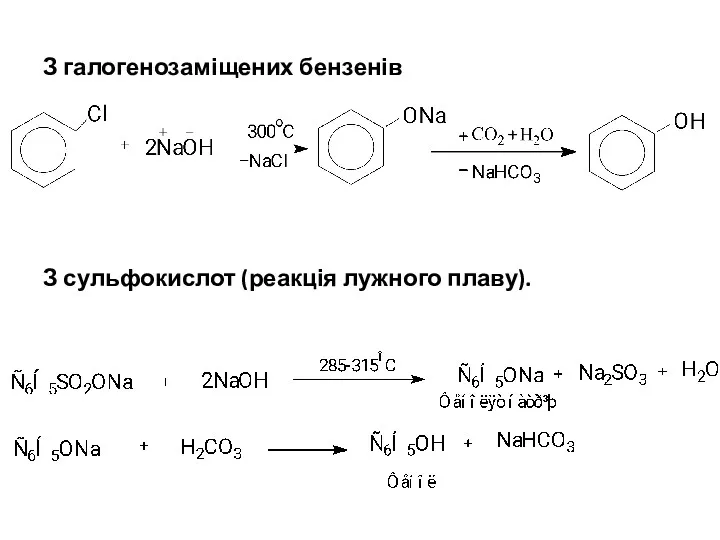
- 5. З галогенозаміщених бензенів З сульфокислот (реакція лужного плаву).
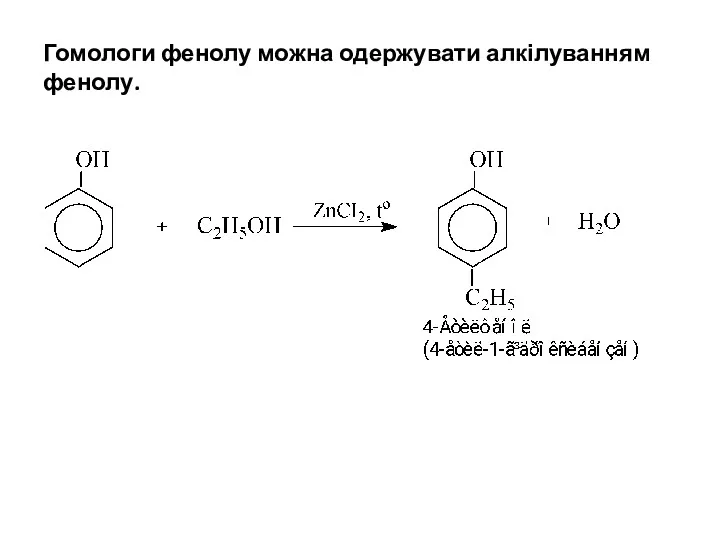
- 6. Гомологи фенолу можна одержувати алкілуванням фенолу.
- 7. ФІЗИЧНІ ТА ХІМІЧНІ ВЛАСТИВОСТІ Одноатомні феноли - кристалічні речовини. Вони помірно розчинні у воді, переганяються з
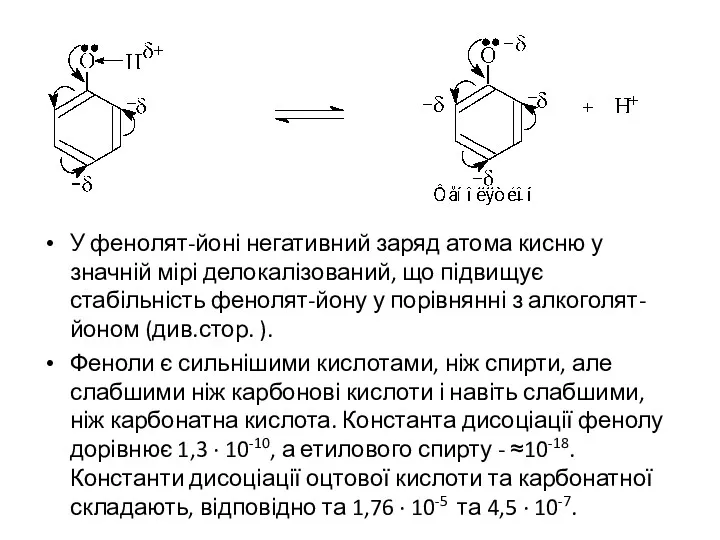
- 8. У фенолят-йоні негативний заряд атома кисню у значній мірі делокалізований, що підвищує стабільність фенолят-йону у порівнянні
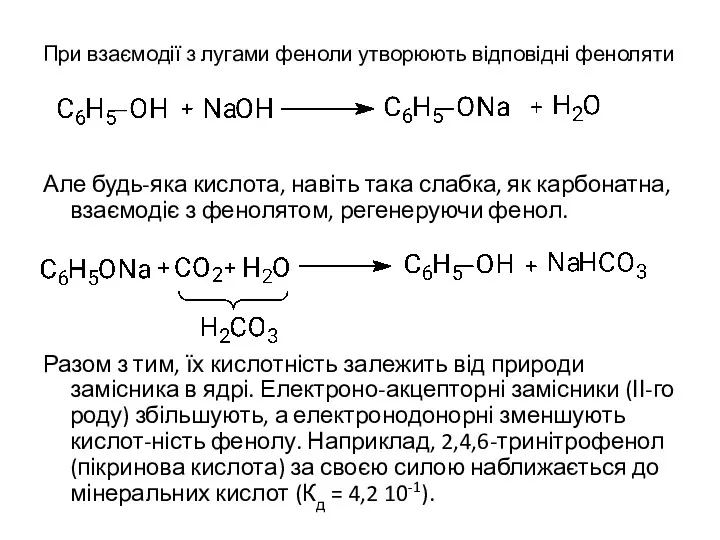
- 9. При взаємодії з лугами феноли утворюють відповідні феноляти Але будь-яка кислота, навіть така слабка, як карбонатна,
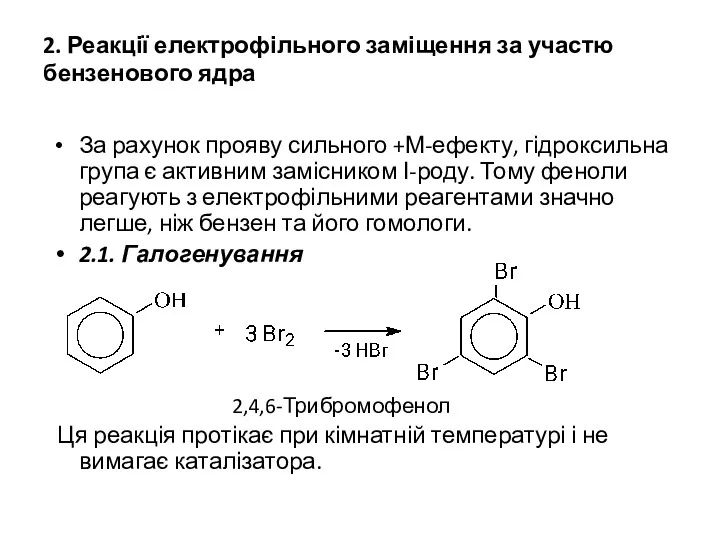
- 10. 2. Реакції електрофільного заміщення за участю бензенового ядра За рахунок прояву сильного +М-ефекту, гідроксильна група є
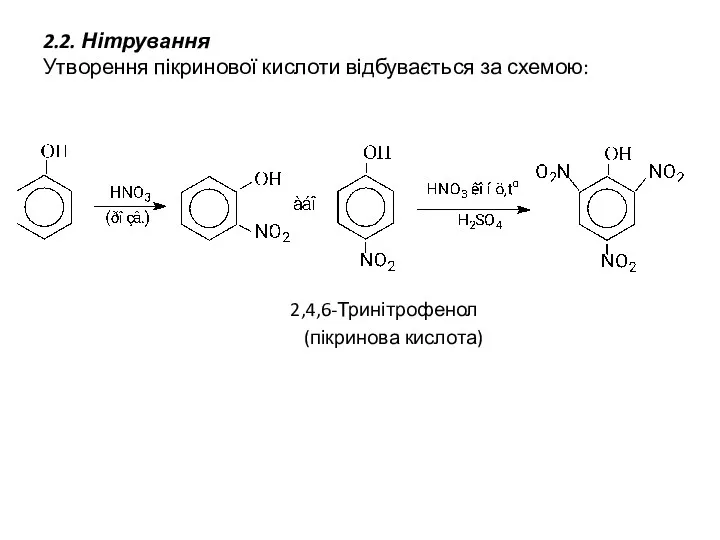
- 11. 2.2. Нітрування Утворення пікринової кислоти відбувається за схемою: 2,4,6-Тринітрофенол (пікринова кислота)
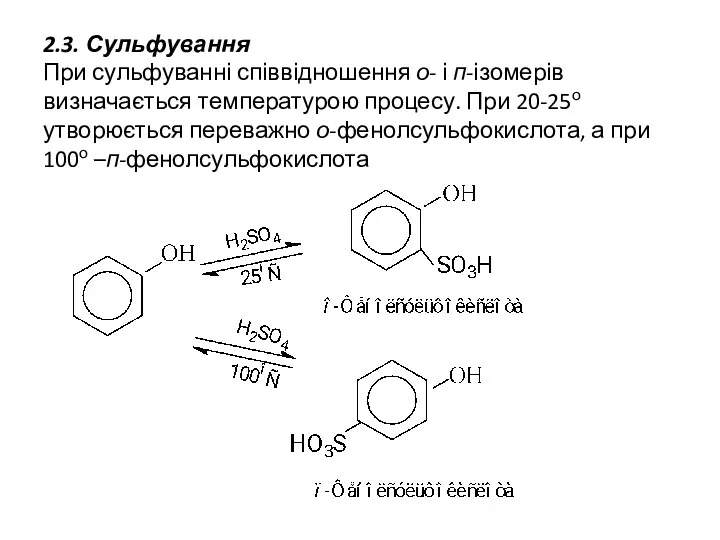
- 12. 2.3. Сульфування При сульфуванні співвідношення о- і п-ізомерів визначається температурою процесу. При 20-25о утворюється переважно о-фенолсульфокислота,
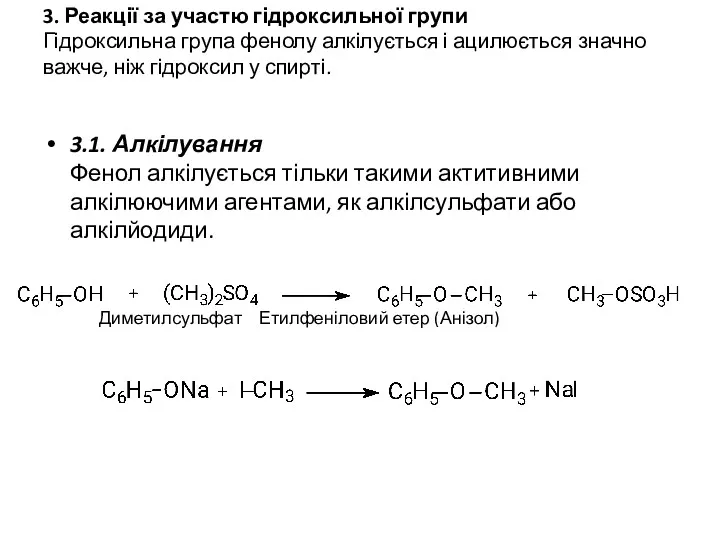
- 13. 3. Реакції за участю гідроксильної групи Гідроксильна група фенолу алкілується і ацилюється значно важче, ніж гідроксил
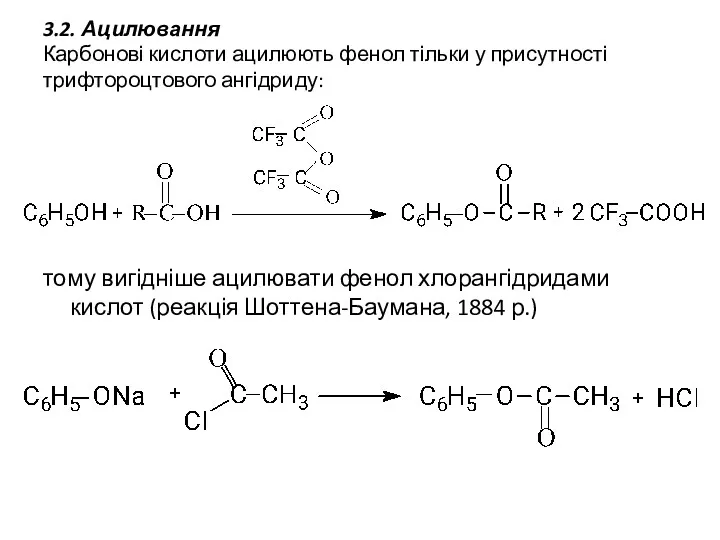
- 14. 3.2. Ацилювання Карбонові кислоти ацилюють фенол тільки у присутності трифтороцтового ангідриду: тому вигідніше ацилювати фенол хлорангідридами
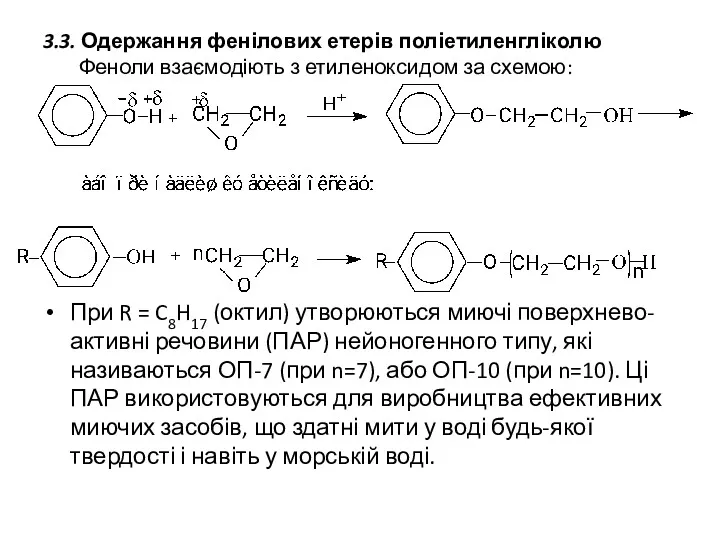
- 15. 3.3. Одержання фенілових етерів поліетиленгліколю Феноли взаємодіють з етиленоксидом за схемою: При R = C8H17 (октил)
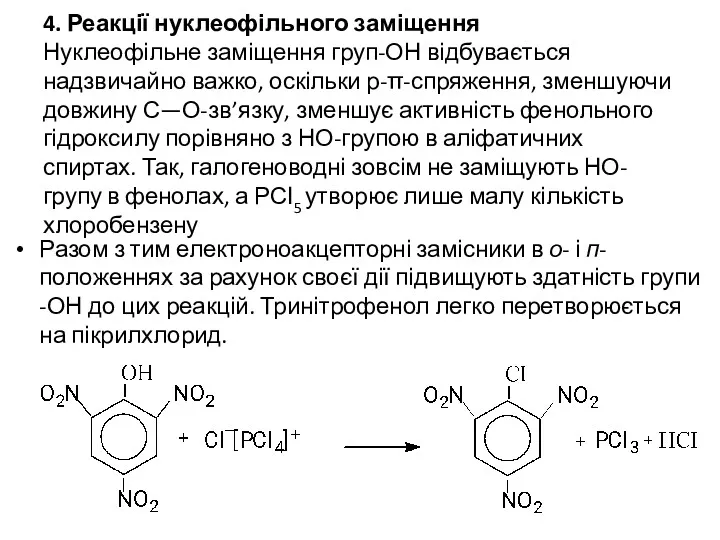
- 16. 4. Реакції нуклеофільного заміщення Нуклеофільне заміщення груп-ОН відбувається надзвичайно важко, оскільки р-π-спряження, зменшуючи довжину С—О-зв’язку, зменшує
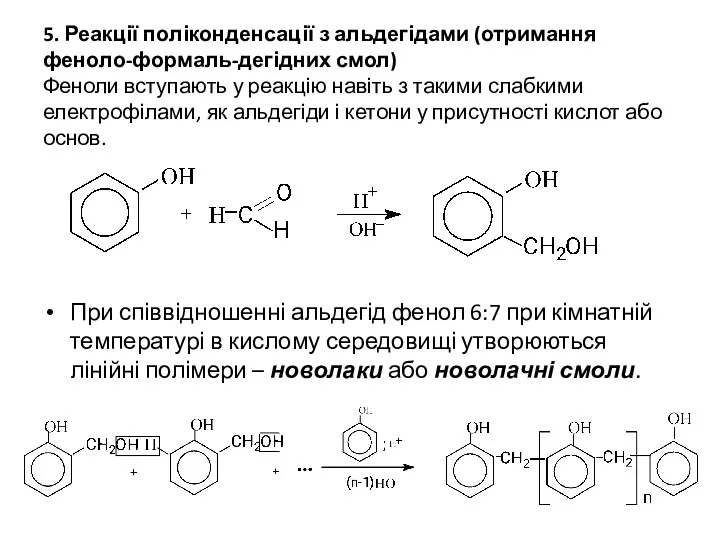
- 17. 5. Реакції поліконденсації з альдегідами (отримання феноло-формаль-дегідних смол) Феноли вступають у реакцію навіть з такими слабкими
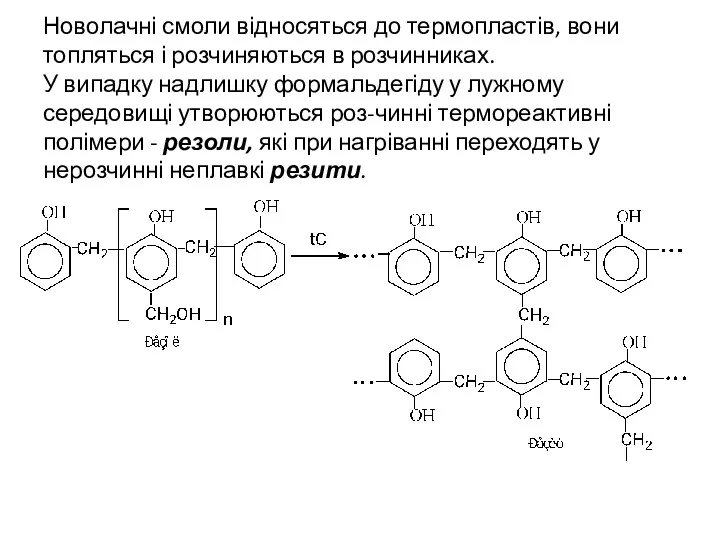
- 18. Новолачні смоли відносяться до термопластів, вони топляться і розчиняються в розчинниках. У випадку надлишку формальдегіду у
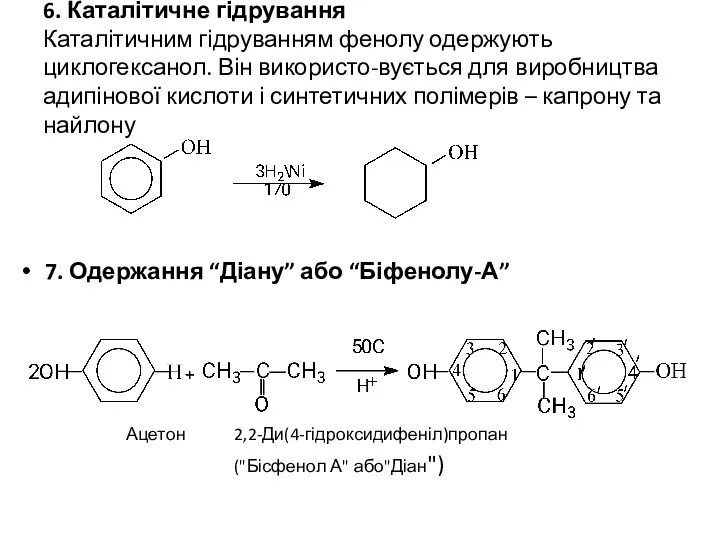
- 19. 6. Каталітичне гідрування Каталітичним гідруванням фенолу одержують циклогексанол. Він використо-вується для виробництва адипінової кислоти і синтетичних
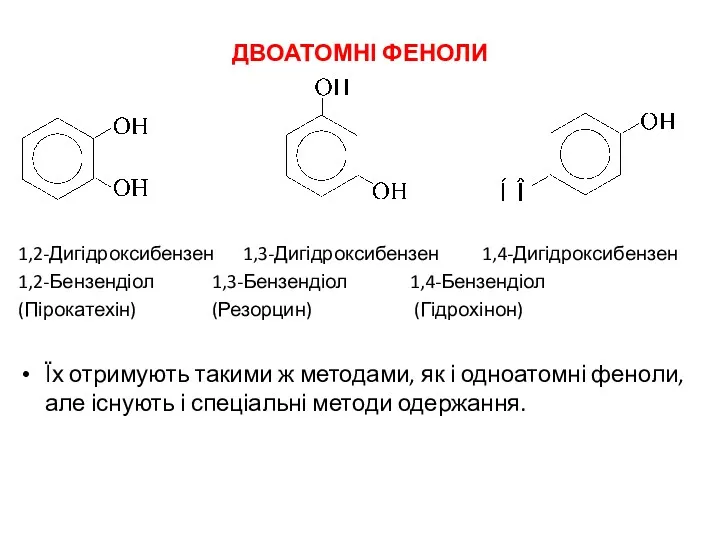
- 20. ДВОАТОМНІ ФЕНОЛИ 1,2-Дигідроксибензен 1,3-Дигідроксибензен 1,4-Дигідроксибензен 1,2-Бензендіол 1,3-Бензендіол 1,4-Бензендіол (Пірокатехін) (Резорцин) (Гідрохінон) Їх отримують такими ж методами,
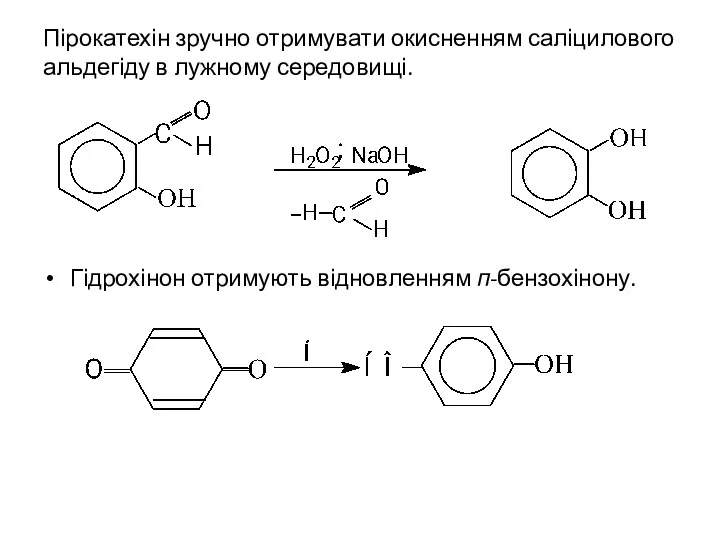
- 21. Пірокатехін зручно отримувати окисненням саліцилового альдегіду в лужному середовищі. Гідрохінон отримують відновленням п-бензохінону.
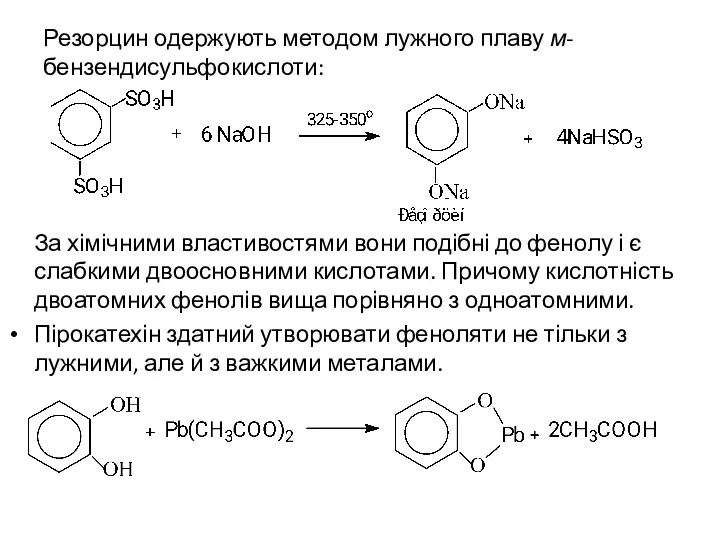
- 22. Резорцин одержують методом лужного плаву м-бензендисульфокислоти: За хімічними властивостями вони подібні до фенолу і є слабкими
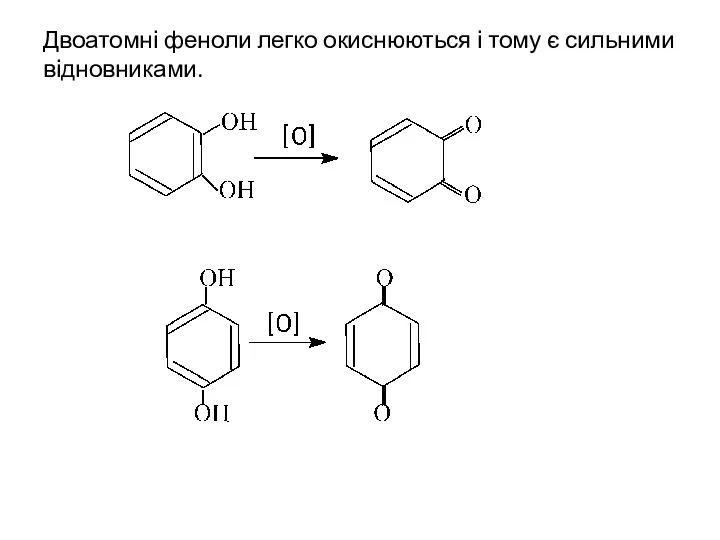
- 23. Двоатомні феноли легко окиснюються і тому є сильними відновниками.
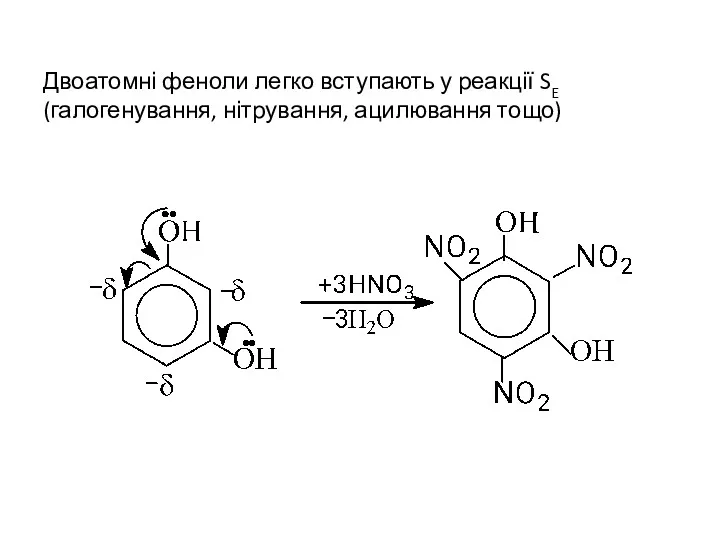
- 24. Двоатомні феноли легко вступають у реакції SE (галогенування, нітрування, ацилювання тощо)
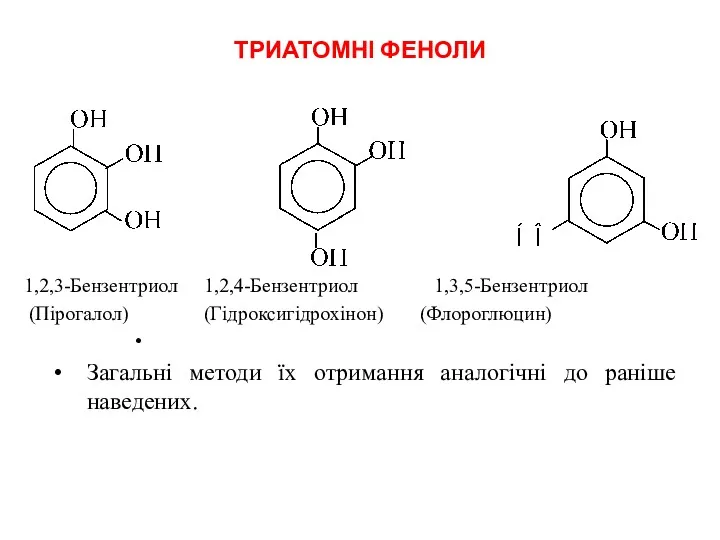
- 25. ТРИАТОМНІ ФЕНОЛИ 1,2,3-Бензентриол 1,2,4-Бензентриол 1,3,5-Бензентриол (Пірогалол) (Гідроксигідрохінон) (Флороглюцин) Загальні методи їх отримання аналогічні до раніше наведених.
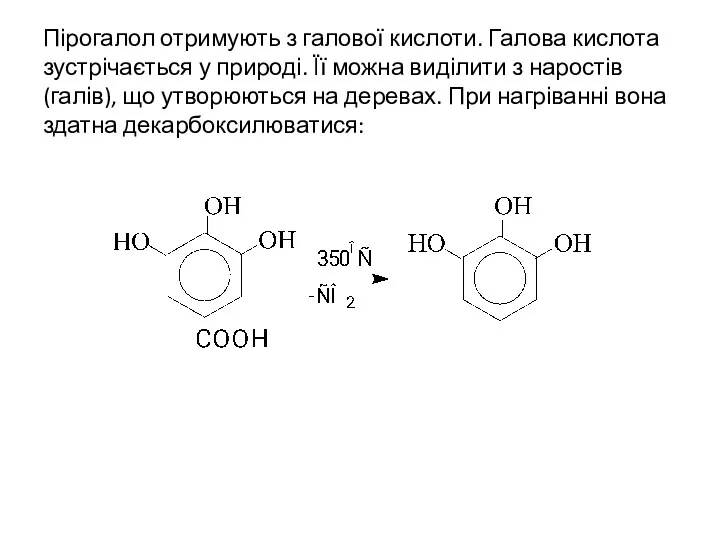
- 26. Пірогалол отримують з галової кислоти. Галова кислота зустрічається у природі. Її можна виділити з наростів (галів),
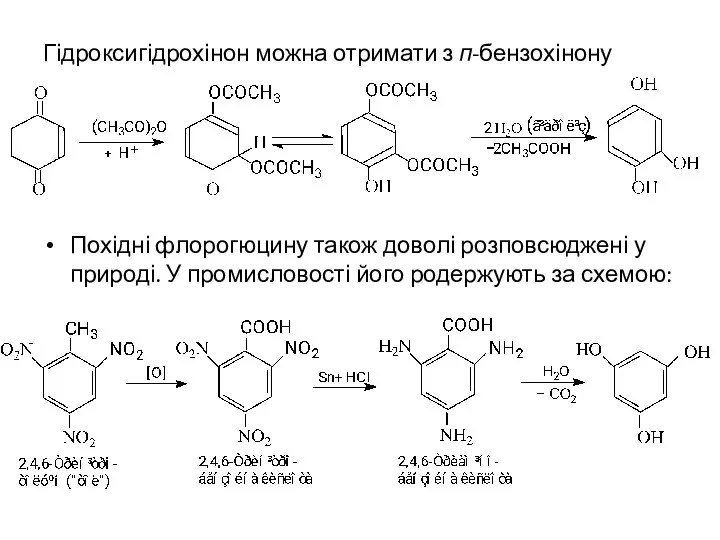
- 27. Гідроксигідрохінон можна отримати з п-бензохінону Похідні флорогюцину також доволі розповсюджені у природі. У промисловості його родержують
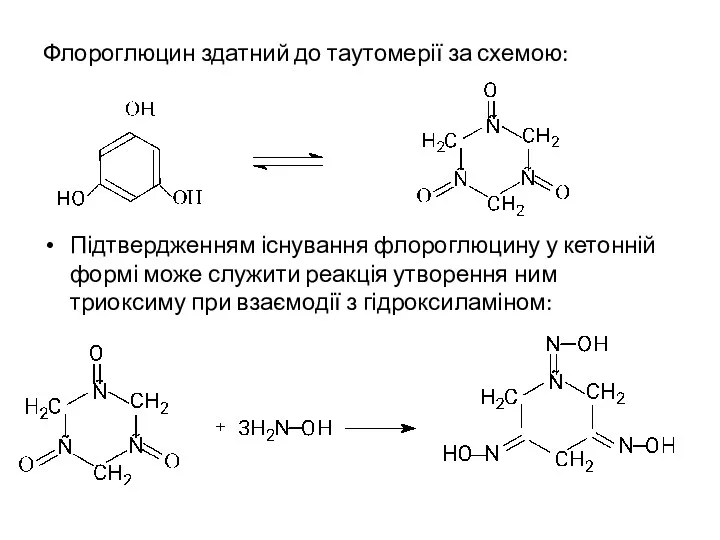
- 28. Флороглюцин здатний до таутомерії за схемою: Підтвердженням існування флороглюцину у кетонній формі може служити реакція утворення
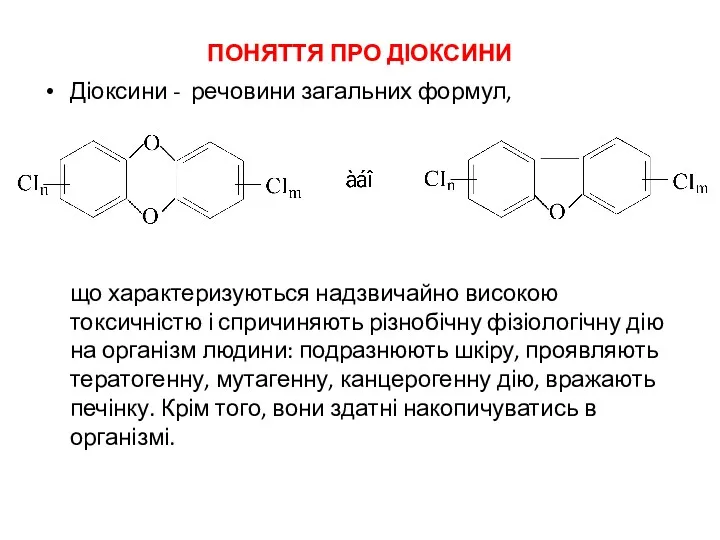
- 29. ПОНЯТТЯ ПРО ДІОКСИНИ Діоксини - речовини загальних формул, що характеризуються надзвичайно високою токсичністю і спричиняють різнобічну
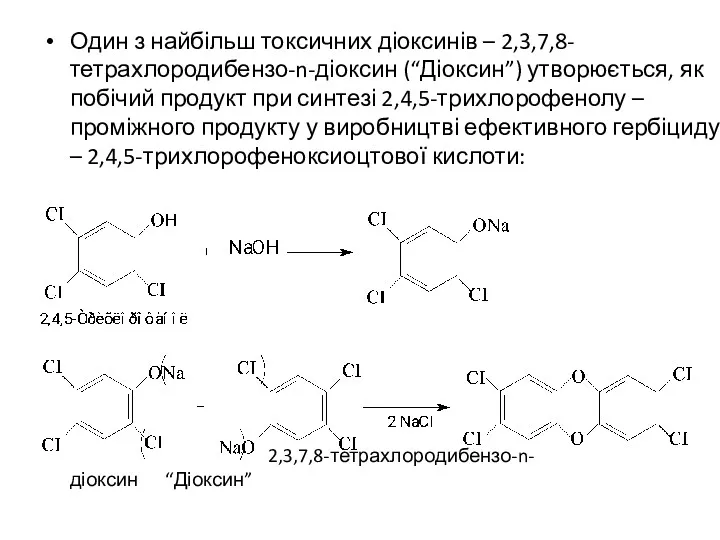
- 30. Один з найбільш токсичних діоксинів – 2,3,7,8-тетрахлородибензо-n-діоксин (“Діоксин”) утворюється, як побічий продукт при синтезі 2,4,5-трихлорофенолу –
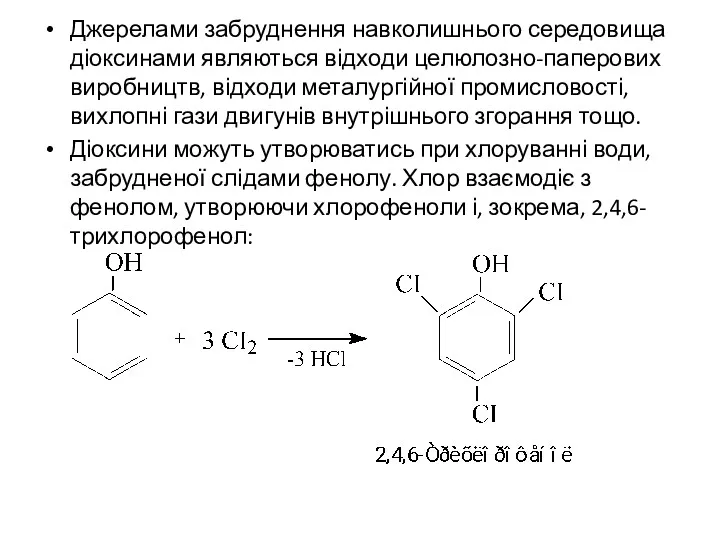
- 31. Джерелами забруднення навколишнього середовища діоксинами являються відходи целюлозно-паперових виробництв, відходи металургійної промисловості, вихлопні гази двигунів внутрішнього
- 33. Скачать презентацию


 Типовые процессы технологии неорганических веществ. (Тема 3)
Типовые процессы технологии неорганических веществ. (Тема 3) Кислородсодержащие соединения. Ароматические соединения
Кислородсодержащие соединения. Ароматические соединения Электрохимические процессы. Лекция 7
Электрохимические процессы. Лекция 7 Электрохимическая коррозии. Катодные процессы электрохимической коррозии
Электрохимическая коррозии. Катодные процессы электрохимической коррозии Типы химических соединений, номенклатура, свойства
Типы химических соединений, номенклатура, свойства Водород. Положение в периодической системе
Водород. Положение в периодической системе Водород. Общая характеристика, нахождение в природе. Получение и физические свойства
Водород. Общая характеристика, нахождение в природе. Получение и физические свойства Группа веществ, изолируемых из биологического материала дистилляцией
Группа веществ, изолируемых из биологического материала дистилляцией Коррозия металлов. Классификация коррозионных процессов
Коррозия металлов. Классификация коррозионных процессов Complex compounds
Complex compounds Углеводороды. Применение природных источников углеводородов и продуктов их переработки
Углеводороды. Применение природных источников углеводородов и продуктов их переработки Водород. Получение и свойства водорода
Водород. Получение и свойства водорода Основи. Гідроксиди Натрію і Кальцію
Основи. Гідроксиди Натрію і Кальцію Неметаллы. Уменьшение радиусов атомов
Неметаллы. Уменьшение радиусов атомов Альдегиды и кетоны
Альдегиды и кетоны Характеристика строения и свойств химических элементов
Характеристика строения и свойств химических элементов Хроматография. Классификации хроматографических методов
Хроматография. Классификации хроматографических методов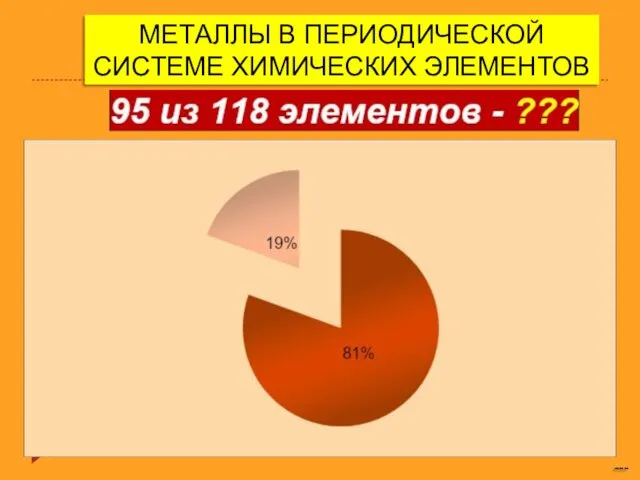 Металлы в периодической системе химических элементов
Металлы в периодической системе химических элементов Объёмная доля компонента смеси
Объёмная доля компонента смеси Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) Законы химии. Классы неорганических соединений
Законы химии. Классы неорганических соединений Трансформация энергии в процессе оксигенного фотосинтеза
Трансформация энергии в процессе оксигенного фотосинтеза Горение топлива
Горение топлива Строение атома. Лекция 2
Строение атома. Лекция 2 Ағзаның барлық жасушасындағы белок алмасу. Аминқышқылдарының дезаминденуі, пурин және пиримидиндердің ыдырауынан
Ағзаның барлық жасушасындағы белок алмасу. Аминқышқылдарының дезаминденуі, пурин және пиримидиндердің ыдырауынан Щелочные металлы. Периодическая система химических элементов Д.И. Менделеева
Щелочные металлы. Периодическая система химических элементов Д.И. Менделеева Композиты на основе полибензоксазинов
Композиты на основе полибензоксазинов Оксиды. Названия оксидов
Оксиды. Названия оксидов