Содержание
- 2. ОСНОВНАЯ ЛИТЕРАТУРА Глинка Н.Л. Общая химия. М.: Интеграл-Пресс, 2006. - 728с. Глинка Н.Л. Задачи и упражнения
- 3. Химия- наука о превращениях веществ, связанных с изменением электронного окружения атомных ядер Значение химии: Агропромышленность и
- 6. Атомно - молекулярное учение. 1. Вещества состоят из молекул. Молекула - наименьшая частица вещества, обладающая его
- 7. Химический элемент - это вид атомов, характеризующийся определенными зарядами ядер и строением электронных оболочек. В настоящее
- 8. Атомное ядро - центральная часть атома, состоящая из протонов (Z) и нейтронов (N), в которой сосредоточена
- 9. Атомы могут соединяться между собой не только в различных соотношениях, но и различным образом. Поэтому число
- 10. Международная единица атомных масс равна 1/12 массы изотопа 12C - основного изотопа природного углерода. 1 а.е.м
- 11. Составление химических уравнений Включает три этапа: 1.Запись формул веществ, вступивших в реакцию (слева) и продуктов реакции
- 12. Закон сохранения массы веществ (М.В.Ломоносов, 1748 г.; А.Лавуазье, 1789 г.) Масса всех веществ, вступивших в химическую
- 14. Закон постоянства состава (впервые сформулировал Ж.Пруст, 1808 г.) Все индивидуальные химические вещества имеют постоянный качественный и
- 15. Закон объемных отношений (Гей-Люссак, 1808 г.) При одинаковых условиях объемы газов, вступающих в химические реакции, и
- 16. Закон Авогадро (1811 г.) В равных объемах любых газов, взятых при одинаковых условиях (температура, давление и
- 17. Уравнение Клайперона-Менделеева Молярные массы газов вычисляют по уравнению состояния идеальных газов: pV= (m / M) RT
- 19. Химическая формула - это условная запись состава вещества с помощью химических знаков (предложены в 1814 г.
- 20. Для вычисления степени окисления элемента в соединении следует исходить из следующих положений: 1. Степень окисления элемента
- 21. количество катионов (+) = количеству анионов (–) Задание: рассчитать степень окисления атома азота в соединениях KNО2
- 22. Простые вещества. Молекулы состоят из атомов одного вида (атомов одного элемента). В химических реакциях не могут
- 23. Простые вещества Неметаллы (молекулы кислорода (O2), N2, H2, F2, Cl2, Br2, I2,) Углерод (C) Сера (S8)
- 24. ОКСИДЫ – это бинарные соединения, состоящие из атомов химического элемента и кислорода ( в степени окисления
- 25. Номенклатура оксидов В настоящее время общепринятой является международная номенклатура оксидов (в соотвествии с номенклатурой ИЮПАК). ОКСИД
- 26. Получение оксидов 1. Взаимодействие простых и сложных веществ с кислородом: CH4 + 2O2 = CO2 +
- 27. ХИМИЧЕСКИЕ СВОЙСТВА ОКСИДОВ сплавление
- 28. Основания – это сложные вещества, в которых атомы металлов соединены с одной или несколькими гидроксильными группами
- 29. НОМЕНКЛАТУРА ОСНОВАНИЙ Получение оснований 1. Реакции активных металлов ( щелочных и щелочноземельных металлов) с водой: 2Na
- 30. ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ
- 31. Кислоты – это сложные вещества, содержащие атомы водорода, способные замещаться атомами металла, и кислотный остаток (Ac)
- 32. НОМЕНКАТУРА КИСЛОТ БЕСКИСЛОРОДНЫЕ КИСЛОТЫ (Н+1nЭ-n) Э + [o] + водородная кислота HCl – хлороводородная кислота HF
- 33. Получение кислот 1. Взаимодействие кислотного оксида с водой (для кислородсодержащих кислот): SO3 + H2O = H2SO4
- 34. Химические свойства кислот
- 35. СОЛИ сложные вещества, которые являются продуктами замещения атомов водорода в молекулах кислот атомами металла Общая формула
- 38. 2. Кислые - продукт неполного замещения атомов водорода многоосновной кислоты на атомы металла. Образование наблюдается при
- 39. 3. Основые – продукт частичного замещения гидроксид-ионов в молекуле основания кислотным остатком. Основные соли могут быть
- 40. 4. Двойные соли состоят из ионов двух разных металлов и кислотного остатка. KNaCO3 – калий натрий
- 41. ПОЛУЧЕНИЕ СРЕДНИХ СОЛЕЙ
- 42. Химические свойства средних солей Ряд активности металлов (электрохимический ряд напряжения металлов Li K Ba Sr Ca
- 44. Общие химические свойства и способы получения основных классов неорганических веществ
- 46. Скачать презентацию






























![НОМЕНКАТУРА КИСЛОТ БЕСКИСЛОРОДНЫЕ КИСЛОТЫ (Н+1nЭ-n) Э + [o] + водородная](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/321163/slide-31.jpg)












 Общая характеристика неметаллов
Общая характеристика неметаллов Химическая кинетика. Основные закономерности протекания химических реакций (лекция 5)
Химическая кинетика. Основные закономерности протекания химических реакций (лекция 5) Теория электролитической диссоциации
Теория электролитической диссоциации Группа веществ, изолируемых полярными растворителями
Группа веществ, изолируемых полярными растворителями Химиялық элементтердің тірі және өлі табиғатта таралуы
Химиялық элементтердің тірі және өлі табиғатта таралуы Особенности органических веществ. 9 класс
Особенности органических веществ. 9 класс Тұндыру әдістері
Тұндыру әдістері ВКР: Изучение золей на основе железа и марганца, полученных методом химической конденсации
ВКР: Изучение золей на основе железа и марганца, полученных методом химической конденсации Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов
Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов Химияны оқыту әдістері
Химияны оқыту әдістері Нефть и способы её переработки
Нефть и способы её переработки Элементы группы галогенов
Элементы группы галогенов Теория сильных и слабых электролитов
Теория сильных и слабых электролитов Витамины. Ашылу тарихы
Витамины. Ашылу тарихы Хімічні елементи, їхні назви і символи. Поширеність хімічних елементів у природі
Хімічні елементи, їхні назви і символи. Поширеність хімічних елементів у природі Ion exchange
Ion exchange Синтетические органические вещества
Синтетические органические вещества Игровая программа по химии Самый умный. Химические свойства оксидов, оснований, кислот и солей
Игровая программа по химии Самый умный. Химические свойства оксидов, оснований, кислот и солей Простые вещества - неметаллы. 8 класс
Простые вещества - неметаллы. 8 класс Сложные эфиры. Жиры
Сложные эфиры. Жиры Периодический закон химических элементов Д. И. Менделеева и периодическая система
Периодический закон химических элементов Д. И. Менделеева и периодическая система Алюминий и его соединения
Алюминий и его соединения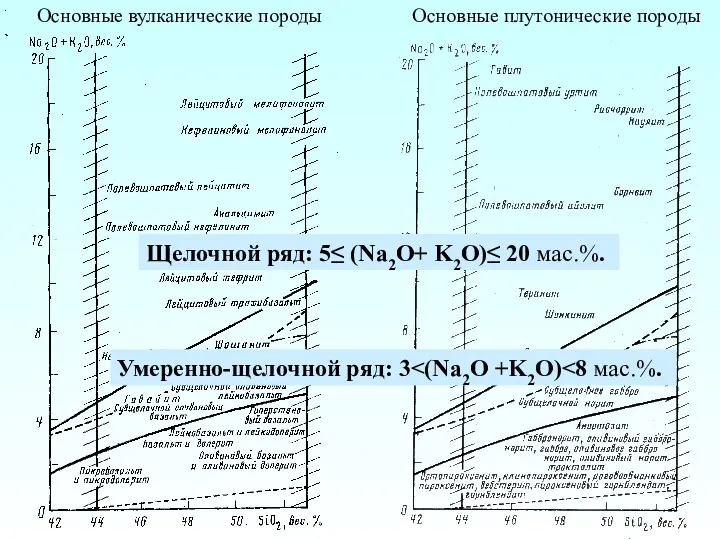 Основные вулканические породы. Основные плутонические породы
Основные вулканические породы. Основные плутонические породы Газоподібна і тверда фаза грунту. Методи аналізу зернового складу
Газоподібна і тверда фаза грунту. Методи аналізу зернового складу Аммиак. Образование молекулы аммиака
Аммиак. Образование молекулы аммиака Кислоты и их свойства
Кислоты и их свойства Сложные эфиры
Сложные эфиры Використання натуральних та штучних добавок при виготовленні харчових продукцій
Використання натуральних та штучних добавок при виготовленні харчових продукцій