Содержание
- 2. Менделеев Дмитрий Иванович Русский ученый-энциклопедист. Родился 27 января (8 февраля) 1834 в Тобольске. Менделеев был членом
- 3. Периодический закон и строение атома До открытия Д.И. Менделеева было сделано много попыток классификации и систематизации
- 4. Историческая справка В 1829 году немецкий ученый Д. В. Деберейнер, профессор химии, технологии и фармакологии университета
- 5. Периодический закон Д.И. Менделеева. Открыт в 1869 г. великим русским ученым Д.М. Менделеевым. В работе «Периодическая
- 6. Физический смысл порядкового номера в периодической системе определил Мозли. Закон Мозли: корень из частоты рентгеновского спектра
- 7. Современная формулировка периодического закона химических элементов: Химические свойства элементов находятся в периодической зависимости от заряда ядра
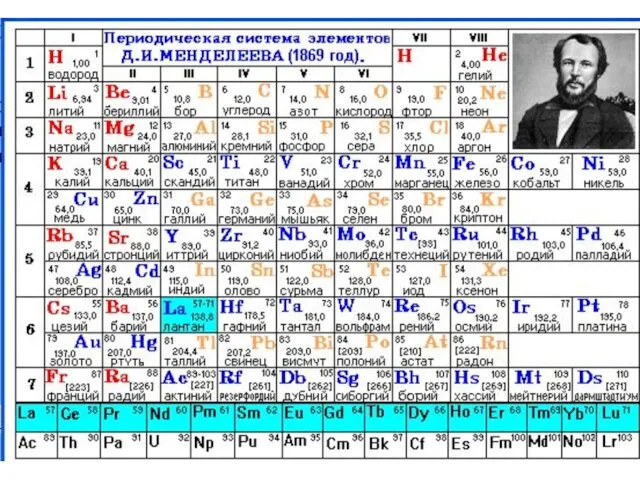
- 8. Периодическая система химических элементов – это система, классификация химических элементов, основанная на периодическом законе. Периодическая таблица
- 9. Периодическая система и периодическая таблица химических элементов
- 10. Периодическая система и периодическая таблица химических элементов Длинная ПТ (32-х клеточная) – все элементы каждого периода
- 12. Связь электронной конфигурации атома элемента с положением в ПС Порядковый номер элемента соответствует заряду ядра атома
- 13. Периоды (горизонтальные ряды) пронумерованы - от 1 до 7. Номер периода соответствует числу электронных слоев в
- 14. В короткой периодической системе все элементы составляют 7 периодов. Первый период включает 2 элемента - водород
- 15. Группы (колонки) обозначаются римскими цифрами - от I до VIII. Каждая группа делится на две подгруппы:
- 16. В таблице 8 главных и 8 побочных подгрупп: всего 16. Элементы семейства лантаноидов и актиноидов (по
- 17. Особенности современной периодической системы элементов Благородные газы рассматриваются как VIII A группа. Но только ксенон проявляет
- 18. Основные особенности изменения свойств элементов по периодам Элементы главных подгрупп различаются числом внешних электронов (s и
- 19. Периодически меняющиеся свойства атомов Атомные и ионные радиусы Потенциал ионизации (энергия ионизации) Сродство к электрону Электроотрицательность
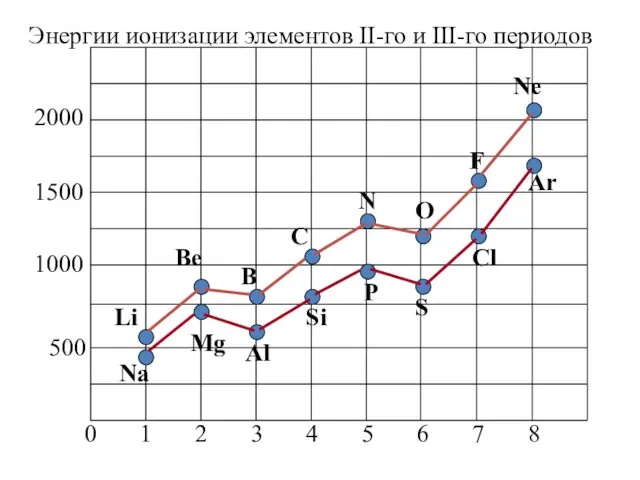
- 20. Периодически меняющиеся свойства атомов Потенциал ионизации Энергия ионизации – энергия, которую необходимо затратить, чтобы удалить из
- 22. Потенциал ионизации По периоду первый ПИ увеличивается, что объясняется увеличением заряда ядра. Однако он изменяется не
- 23. Ионизация переходных d – и f – элементов существенно отличается. Сначала удаляются внешние s – электроны.
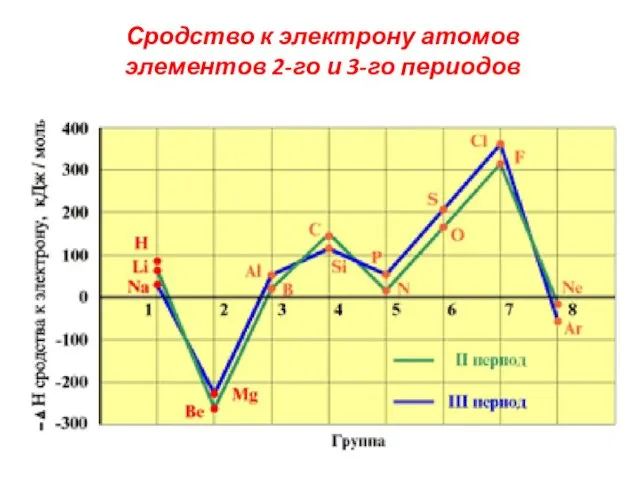
- 24. Сродство к электрону Сродство к электрону (F) – энергия, выделяющаяся при присоединении электрона к свободному атому.
- 25. Сродство к электрону атомов элементов 2-го и 3-го периодов
- 26. Атомный радиус Атомный радиус – условный радиус атома, вычисленный из длин связи этого атома с другими
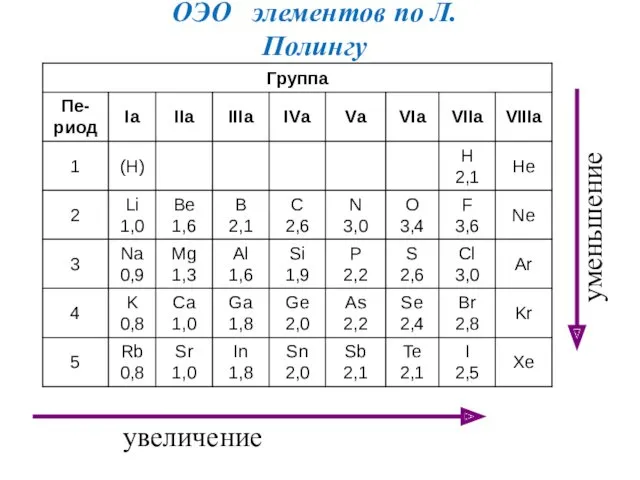
- 27. Электроотрицательность Электроотрицательность (ЭО) атома - способность атома в молекуле притягивать электроны, связывающие его с другими атомами
- 28. Шкала Полинга χ F = ½ (1700+310) = 1005 кДж/моль По Полингу χ Li условно принята
- 29. увеличение уменьшение ОЭО элементов по Л.Полингу
- 31. Скачать презентацию
























 Кислород. Распространение кислорода в природе (8 класс)
Кислород. Распространение кислорода в природе (8 класс) Электролиз веществ
Электролиз веществ Основные понятия и законы химии. Тема1
Основные понятия и законы химии. Тема1 Карбоновые кислоты
Карбоновые кислоты Химические свойства основных классов неорганических веществ
Химические свойства основных классов неорганических веществ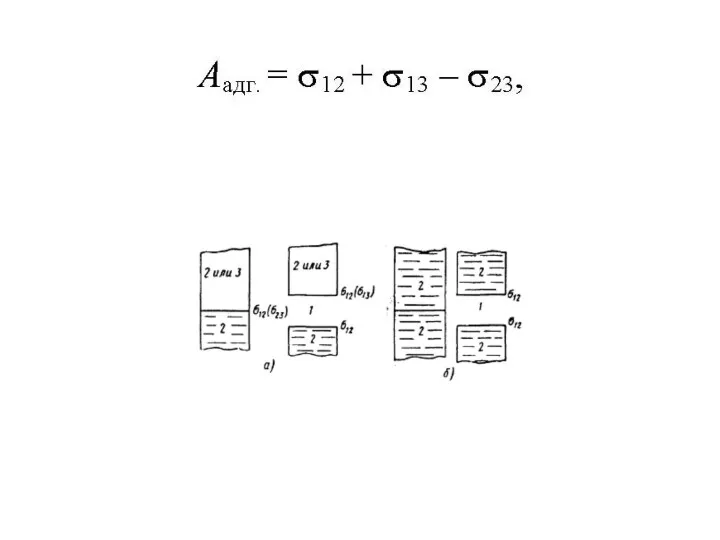 Характер затвердевания
Характер затвердевания Взаимодействия кислорода с металлом
Взаимодействия кислорода с металлом Радиоактивные элементы почв
Радиоактивные элементы почв Сучасні каталізатори у процесах нафтопереробки та нафтохімії
Сучасні каталізатори у процесах нафтопереробки та нафтохімії Металлы применяемые в строительстве
Металлы применяемые в строительстве Окислительно-восстановительные реакции. Основные закономерности окисления различных классов органических веществ
Окислительно-восстановительные реакции. Основные закономерности окисления различных классов органических веществ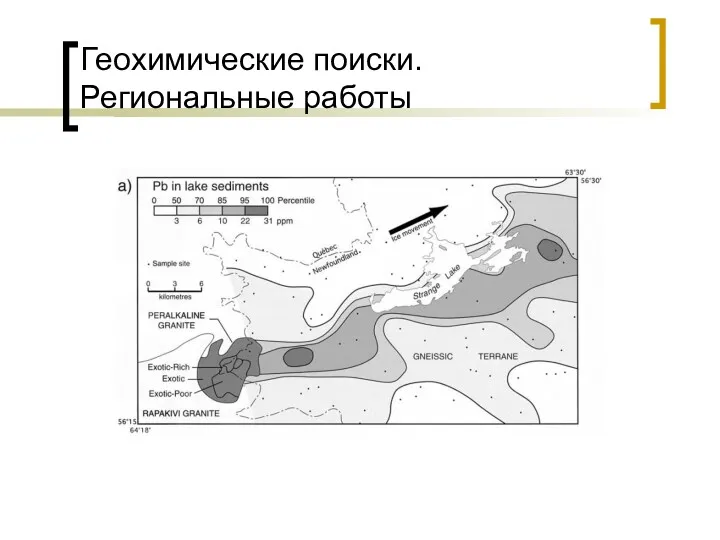 Геохимические поиски. Региональные работы
Геохимические поиски. Региональные работы ЭЛЕКТРОЛИТЫ
ЭЛЕКТРОЛИТЫ Составление формул молекулярных простых веществ
Составление формул молекулярных простых веществ МЕТОДЫ ОЧИСТКИ НЕФТЯНЫХ ФРАКЦИЙ
МЕТОДЫ ОЧИСТКИ НЕФТЯНЫХ ФРАКЦИЙ Приборы и методы исследования в химической технологии
Приборы и методы исследования в химической технологии Полисахариды. Крахмал и целлюлоза
Полисахариды. Крахмал и целлюлоза Электрохимический ряд напряжений металлов
Электрохимический ряд напряжений металлов Важнейшие промышленные синтезы на основе переработки нефти и другого углеводородного сырья
Важнейшие промышленные синтезы на основе переработки нефти и другого углеводородного сырья Сероводород. Сернистый водород, сульфид водорода, дигидросульфид
Сероводород. Сернистый водород, сульфид водорода, дигидросульфид Кислотность и основность органических соединений. (Лекция 3)
Кислотность и основность органических соединений. (Лекция 3) Валентность химических элементов
Валентность химических элементов Составление химических формул бинарных соединений по степени окисления атомов
Составление химических формул бинарных соединений по степени окисления атомов Electroanalytical Chemistry
Electroanalytical Chemistry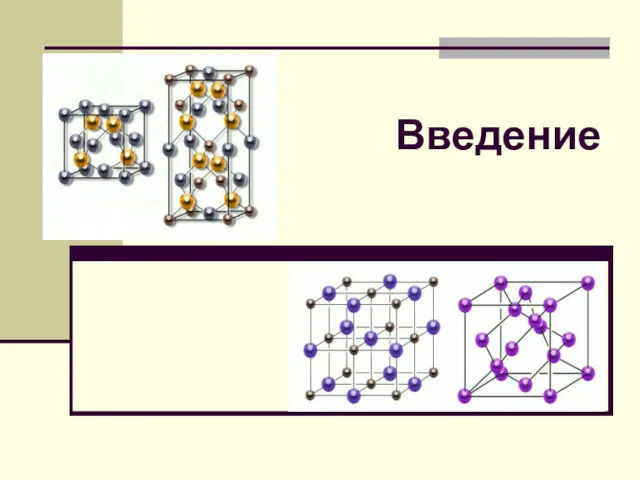 Кристаллохимия как наука
Кристаллохимия как наука IVA группа С, Si, Ge, Sn, Pb (подгруппа титана)
IVA группа С, Si, Ge, Sn, Pb (подгруппа титана) Параметры токсичности продуктов горения материала. (Задача 3)
Параметры токсичности продуктов горения материала. (Задача 3) Природный и попутный нефтяной газы
Природный и попутный нефтяной газы