Содержание
- 2. Электролизом называется окислительно-восстановительное разложение вещества под действием проходящего через него постоянного электрического тока. Процессы, протекающие при
- 3. Электролиза возможен при соблюдении двух условий: 1. Необходима электропроводность вещества, т.е. наличие проводников второго рода (ионов).
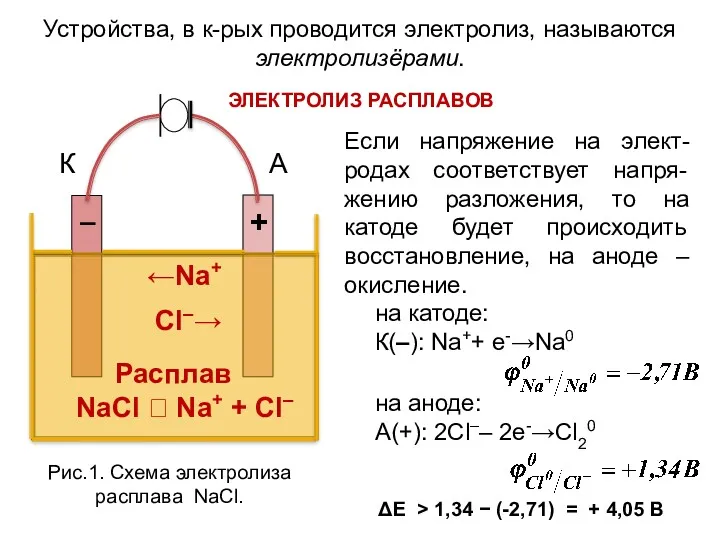
- 4. ←Na+ Cl–→ Расплав NaCl ⮀ Na+ + Cl– Устройства, в к-рых проводится электролиз, называются электролизёрами. ЭЛЕКТРОЛИЗ
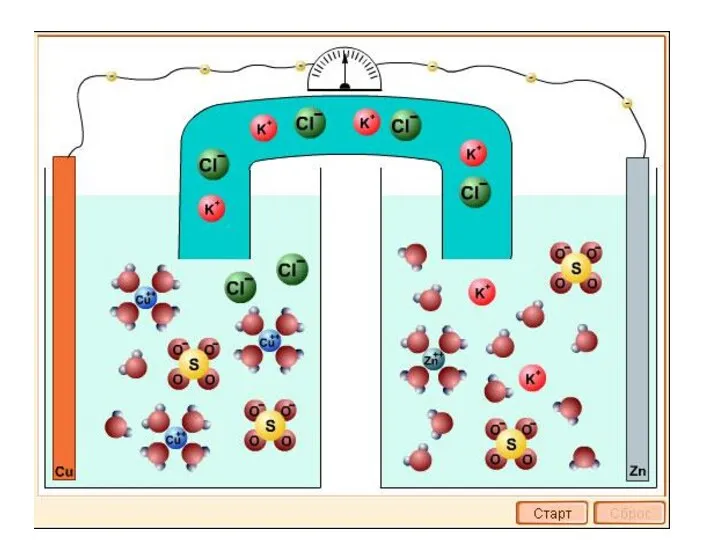
- 5. ЭЛЕКТРОЛИЗ ВОДНЫХ РАСТВОРОВ При электролизе растворов наряду с разложением растворённого вещества возможен и электролиз растворителя. Последовательность
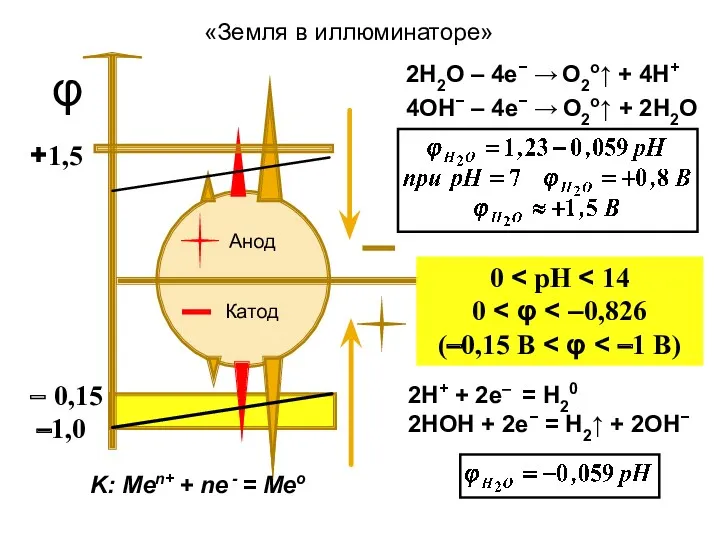
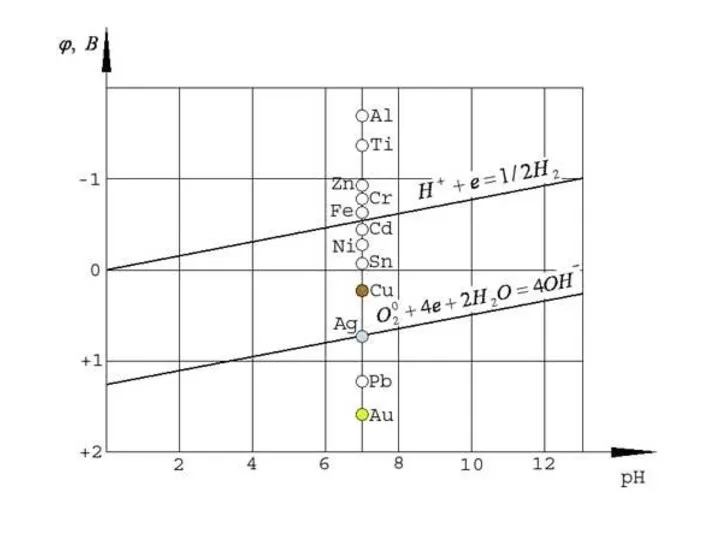
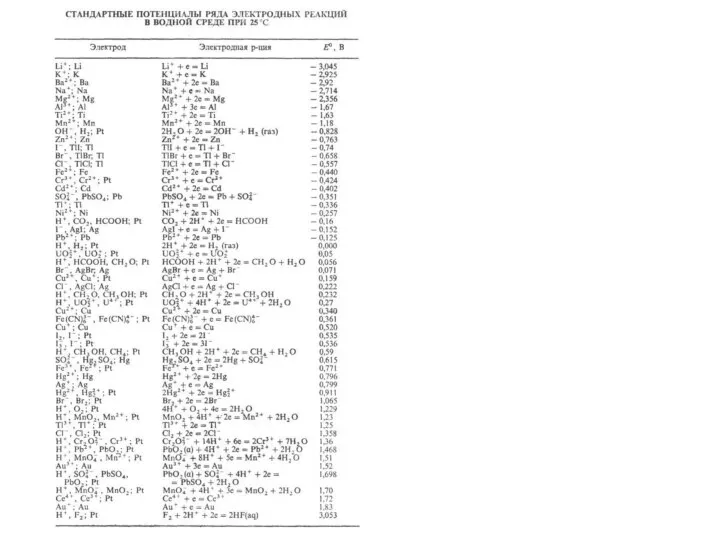
- 7. Анод Катод φ 0 0 (–0,15 B K: Меn+ + nе - = Мео 2Н+ +
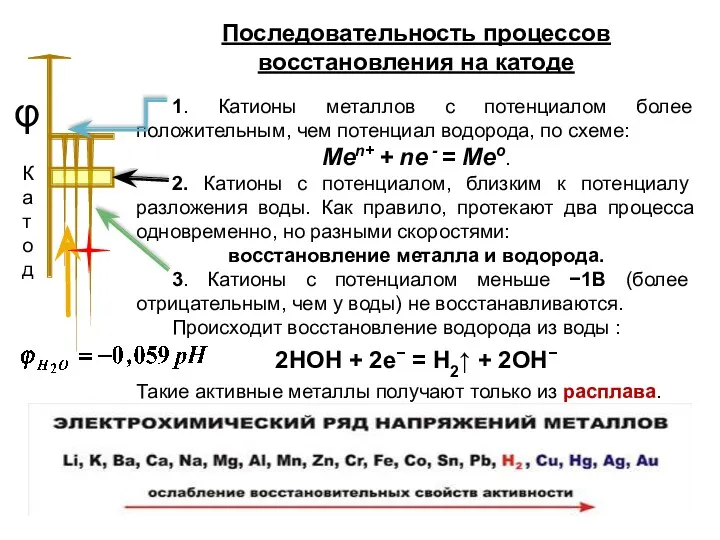
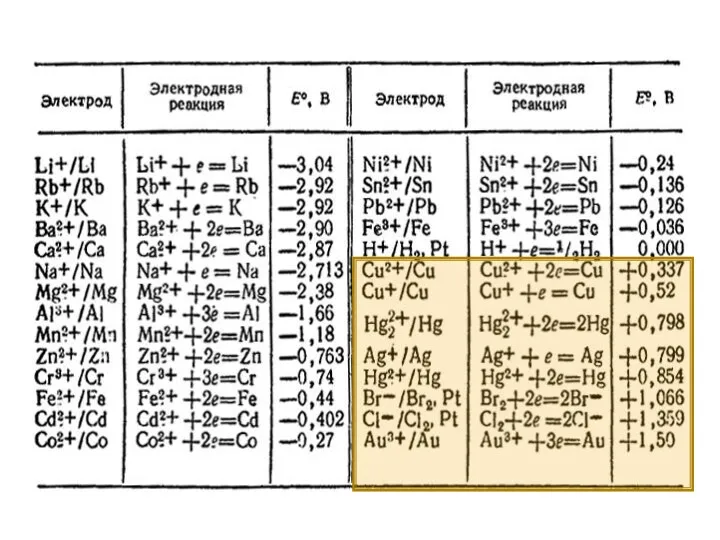
- 9. Последовательность процессов восстановления на катоде 1. Катионы металлов с потенциалом более положительным, чем потенциал водорода, по
- 10. Последовательность процессов окисления на аноде 1. электролиз с растворимым (активным) анодом. Если анод выполнен из активного
- 11. 3. Выделение кислорода при окислении ионов ОН− и воды протекает при отсутствии бескислородных анионов по схеме.
- 12. Законы электролиза (з-ны Фарадея) Количественные закономерности, к-рым подчиняются процессы эл-за, установлены в 1833-1834г.г. М. Фарадеем: Кол-во
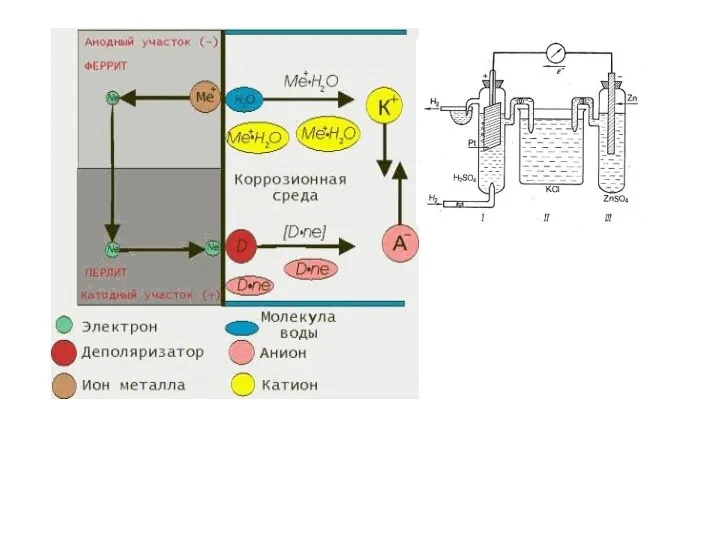
- 13. На практике масса покрытия (mпракт) оказывается ниже теоретически рассчитанной. Объясняется это протеканием разл. побочных процессов, например,
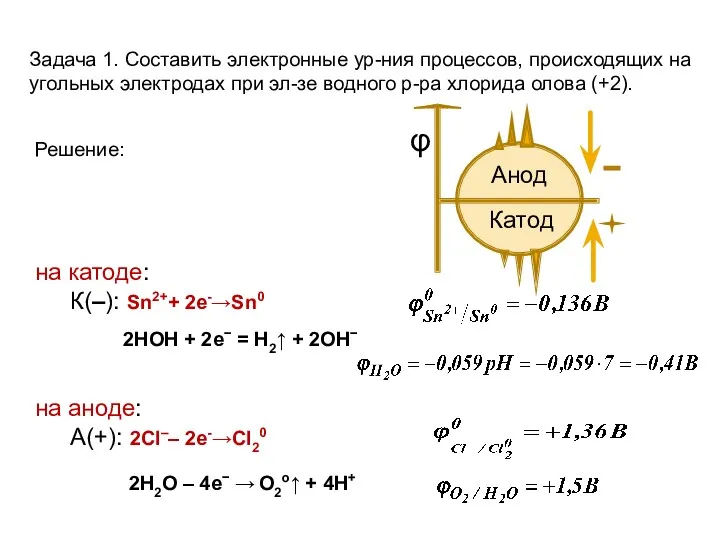
- 14. Задача 1. Составить электронные ур-ния процессов, происходящих на угольных электродах при эл-зе водного р-ра хлорида олова
- 15. Задача 2. Деталь хромируется в водном р-ре сульфата хрома (+3). Определить силу тока, если в течение
- 16. Анод Катод φ
- 25. Скачать презентацию











 Качественные реакции на органические вещества
Качественные реакции на органические вещества Озон
Озон Қарапайым кристалдық құрылымдар
Қарапайым кристалдық құрылымдар Лантаноидтар. Лантаноидтардың қасиеттері
Лантаноидтар. Лантаноидтардың қасиеттері Электрохимические методы анализа
Электрохимические методы анализа Материальный баланс химического реактора. Лекция № 3
Материальный баланс химического реактора. Лекция № 3 Биомакромолекулы. Нуклеиновые кислоты
Биомакромолекулы. Нуклеиновые кислоты Глоссарий
Глоссарий Ароматические углеводороды (Арены)
Ароматические углеводороды (Арены) Kарбонові кислоти. Гетерофункціональні похідні карбонових кислот
Kарбонові кислоти. Гетерофункціональні похідні карбонових кислот Метаболизм нуклеотидов
Метаболизм нуклеотидов Уравнения химических реакций
Уравнения химических реакций Тұнбалар мен қайнатпаларды алу принциптері
Тұнбалар мен қайнатпаларды алу принциптері Vitaminele
Vitaminele Алотропні модифікації фосфору
Алотропні модифікації фосфору Защита от коррозии каменных и бетонных строительных материалов и конструкций
Защита от коррозии каменных и бетонных строительных материалов и конструкций Химические опасности. Токсичные элементы. Мышьяк. Свинец. Ртуть
Химические опасности. Токсичные элементы. Мышьяк. Свинец. Ртуть Век пластмасс
Век пластмасс Техника безопасности на уроках химии
Техника безопасности на уроках химии Химия. 6я группа элементов. 9 класс
Химия. 6я группа элементов. 9 класс Нефтепродукты. Продукты переработки нефти
Нефтепродукты. Продукты переработки нефти Генетичні зв’язки між неорганічними речовинами. Практична робота 2
Генетичні зв’язки між неорганічними речовинами. Практична робота 2 Алкены. Химия
Алкены. Химия Относительная молекулярная масса
Относительная молекулярная масса Растворы. Дисперсные системы. Термодинамика процесса растворения. (Лекция 2)
Растворы. Дисперсные системы. Термодинамика процесса растворения. (Лекция 2) Бытовая химия в нашем доме и альтернативные способы уборки
Бытовая химия в нашем доме и альтернативные способы уборки Азотистая кислота
Азотистая кислота Простые и сложные вещества. Химический элемент
Простые и сложные вещества. Химический элемент