Содержание
- 2. Из 10 грамм какого вещества получиться больше кислорода: 2KMnO4 -> K2MnO4 + MnO2 + O2 4K2Cr2O7
- 3. Сера элемент встречающийся в самородном виде. Имеет три аллотропных модификации: ромбическая, моноклинная и пластическая. Сера
- 4. Часто образуется в фумаролах рядом с вулканами. Сера
- 5. При комнатной температуре сера реагирует со фтором, хлором и концентрированными кислотами-окислителями (HNO3, H2SO4): S + 3F2
- 6. При комнатной температуре сера реагирует со фтором, хлором и концентрированными кислотами-окислителями (HNO3, H2SO4): S + 3F2
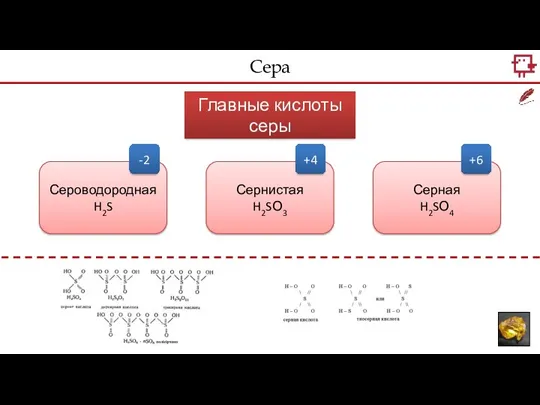
- 7. Сера Главные кислоты серы Сероводородная H2S Сернистая H2SО3 Серная H2SО4 -2 +4 +6
- 8. Сероводород – бесцветный и очень токсичный газ с запахом тухлых яиц. Получение в лаборатории: FeS +
- 9. SO2 + H2O H2SO3 Сернистый газ можно получить при взаимодействии: Me + 2H2SO4 (конц) -> CuSO4
- 11. Скачать презентацию







 Особенности сжигания твердого, жидкого и газообразного топлива
Особенности сжигания твердого, жидкого и газообразного топлива Электролитическая диссоциация. Протолитическая теория кислот и оснований. Лекция №5
Электролитическая диссоциация. Протолитическая теория кислот и оснований. Лекция №5 Элементы IV А - группы
Элементы IV А - группы Галогены. Их роль в нашей жизни
Галогены. Их роль в нашей жизни Черная металлургия
Черная металлургия Кривая охлаждения железа и структуры сплавов
Кривая охлаждения железа и структуры сплавов Гидролиз органических и неорганических соединений
Гидролиз органических и неорганических соединений Электрохимический ряд напряжений металлов
Электрохимический ряд напряжений металлов Легированные стали
Легированные стали Влияние циклогексанола селективную очистку масляных фракций нефти N-метилпирролидоном (N-МП)
Влияние циклогексанола селективную очистку масляных фракций нефти N-метилпирролидоном (N-МП) Гидроксиды. Основания. Состав, классификация, свойства, получение
Гидроксиды. Основания. Состав, классификация, свойства, получение Защита металлоконструкций от коррозии
Защита металлоконструкций от коррозии Кевлар. Структура кевлара
Кевлар. Структура кевлара Непредельные углеводороды ряда этилена. Олефины
Непредельные углеводороды ряда этилена. Олефины Кислотность и основность органических соединений. (Лекция 3)
Кислотность и основность органических соединений. (Лекция 3) Chemistry th 11 grade The end of second Term
Chemistry th 11 grade The end of second Term Минералы свинца
Минералы свинца Химиялық қауіптілер. Нитраттар
Химиялық қауіптілер. Нитраттар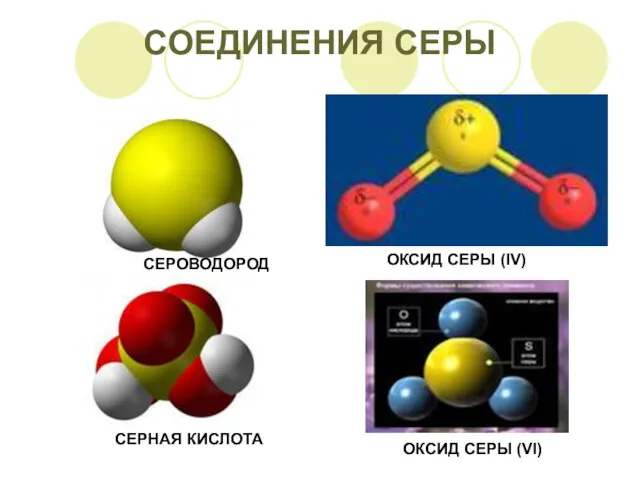 Cоединения серы
Cоединения серы Практическая работа. Химический состав клетки
Практическая работа. Химический состав клетки Контроль качества пищевых товаров
Контроль качества пищевых товаров Электролиз
Электролиз Мини-проект по дисциплине: Физико-химические методы исследования и техника лабораторных работ
Мини-проект по дисциплине: Физико-химические методы исследования и техника лабораторных работ Фтор (Fluorum), F
Фтор (Fluorum), F Аммиак
Аммиак Химический элемент и вещество
Химический элемент и вещество Жиры (триглицериды)
Жиры (триглицериды) Характер затвердевания
Характер затвердевания