Содержание
- 2. СЕРОВОДОРОД Бесцветный газ с запахом «тухлых яиц». Тяжелее воздуха. Ядовит (блокирует металлопротеидные центры ферментов, гемоглобина). Хорошо
- 3. СЕРОВОДОРОД В ПРИРОДЕ Сероводородные ванны Сероводородные минеральные воды Сероводород в районах вулканов Сероводород в Чёрном море
- 5. ХИМИЧЕСКИЕ СВОЙСТВА СЕРОВОДОРОДА Восстановительные (S-2 – минимальная степень окисления) Горение: 2H2S + 3O2 →2SO2+2H2O Неполное окисление:
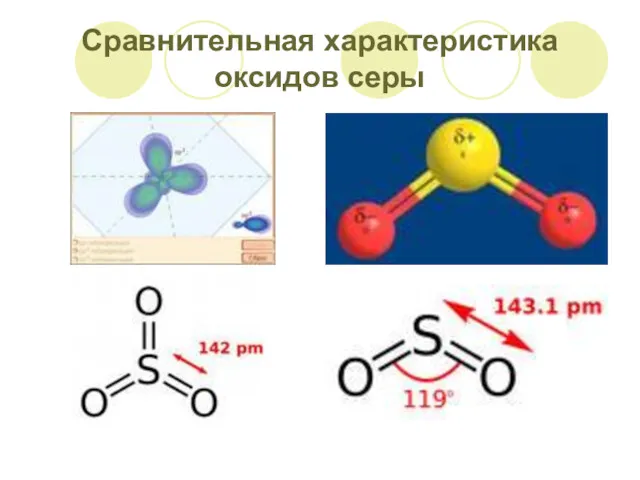
- 6. Сравнительная характеристика оксидов серы
- 7. Сравнительная характеристика оксидов серы SO2 – сернистый газ, сернистый ангидрид Бесцветный газ с удушливым запахом «горелых
- 8. Способы получения оксидов серы SO2 В промышленности – обжиг пирита: 4FeS2 + 11O2 → 2Fe2O3+8SO2 В
- 9. Свойства кислотных оксидов Сернистый ангидрид SO2+NaOH→NaHSO3 SO2+2NaOH→Na2SO3 + H2O SO2 + H2O ↔ H2SO3 SO2 +
- 10. Окислительно-восстановительная активность оксидов серы SO2 – и восстановитель, и окислитель, так как сера в промежуточной степени
- 11. Сернистый газ используется для отбеливания тканей, но его присутствие в атмосфере чрезвычайно опасно для здоровья
- 12. Серная кислота Сернокислотное озеро вулкан Горелый на Камчатке
- 13. Обугливающее действие концентрированной серной кислоты
- 14. Разрушение бумаги под действием серной кислоты
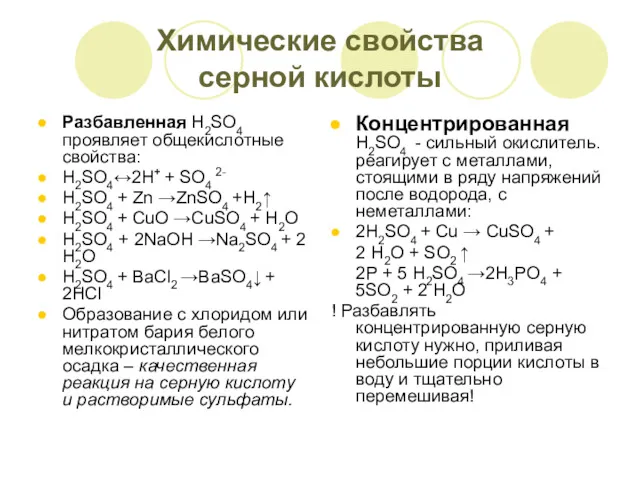
- 15. Химические свойства серной кислоты Разбавленная H2SO4 проявляет общекислотные свойства: H2SO4↔2Н+ + SO4 2- H2SO4 + Zn
- 16. Серная кислота – «хлеб химической промышленности» Сернокислотный завод Цистерны с серной кислотой
- 17. Производство серной кислоты 1-я стадия – обжиг пирита (обжиговая печь) 4FeS2 + 11O2 → 2Fe2O3+8SO2 2-я
- 18. Производство серной кислоты
- 20. Скачать презентацию













 Вода
Вода Строение атома
Строение атома Железо и его соединения
Железо и его соединения Особенности строения соединений органической химии. 10 класс
Особенности строения соединений органической химии. 10 класс Історія відкриття періодичної системи хімічних елементів
Історія відкриття періодичної системи хімічних елементів Основы химмотологии моторных топлив. Тема 3
Основы химмотологии моторных топлив. Тема 3 Prezentatciya
Prezentatciya Растворы. Основные понятия. Концентрация. Законы Рауля
Растворы. Основные понятия. Концентрация. Законы Рауля Кислородсодержащие соединения азота
Кислородсодержащие соединения азота Аналитическая химия стойких органических загрязнителей
Аналитическая химия стойких органических загрязнителей Получение каталитического слоя на основе углеродных нанотрубок с наночастицами платины для водородно–воздушных топливных элементов
Получение каталитического слоя на основе углеродных нанотрубок с наночастицами платины для водородно–воздушных топливных элементов Периодическая система химических элементов Д.И. Менделеева. Строение атома
Периодическая система химических элементов Д.И. Менделеева. Строение атома Окисно-відновні реакції, їхнє значення. Складання найпростіших окисно-відновних реакцій, добір коефіцієнтів
Окисно-відновні реакції, їхнє значення. Складання найпростіших окисно-відновних реакцій, добір коефіцієнтів Химический элемент. Изотопы. 11 класс
Химический элемент. Изотопы. 11 класс Непредельные углеводороды
Непредельные углеводороды Аминокислоты. Пептиды. Хроматографические методы исследования
Аминокислоты. Пептиды. Хроматографические методы исследования Воздух и его состав
Воздух и его состав Поверхностный мембранный потенциал. Равновесие Доннана
Поверхностный мембранный потенциал. Равновесие Доннана Трансмиссионные масла
Трансмиссионные масла Одноатомные спирты. Глицерин
Одноатомные спирты. Глицерин Неметаллические материалы
Неметаллические материалы Углеводы. Общая характеристика углеводов
Углеводы. Общая характеристика углеводов Полимеры органические и неорганические
Полимеры органические и неорганические Первоначальные представления об органических веществах
Первоначальные представления об органических веществах Металлы. Свойства металлов
Металлы. Свойства металлов Алканы. Получение, свойства и применение
Алканы. Получение, свойства и применение Общая характеристика металлов
Общая характеристика металлов Кислоты, их состав и названия
Кислоты, их состав и названия