Содержание
- 2. Цели урока Дать понятие о составе атома и составе атомного ядра Раскрыть взаимосвязь понятий: протон; нейтрон;
- 3. Актуализация знаний 1. В предложение вставьте слова „атом” и „молекула” а) …водорода образована … водорода. б)
- 4. Основные положения атомно-молекулярного учения (М. Ломоносов) Вещества состоят из молекул, а молекулы из атомов. Молекула –мельчайшая
- 5. Атом - сложная частица Введение понятия „электрон” (Стони) Открытие катодных лучей. Катодные лучи- поток электронов (Томсон
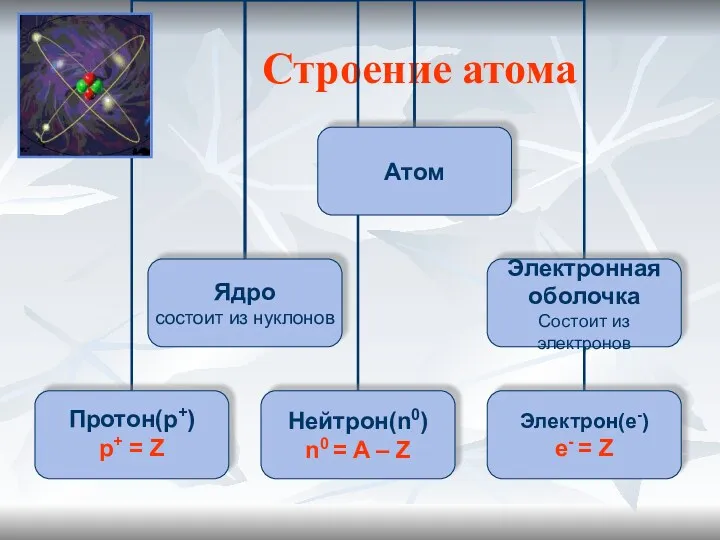
- 6. Строение атома
- 7. Планетарная модель атома (Резерфорд) Атом –это микрочастица, которая имеет форму шара. Атом –сложная система, состоящая из
- 8. Строение атома Связь строения атома и Периодической системы химических элементов Д.И. Менделеева Порядковый Заряд Число Число
- 9. Самостоятельная работа Укажите состав атома железа Укажите состав ядра атома железа Укажите состав атома фосфора, состав
- 10. Домашнее задание § 6 Задание №3, №5 (с.43) Творческое задание: Пользуясь этимологическим словарем, объясните, почему планетарную
- 11. Изменения в составе ядер атомов химических элементов. Изотопы
- 12. Что произойдет с атомом элемента, если в его ядре изменить число протонов? Например, в ядро атома
- 13. Что произойдет с атомом элемента, если в его ядре изменить число нейтронов? Например, в ядро атома
- 14. Изотопы Укажите состав изотопов хлора: 35Сl и 37Сl +1735Сl(17p++18n0) 17е- Аr=35 +1737Сl(17p++20n0) 17е- Аr=37 Атомы изотопов
- 15. Задание 1 Символ изотопа элемента +1939Э. Определите, какой это элемент, состав атома этого элемента. Z=19. Элемент
- 16. Задание 2 Природный хлор состоит из 75% изотопа с массовым числом 35 и из 25% изотопа
- 17. Задание 3 Символ изотопа элемента +1939Э. Определите, какой это элемент, состав атома этого элемента. Z=19 Элемент
- 18. Задание 4 Относительная атомная масса хлора 35,5. Хлор существует в природе в виде двух изотопов: 35Cl
- 20. Скачать презентацию
















 Особенности строения, реакционной способности и методы синтеза азотсодержащих соединений
Особенности строения, реакционной способности и методы синтеза азотсодержащих соединений Строение атома. Теории строения атома
Строение атома. Теории строения атома Элементы подгруппы углерода
Элементы подгруппы углерода Гетерогенді химиялық реакциялар
Гетерогенді химиялық реакциялар Камни и минералы
Камни и минералы Предельные углеводороды
Предельные углеводороды Обмен простых белков. Дезаминирование и трансаминирование аминокислот
Обмен простых белков. Дезаминирование и трансаминирование аминокислот Гидролиз органических и неорганических веществ
Гидролиз органических и неорганических веществ Методы разделения и концентрирования. Хроматографические методы
Методы разделения и концентрирования. Хроматографические методы 20231116_tipy_himicheskih_reaktsiy
20231116_tipy_himicheskih_reaktsiy Збуджений стан атома. Валентні стани елементів. Можливі ступені окиснення неметалічних елементів 2-го і 3-го періодів
Збуджений стан атома. Валентні стани елементів. Можливі ступені окиснення неметалічних елементів 2-го і 3-го періодів Окисно-відновні реакції. Гальванічні елементи
Окисно-відновні реакції. Гальванічні елементи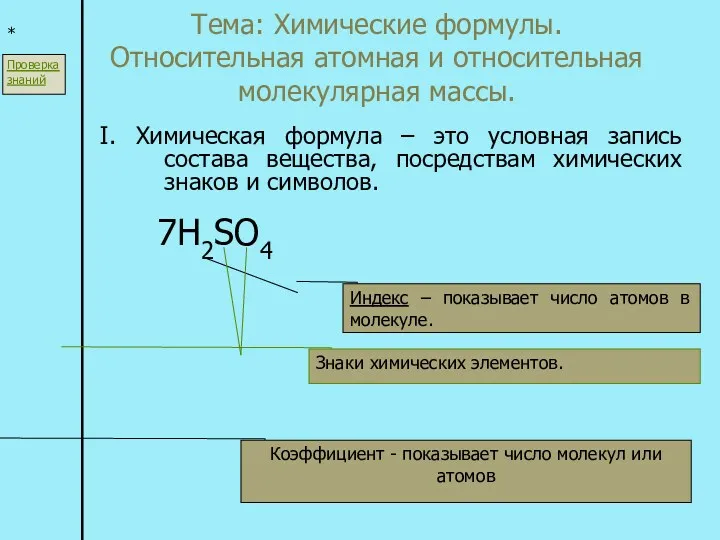 Химические формулы. Относительная атомная и относительная молекулярная массы
Химические формулы. Относительная атомная и относительная молекулярная массы Водород - топливо будущего
Водород - топливо будущего Углеводороды: предельные и непредельные
Углеводороды: предельные и непредельные Как трудно быть особенной…
Как трудно быть особенной… Alkynes
Alkynes Углеводородное сырье: способы переработки
Углеводородное сырье: способы переработки Основные положения теории растворов электролитов, используемых в аналитической химии. (Лекция 3)
Основные положения теории растворов электролитов, используемых в аналитической химии. (Лекция 3) Пластмаси та полімери
Пластмаси та полімери Определение нефтепродуктов в воде с использованием Флюората-02-5М
Определение нефтепродуктов в воде с использованием Флюората-02-5М Элемент 7 группы, побочной подгруппы, d-элемент - Mn (марганец)
Элемент 7 группы, побочной подгруппы, d-элемент - Mn (марганец) Общая и медицинская химия
Общая и медицинская химия Дисперсные системы
Дисперсные системы Получение кислот
Получение кислот Нуклеиновые кислоты. Нуклеотиды
Нуклеиновые кислоты. Нуклеотиды Органическая химия. Пособие
Органическая химия. Пособие Металлы. Свойства металлов
Металлы. Свойства металлов