Содержание
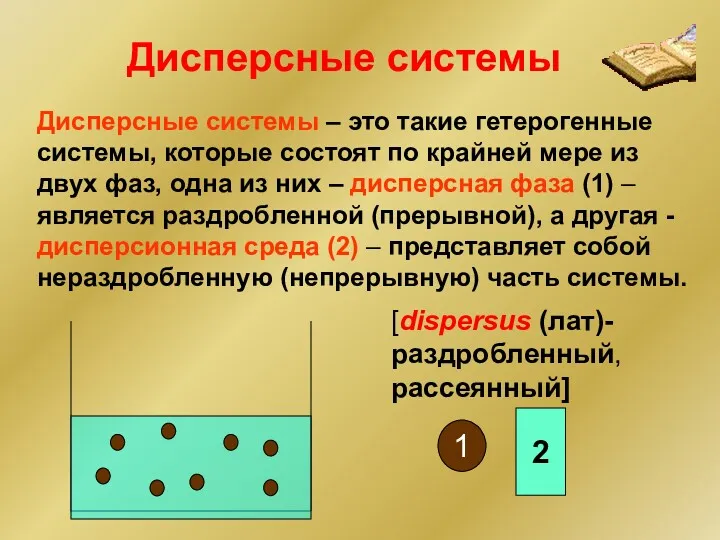
- 2. Дисперсные системы – это такие гетерогенные системы, которые состоят по крайней мере из двух фаз, одна
- 3. Согласно историческому развитию нашего естествознания, мы привыкли свойства всех тел рассматривать или с точки зрения познания
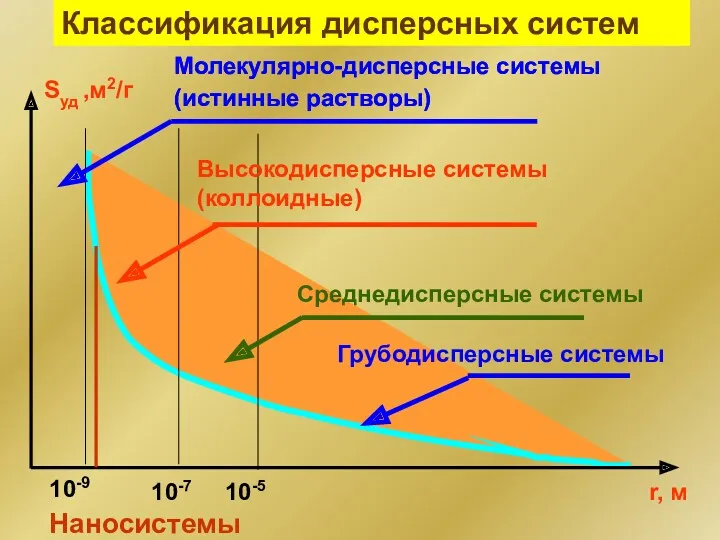
- 4. Классификация дисперсных систем Молекулярно-дисперсные системы (истинные растворы) Наносистемы
- 5. Коллоидная химия [kolla (греч.) – клей] – наука о поверхностных явлениях и дисперсных системах. Значимость коллоидной
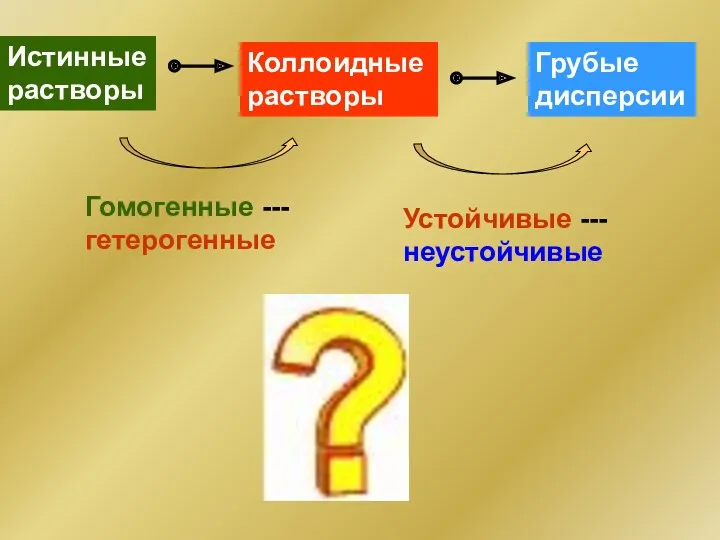
- 6. Истинные растворы Коллоидные растворы Грубые дисперсии Гомогенные ---гетерогенные Устойчивые ---неустойчивые
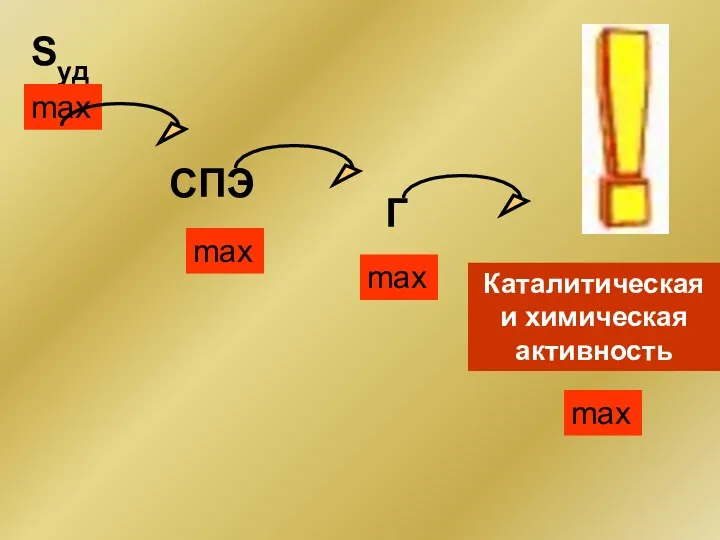
- 7. Sуд СПЭ Г max max max max Каталитическая и химическая активность
- 8. Размерные (масштабные) эффекты Прочность, теплоемкость,магнитные свойства, электрические характеристики, реакционная способность вещества изменяются с размером частиц. Эти
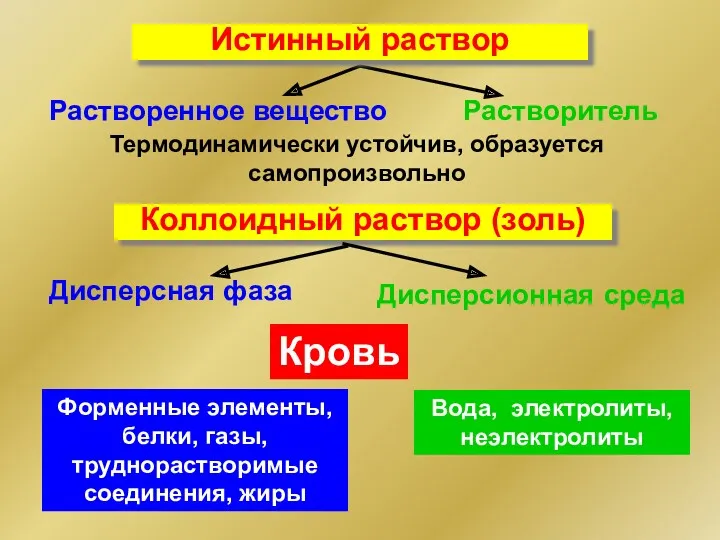
- 9. Растворенное вещество Растворитель Термодинамически устойчив, образуется самопроизвольно Коллоидный раствор (золь) Дисперсная фаза Дисперсионная среда Истинный раствор
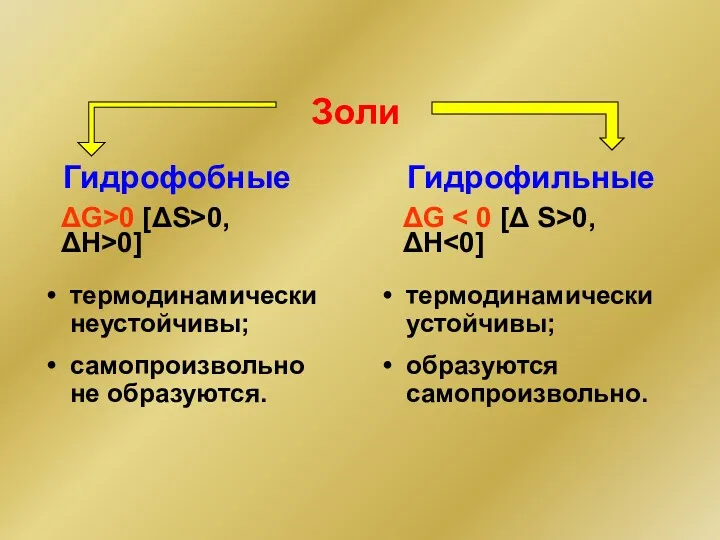
- 10. Золи Гидрофобные Гидрофильные термодинамически неустойчивы; самопроизвольно не образуются. термодинамически устойчивы; образуются самопроизвольно. ΔG>0 [ΔS>0, ΔH>0] ΔG
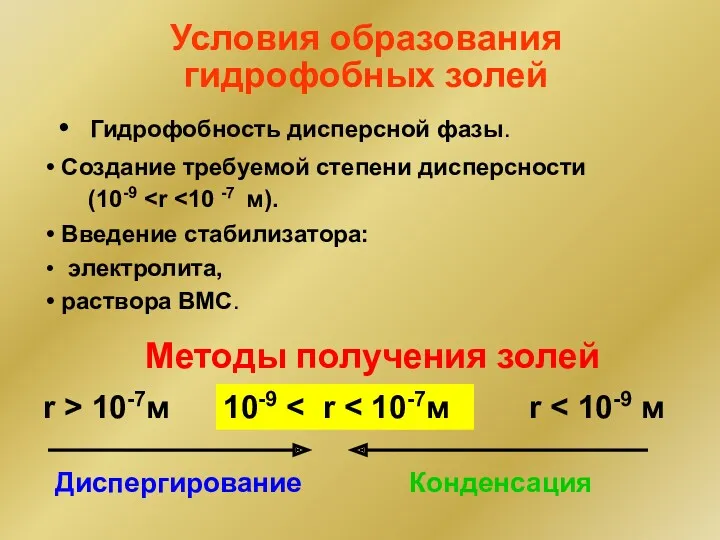
- 11. Условия образования гидрофобных золей Гидрофобность дисперсной фазы. Методы получения золей 10-9 r r > 10-7м Диспергирование
- 12. Методы диспергирования Механическое дробление (ступка, шаровая мельница, коллоидная мельница); Пептизация - переход осадка золя во взвешенное
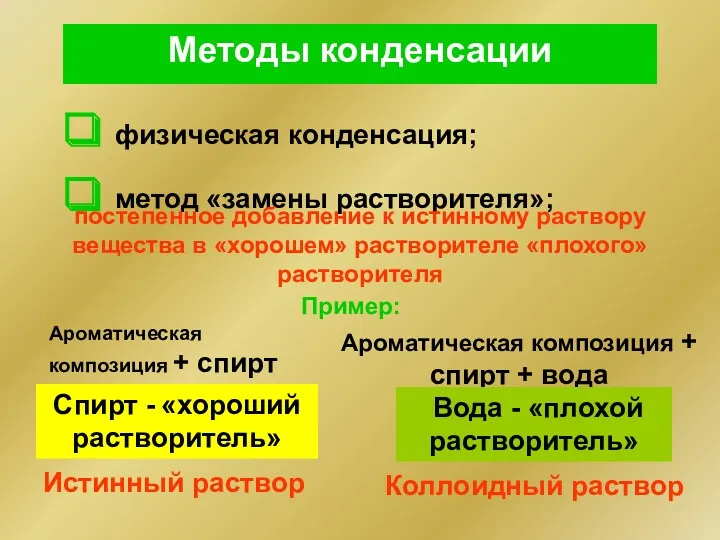
- 13. Методы конденсации физическая конденсация; метод «замены растворителя»; постепенное добавление к истинному раствору вещества в «хорошем» растворителе
- 14. Методы конденсации Физическая конденсация; химическая конденсация – любая реакция, приводящая к образованию осадка. Необходимая концентрация растворов:
- 15. Окислительно-восстановительные реакции: Методы конденсации 2 SbCl3 + 3H2S → Sb2S3 + 6HCl AgNO3 + Red →
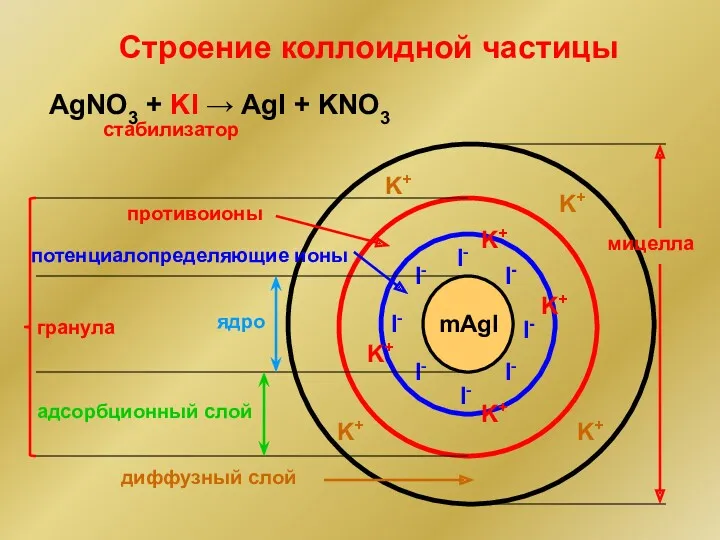
- 16. Строение коллоидной частицы Мицелла – частица дисперсной фазы золя вместе с окружающей ее сольватной оболочкой из
- 17. Строение коллоидной частицы AgNO3 + KI → AgI + KNO3 mAgI I- I- I- I- I-
- 18. [ m AgI n I- (n-x) K+]-x x K+ FeCl3 + 3 H2O → Fe(OH)3 +
- 19. FeCl3 + K4[Fe(CN)6] → KFe[Fe(CN)6]3 + 3KCl {m KFe[Fe(CN)6]3 n [Fe(CN)6]4- 4(n-x)K+}-4x 4xK+ Na2SiO3 + H2O
- 20. Молекулярно-кинетические свойства Броуновское движение; А.Эйнштейн, М. Смолуховский 1905 г. Диффузия Осмотическое давление
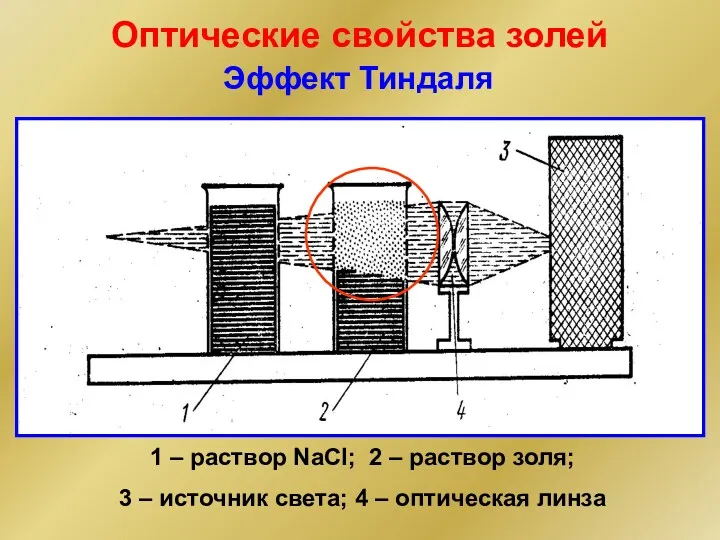
- 21. Оптические свойства золей Окраска Если размер частиц меньше длины полуволны падающего света, наблюдается дифракционное рассеяние света.
- 22. Оптические свойства золей 1 – раствор NaCl; 2 – раствор золя; 3 – источник света; 4
- 23. Формула Рэлея I – интенсивность рассеянного света в направлении, перпендикулярном к лучу падающего света Эффект Тиндаля
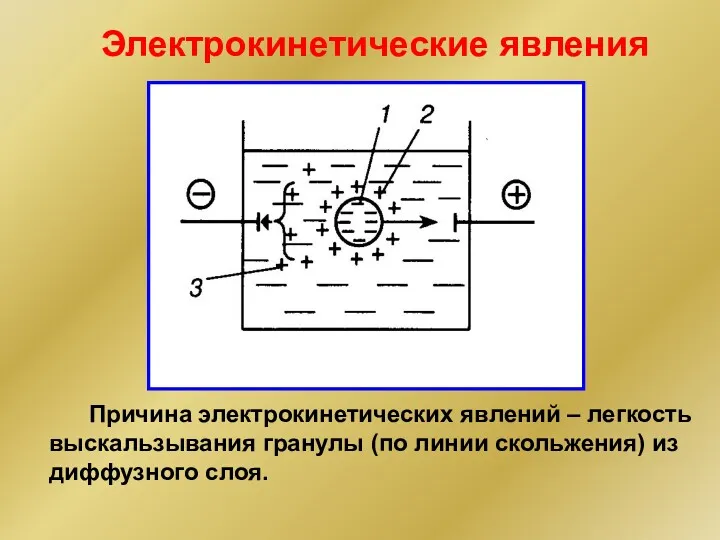
- 24. Электрокинетические явления Ф. Pейсс (1807) [mSiO2nSiO32- 2(n-x)Na+]2x- 2xNa+ гранула линия скольжения
- 25. Причина электрокинетических явлений – легкость выскальзывания гранулы (по линии скольжения) из диффузного слоя. Электрокинетические явления
- 26. Электрофорез – движение частиц дисперсной фазы под действием внешнего электрического поля. Электрокинетические явления Лекарственный электрофорез –
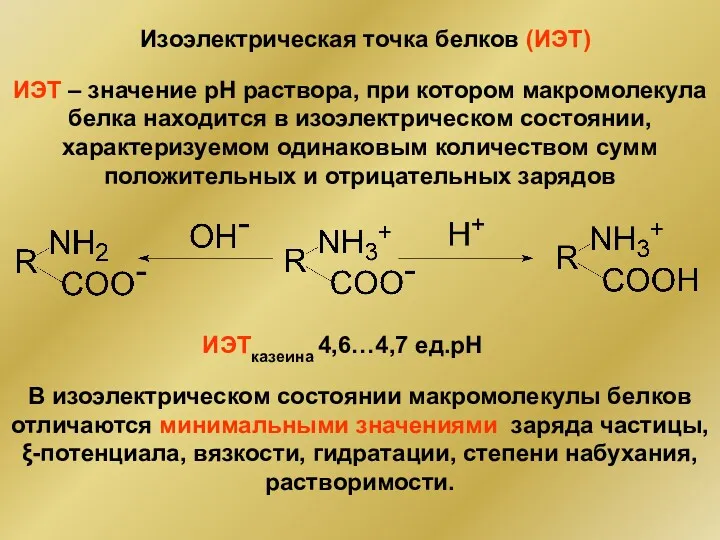
- 27. Изоэлектрическая точка белков (ИЭТ) ИЭТ – значение рН раствора, при котором макромолекула белка находится в изоэлектрическом
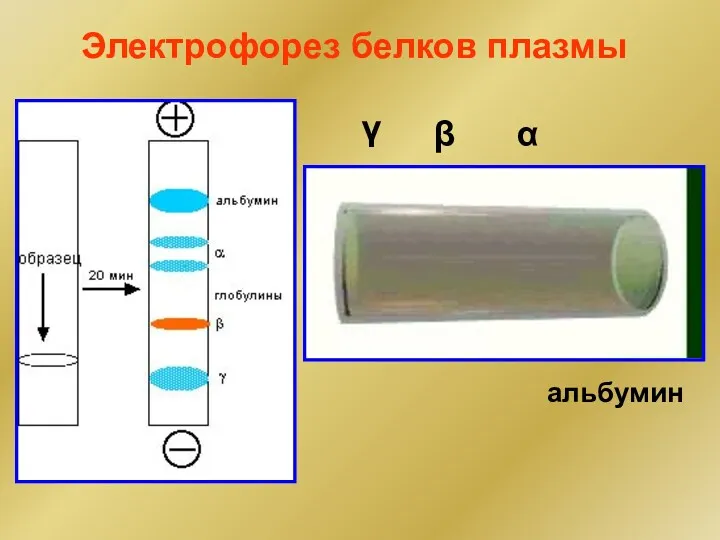
- 28. Электрофорез белков плазмы α β γ альбумин
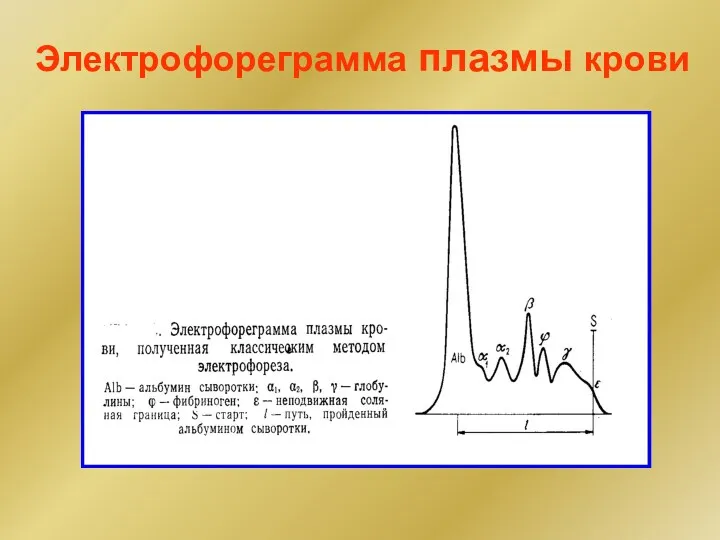
- 29. Электрофореграмма плазмы крови
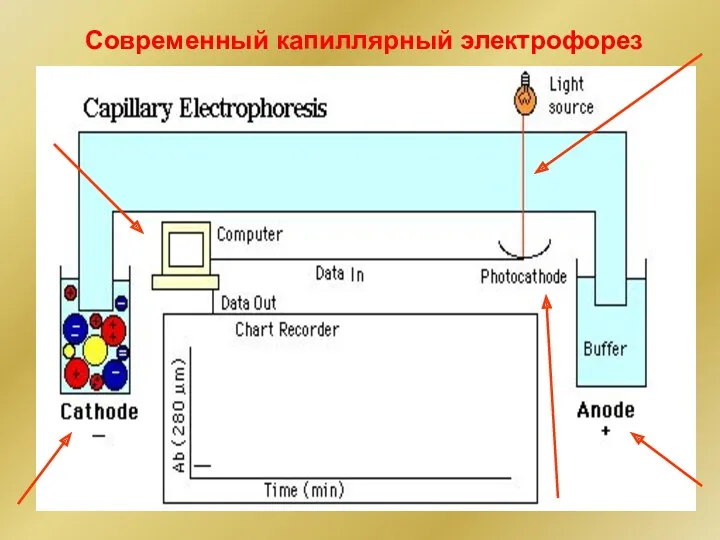
- 30. Современный капиллярный электрофорез
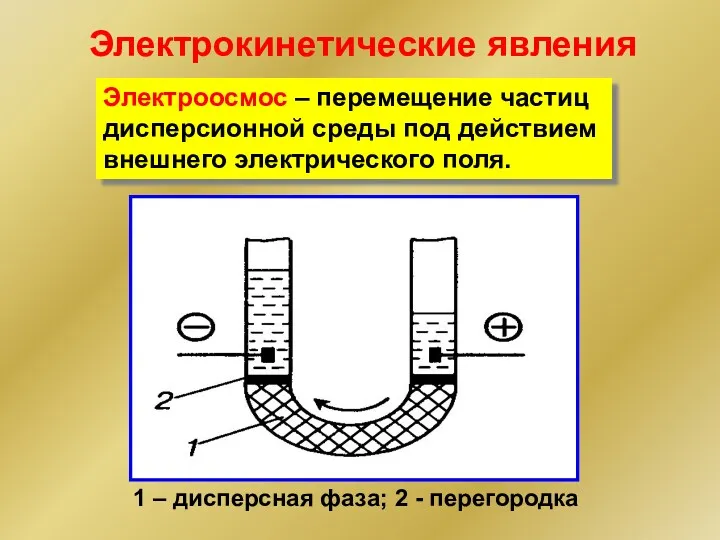
- 31. 1 – дисперсная фаза; 2 - перегородка Электроосмос – перемещение частиц дисперсионной среды под действием внешнего
- 32. Применение электроосмоса Удаление избыточной влаги из капиллярно-пористых тел (стен зданий, сыпучих материалов); очистка дисперсионной среды коллоидных
- 33. Мерой электрокинетических явлений является электрокинетический [ξ(дзета)]потенциал] ОА – поверхностный (ϕ) потенциал (≈1000мВ); BD – электрокинетический потенциал
- 34. Прибор для наблюдения электрофореза по движению границы между растворами К – постоянная, зависящая от природы дисперсионной
- 35. Основные характеристики электрокинетического потенциала Возникает между гранулой и диффузным слоем ξ -потенциал клеток -10 ≈ -30
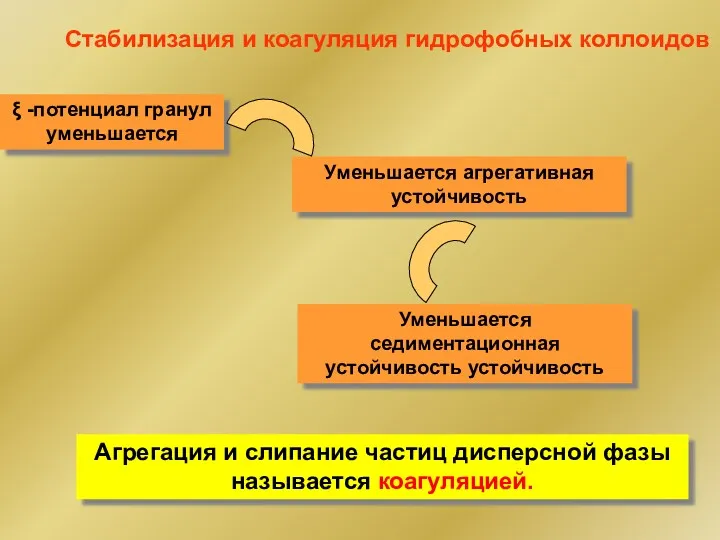
- 36. Стабилизация и коагуляция гидрофобных коллоидов Седиментационная устойчивость обусловлена броуновским движением Агрегативная устойчивость определяется одноименным зарядом гранул
- 37. Агрегация и слипание частиц дисперсной фазы называется коагуляцией. Стабилизация и коагуляция гидрофобных коллоидов ξ -потенциал гранул
- 38. Правила электролитной коагуляции (правила Шульце-Гарди) Любой электролит может вызывать коагуляцию золя. Минимальное количество электролита (ммоль), вызывающее
- 39. Пример: Пороги коагуляции электролитов для золя ВаSO4 следующие: γ(КСl) = 256.0, γ(K2SO4) = 6.0; γ (K3PO4)
- 40. Выводы: Ион - коагулянт заряжен отрицательно; Гранула заряжена положительно; Мицелла: [ mBaSO4 nBa2+ 2(n-x)Cl-]2x+ 2xCl-
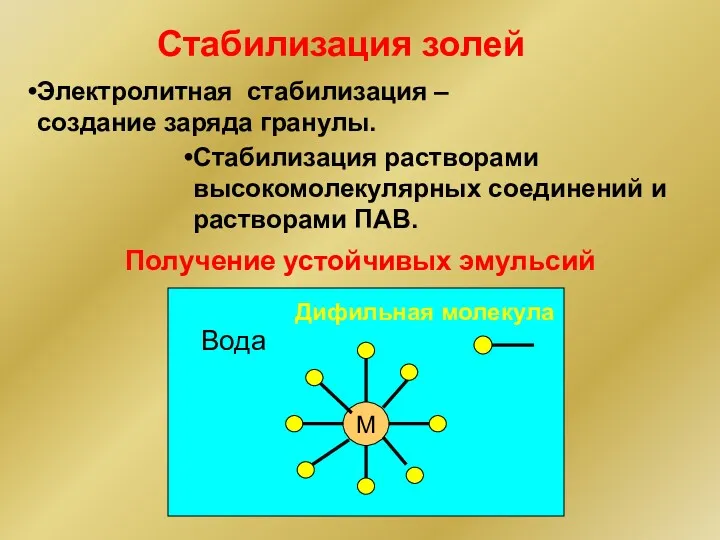
- 41. Стабилизация растворами высокомолекулярных соединений и растворами ПАВ. Стабилизация золей Электролитная стабилизация – создание заряда гранулы. Получение
- 42. Применение антикоагулянтов в медицине Лечение тромбозов, тромбофлебитов Понижение свертываемости крови во время операции (гепарин, кумарин, цитрат
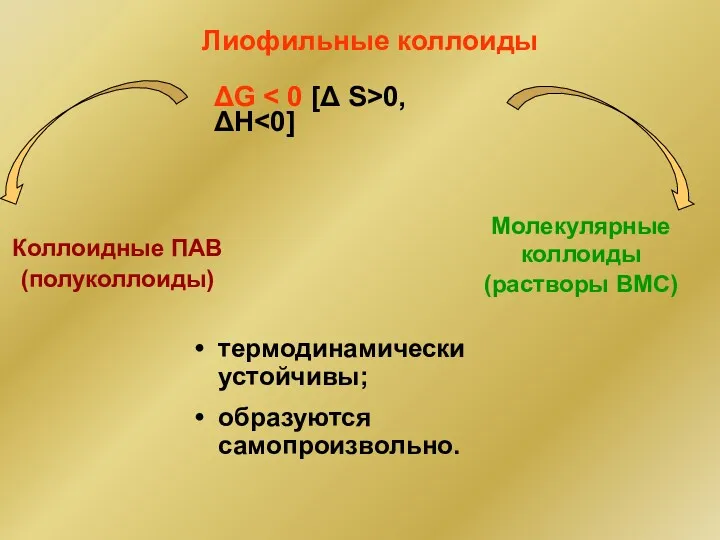
- 43. Лиофильные коллоиды Коллоидные ПАВ (полуколлоиды) Молекулярные коллоиды (растворы ВМС) ΔG 0, ΔH термодинамически устойчивы; образуются самопроизвольно.
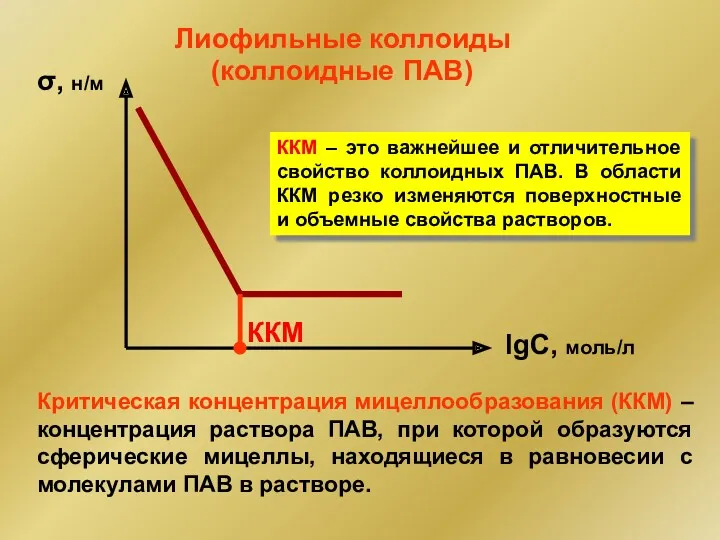
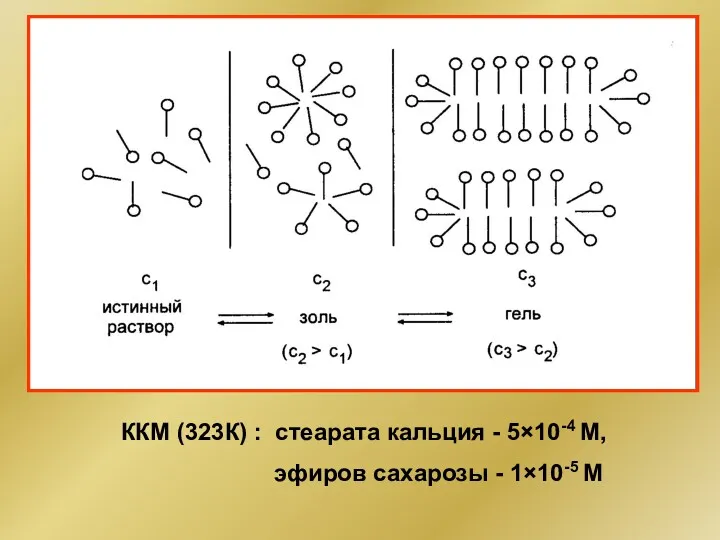
- 44. σ, н/м lgC, моль/л ККМ (коллоидные ПАВ) Лиофильные коллоиды Критическая концентрация мицеллообразования (ККМ) – концентрация раствора
- 45. ККМ (323К) : стеарата кальция - 5×10-4 М, эфиров сахарозы - 1×10-5 М
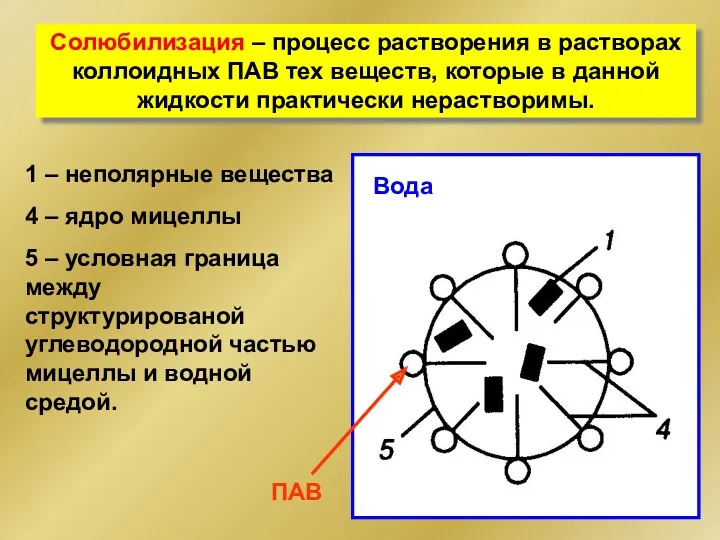
- 46. Солюбилизация – процесс растворения в растворах коллоидных ПАВ тех веществ, которые в данной жидкости практически нерастворимы.
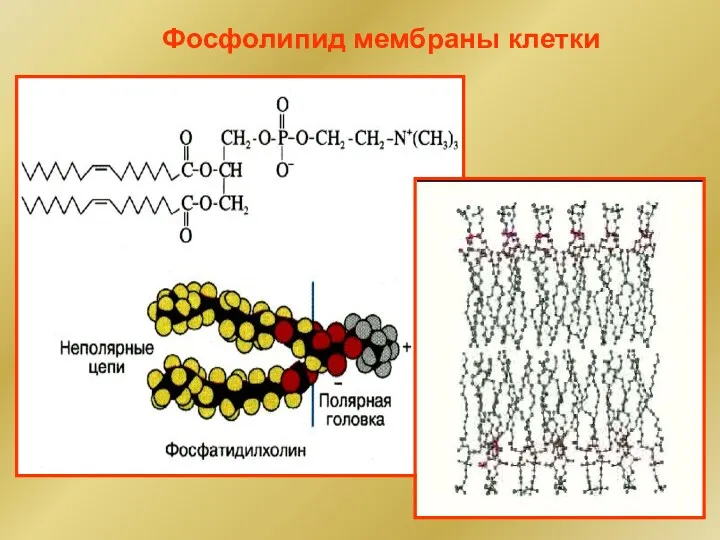
- 47. Фосфолипид мембраны клетки
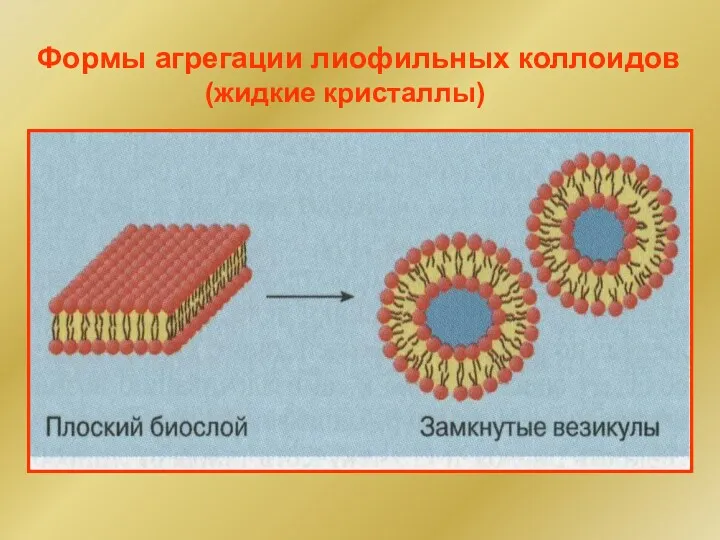
- 48. Формы агрегации лиофильных коллоидов (жидкие кристаллы)
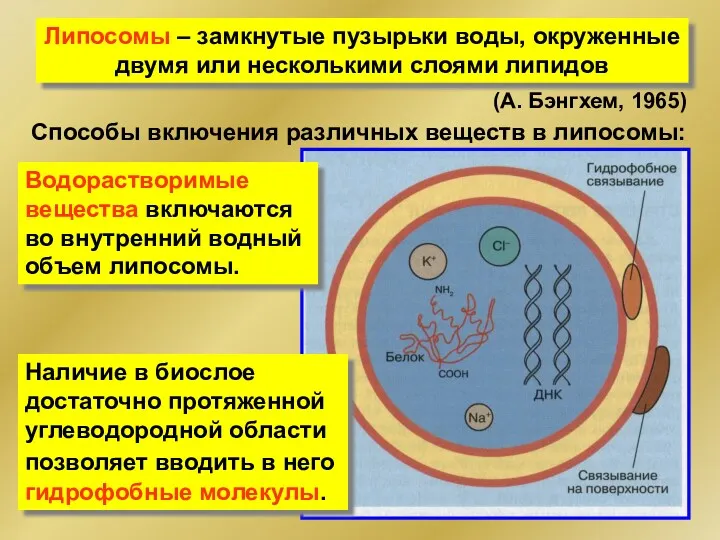
- 49. Липосомы – замкнутые пузырьки воды, окруженные двумя или несколькими слоями липидов (А. Бэнгхем, 1965) Способы включения
- 50. Липосомальная терапия применяется при лечении онкологических, инфекционных заболеваний, диабета и ряда др. Липосомы – носители лекарств
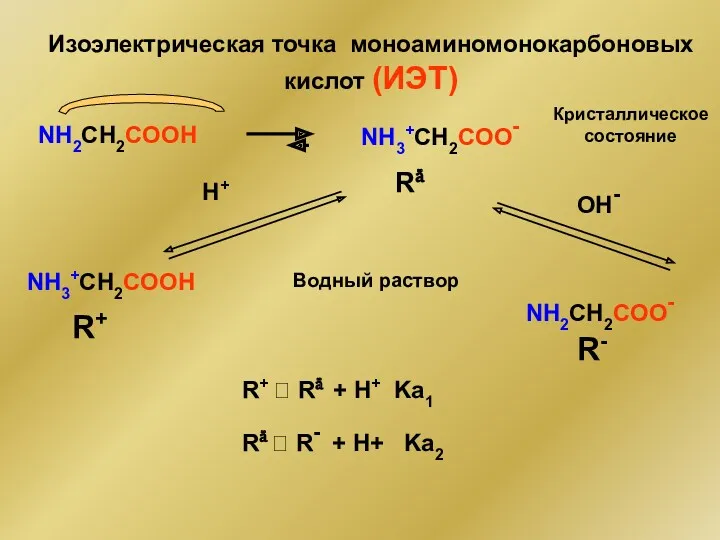
- 51. Изоэлектрическая точка моноаминомонокарбоновых кислот (ИЭТ) NH2CH2COOH NH3+CH2COOН Кристаллическое состояние Rä Водный раствор NH3+CH2COO- Н+ R+ ОН-
- 53. Скачать презентацию

![Коллоидная химия [kolla (греч.) – клей] – наука о поверхностных](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/270215/slide-4.jpg)





![[ m AgI n I- (n-x) K+]-x x K+ FeCl3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/270215/slide-17.jpg)
![FeCl3 + K4[Fe(CN)6] → KFe[Fe(CN)6]3 + 3KCl {m KFe[Fe(CN)6]3 n](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/270215/slide-18.jpg)



![Электрокинетические явления Ф. Pейсс (1807) [mSiO2nSiO32- 2(n-x)Na+]2x- 2xNa+ гранула линия скольжения](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/270215/slide-23.jpg)


![Мерой электрокинетических явлений является электрокинетический [ξ(дзета)]потенциал] ОА – поверхностный (ϕ)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/270215/slide-32.jpg)





![Выводы: Ион - коагулянт заряжен отрицательно; Гранула заряжена положительно; Мицелла: [ mBaSO4 nBa2+ 2(n-x)Cl-]2x+ 2xCl-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/270215/slide-39.jpg)


 Растворы ВМС
Растворы ВМС Лекарства
Лекарства Электролитическая диссоциация
Электролитическая диссоциация Суспензии: получение, свойства
Суспензии: получение, свойства Галогены - химические элементы 17-й группы периодической таблицы химических элементов Д.И. Менделеева
Галогены - химические элементы 17-й группы периодической таблицы химических элементов Д.И. Менделеева Сущность процесса электролитической диссоциации
Сущность процесса электролитической диссоциации Диены (диолефины, алкадиены)
Диены (диолефины, алкадиены) Нобелевская премия по химии
Нобелевская премия по химии Основы термической и химико-термической обработки стали. Теория и технология термической обработки стали. Лекция 3. Тема 7
Основы термической и химико-термической обработки стали. Теория и технология термической обработки стали. Лекция 3. Тема 7 Проведення електрофоретичного розділення ДНК в агарозному гелі
Проведення електрофоретичного розділення ДНК в агарозному гелі Арены. Бензол и его гомологи
Арены. Бензол и его гомологи Химические свойства алканов
Химические свойства алканов Алкины. Химические свойства и способы получения алкинов
Алкины. Химические свойства и способы получения алкинов Моносахариды, дисахариды
Моносахариды, дисахариды Сущность процесса электролитической диссоциации
Сущность процесса электролитической диссоциации Практикум по органической и биоорганической химии
Практикум по органической и биоорганической химии Проект познавательно-исследовательской деятельности. Удивительная соль
Проект познавательно-исследовательской деятельности. Удивительная соль Багатоядерні ароматичні сполуки
Багатоядерні ароматичні сполуки Алюминий. Строение и свойства атома
Алюминий. Строение и свойства атома Альтернативная елочка из кристаллов
Альтернативная елочка из кристаллов Теория строения химических соединений А. М. Бутлерова
Теория строения химических соединений А. М. Бутлерова Классификация моторных масел
Классификация моторных масел Пластмасса
Пластмасса Строение атома и периодический закон
Строение атома и периодический закон Характеристика хімічного елемента Hg
Характеристика хімічного елемента Hg Ендотермічні реакції на службі людини
Ендотермічні реакції на службі людини Анализ раствора кальция хлорида 5%-200 мл
Анализ раствора кальция хлорида 5%-200 мл Процесс в химическом реакторе
Процесс в химическом реакторе