Содержание
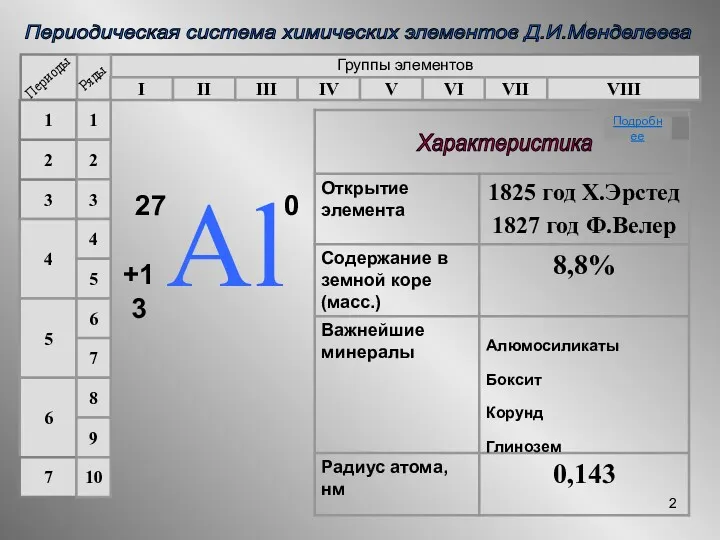
- 2. Периодическая система химических элементов Д.И.Менделеева Группы элементов I II III IV VII VI V VIII 3
- 3. Алюминий 2. Электронное строение 5. Свойства атома 3. Строение простого вещества 4. Физические свойства 6. Химические
- 4. Алюминий 1. Из истории открытия главная Далее Впервые Al был получен датским физиком Эрстедом Х. в
- 5. Алюминий 1. Из истории открытия Главная Далее В период открытия алюминия - металл был дороже золота.
- 6. Алюминий главная Вставьте пропущенные слова Алюминий - элемент III группы, главной подгруппы. Заряд ядра атома алюминия
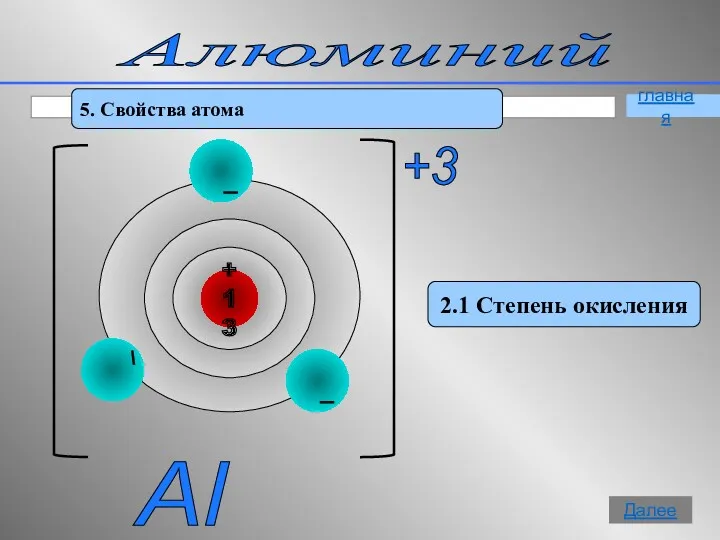
- 7. Алюминий 2. Электронное строение 27 Аl +13 0 2e 8e 3e 1s2 2s2 2p6 3s2 3p1
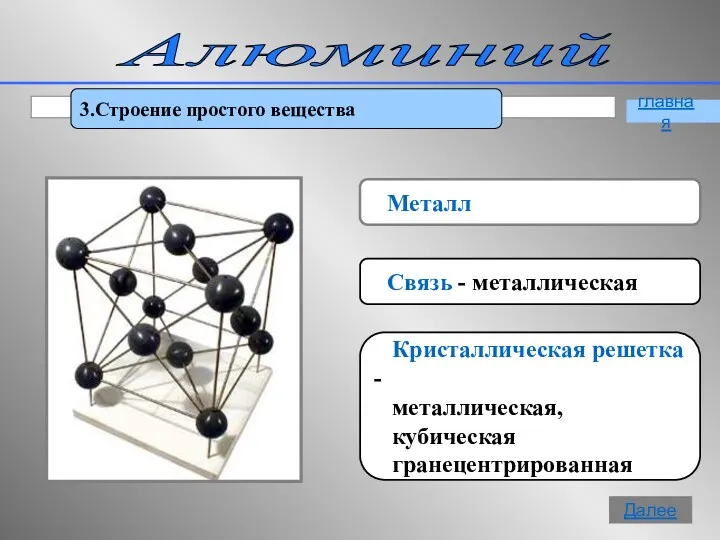
- 8. Алюминий 3.Строение простого вещества Металл Связь - металлическая Кристаллическая решетка - металлическая, кубическая гранецентрированная главная Далее
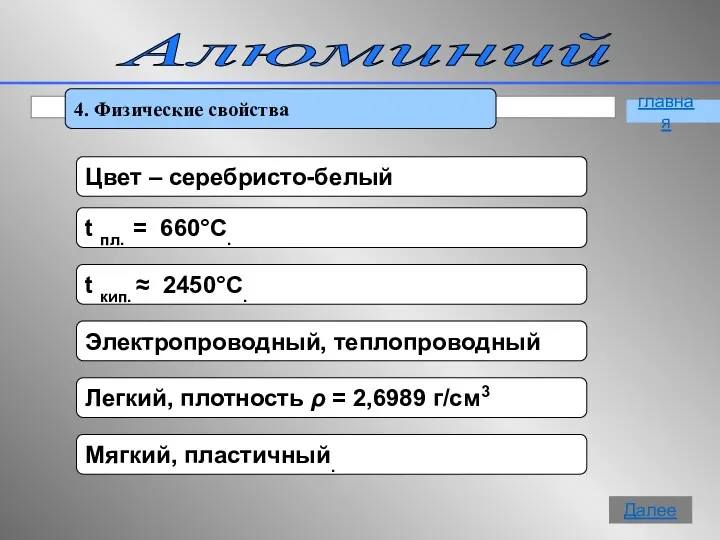
- 9. Алюминий 4. Физические свойства главная Далее
- 10. Алюминий 5. Свойства атома 2.1 Степень окисления Al +3 главная Далее
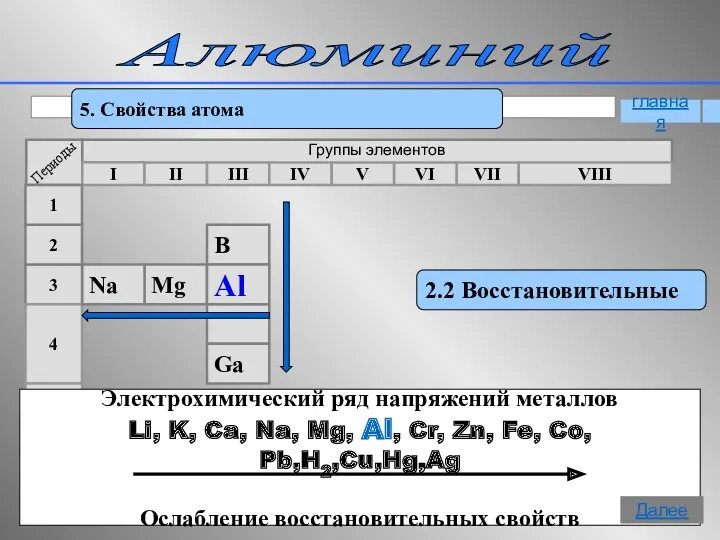
- 11. Алюминий 5. Свойства атома 2.2 Восстановительные Электрохимический ряд напряжений металлов Li, K, Ca, Na, Mg, Al,
- 12. Алюминий 6. Химические свойства 4Аl + 3O2 = 2Al2O3 t 2Al + 3S = Al2S3 C
- 13. • С кислородом взаимодействует только в мелкораздробленном состоянии при высокой температуре: 4Al + 3O2 = 2Al2O3
- 14. Очищенный от оксидной пленки алюминий энергично взаимодействует с водой: 2Al + 6H2O = 2Al(OH)3 + 3H2↑
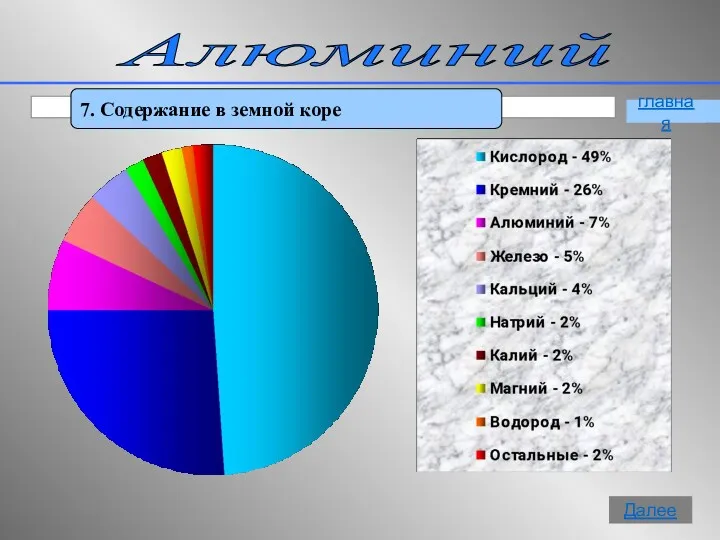
- 15. Алюминий 7. Содержание в земной коре главная Далее
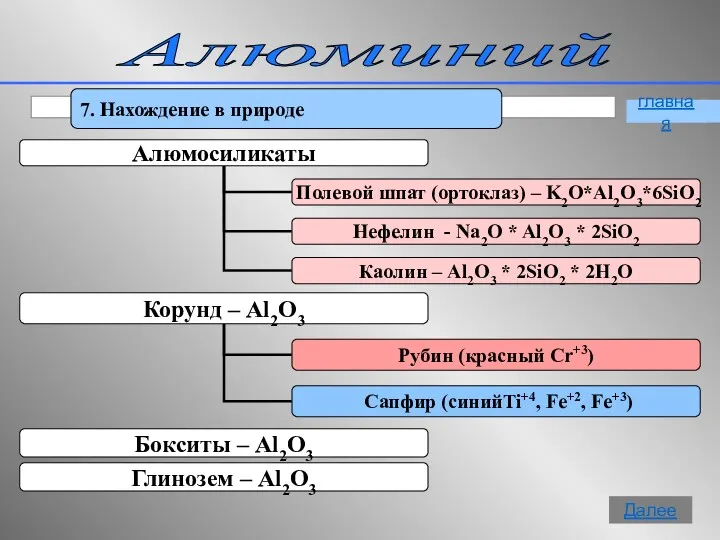
- 16. Алюминий 7. Нахождение в природе главная Далее
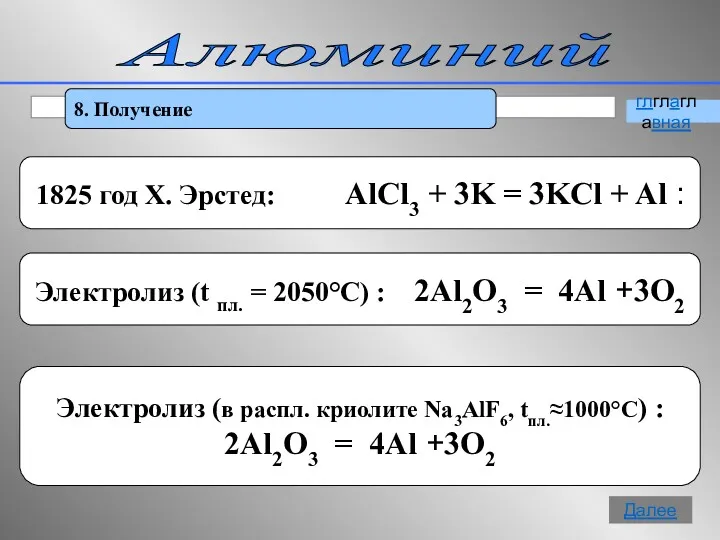
- 17. Алюминий 8. Получение глглаглавная Далее
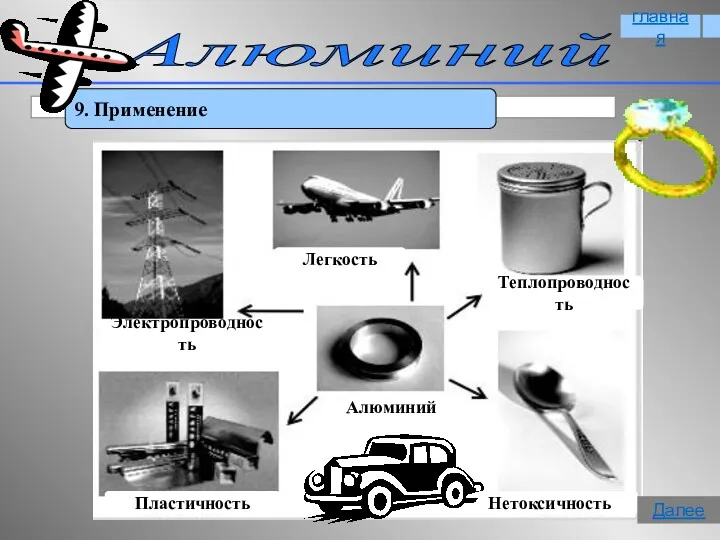
- 18. Алюминий 9. Применение главная Далее
- 20. Скачать презентацию








 Аминокислоты
Аминокислоты Скорость химической реакции
Скорость химической реакции Альдегиды, свойства, получение, применение
Альдегиды, свойства, получение, применение Неон (Ne)
Неон (Ne) Строение вещества. Химические элементы
Строение вещества. Химические элементы Изучение физико-химических свойств мицеллярных растворов индивидуальных ПАВ, композиций различных ПАВ
Изучение физико-химических свойств мицеллярных растворов индивидуальных ПАВ, композиций различных ПАВ Органічні сполуки і здоров'я людини
Органічні сполуки і здоров'я людини Массовая и объемная доля компонентов смеси
Массовая и объемная доля компонентов смеси Равновесие в реакциях гидролиза и трудно растворимых электролитов. Лекция 12
Равновесие в реакциях гидролиза и трудно растворимых электролитов. Лекция 12 Азо-, диазосоединения
Азо-, диазосоединения Повышение эффективности производства изопропилбензола за счёт нового катализатора, производительность по кумолу 100500 т/год
Повышение эффективности производства изопропилбензола за счёт нового катализатора, производительность по кумолу 100500 т/год становление органической химии
становление органической химии Строение атома и периодический закон Д.И. Менделеева
Строение атома и периодический закон Д.И. Менделеева Сучасні каталізатори у процесах нафтопереробки та нафтохімії
Сучасні каталізатори у процесах нафтопереробки та нафтохімії Жесткость воды
Жесткость воды Отложения и коррозия
Отложения и коррозия Чистые вещества и смеси
Чистые вещества и смеси Омега 3
Омега 3 Стекловолокно. Что такое стекловолокно?
Стекловолокно. Что такое стекловолокно? Подготовка к ГИА. В3. Степень окисления химических элементов. Окислительно-восстановительные реакции
Подготовка к ГИА. В3. Степень окисления химических элементов. Окислительно-восстановительные реакции Исследование модифицирования на структуру и жидкотекучесть сплава АК12
Исследование модифицирования на структуру и жидкотекучесть сплава АК12 Использование сплавов алюминия
Использование сплавов алюминия Жёсткость воды и способы её устранения. Практическая работа №6. 9 класс
Жёсткость воды и способы её устранения. Практическая работа №6. 9 класс Обратимость химических реакций. Обратимые и необратимые химические реакции. Химическое равновесие
Обратимость химических реакций. Обратимые и необратимые химические реакции. Химическое равновесие Циклоалканы
Циклоалканы Физико-химические свойства сырья, продукции, реагентов и материалов (часть 2)
Физико-химические свойства сырья, продукции, реагентов и материалов (часть 2) Строение атомов химических элементов и природа химической связи
Строение атомов химических элементов и природа химической связи Физические и химические свойства алканов
Физические и химические свойства алканов