Содержание
- 2. План лекции Планетарная модель атома. Квантово-механическая модель атома водорода: двойственная природа электрона; орбиталь, квантовые числа. Периодический
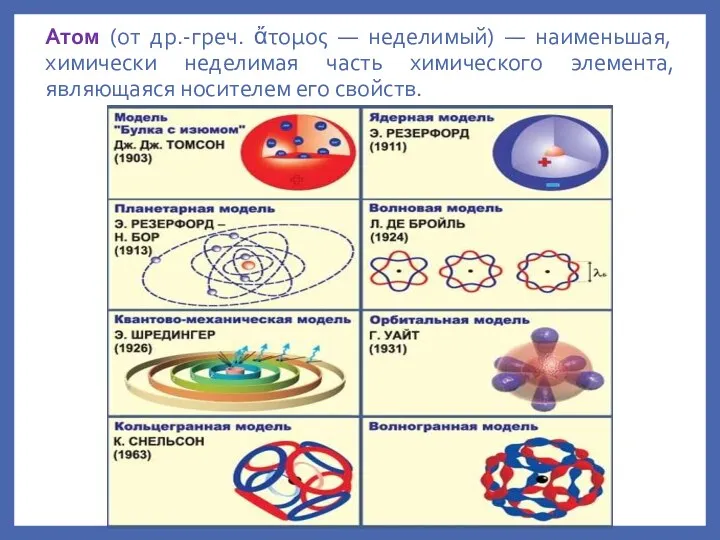
- 3. Атом (от др.-греч. ἄτομος — неделимый) — наименьшая, химически неделимая часть химического элемента, являющаяся носителем его
- 4. Современная модель строения атома В основе современной теории строения атома лежат работы: Дж. Томсона (который в
- 5. Недостатки модели Резерфорда были устранены Н. Бором, который, дополнив ее новыми постулатами, представил динамическую модель строения
- 6. . М. Планка (который в 1900 г. высказал предложение, что вещества поглощают и пропускают энергию дискретными
- 7. Пространство вокруг ядра, в котором вероятность нахождения электрона достаточно велика, называется орбиталью. Вероятность нахождения электрона внутри
- 8. Современная модель строения атома базируется на четырех положениях: 1. В центре атома находится положительно заряженное ядро,
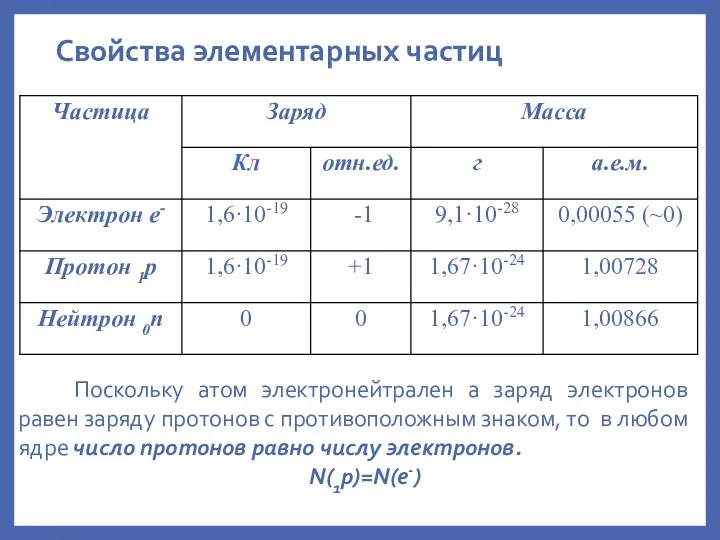
- 9. Свойства элементарных частиц Поскольку атом электронейтрален а заряд электронов равен заряду протонов с противоположным знаком, то
- 10. А – массовое число. A = N(1p) + N(0n) Z – заряд ядра (порядковый номер элемента).
- 11. Нуклиды — это отдельный вид атомов какого-либо химического элемента с ядром, состоящим из строго определённого числа
- 12. Квантовые числа Атом - квантовая система, т.е. система микрочастиц, поведение которых описывается законами квантовой механики при
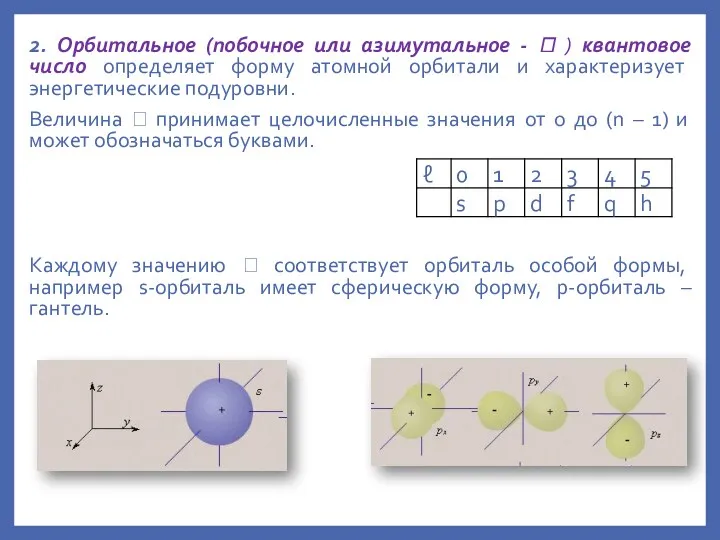
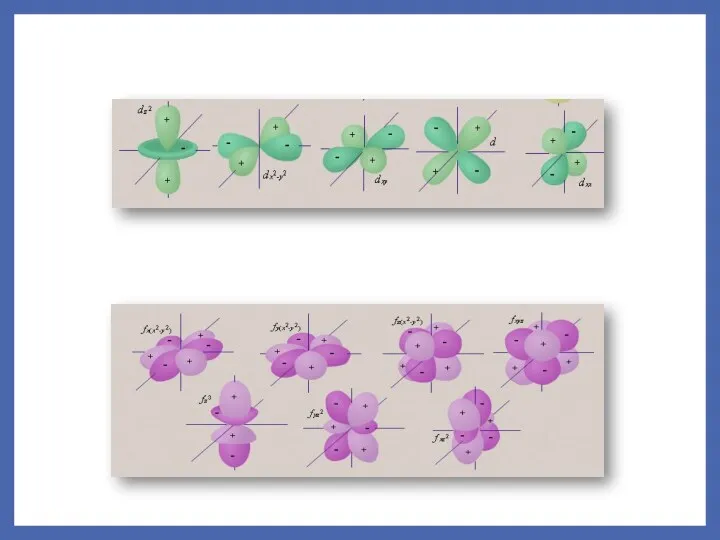
- 13. 2. Орбитальное (побочное или азимутальное - ) квантовое число определяет форму атомной орбитали и характеризует
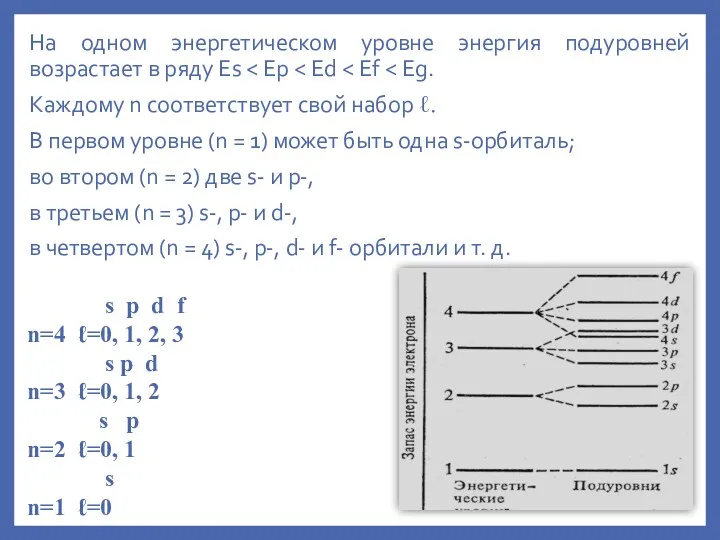
- 14. На одном энергетическом уровне энергия подуровней возрастает в ряду Es Каждому n соответствует свой набор ℓ.
- 15. 3. Магнитное квантовое число m m – характеризует ориентацию орбиталей в пространстве; принимает значения –…0…+ .
- 17. 4. Магнитное спиновое квантовое число (ms) характеризует механический момент движения электронов и имеет два значения +1/2
- 18. Электронные конфигурации атомов Распределение электронов по уровням и подуровням подчиняется определенным закономерностям. Принцип наименьшей энергии. Если
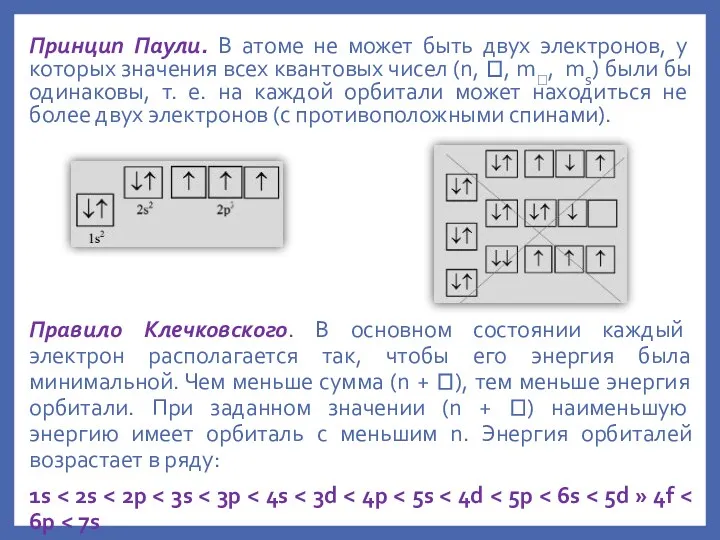
- 19. Принцип Паули. В атоме не может быть двух электронов, у которых значения всех квантовых чисел (n,
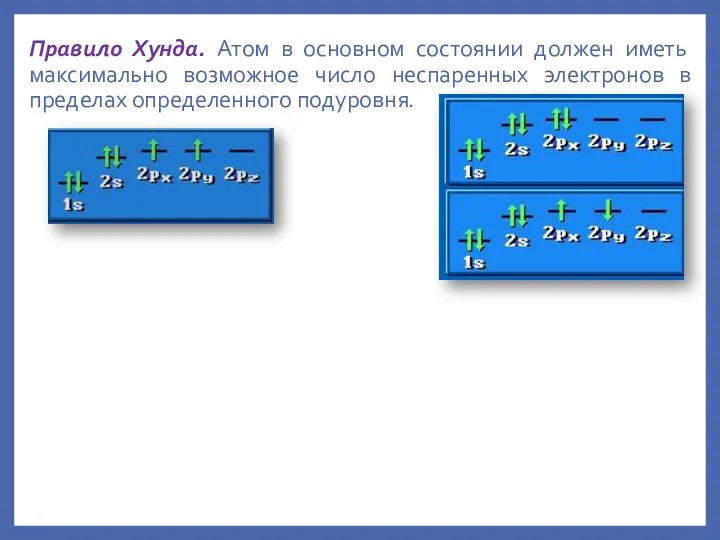
- 20. Правило Хунда. Атом в основном состоянии должен иметь максимально возможное число неспаренных электронов в пределах определенного
- 21. Запись, отражающая распределение электронов в атоме химического элемента по энергетическим уровням и подуровням, называется электронной конфигурацией
- 22. Например, энергия электрона на подуровне 4s меньше, чем на подуровне 3d, так как в первом случае
- 23. Строение электронной оболочки атома Энергетический уровень Число энергетических уровней в атоме равно номеру периода, в котором
- 24. Энергетический подуровень Число подуровней на каждом энергетическом уровне равно номеру уровня!!!
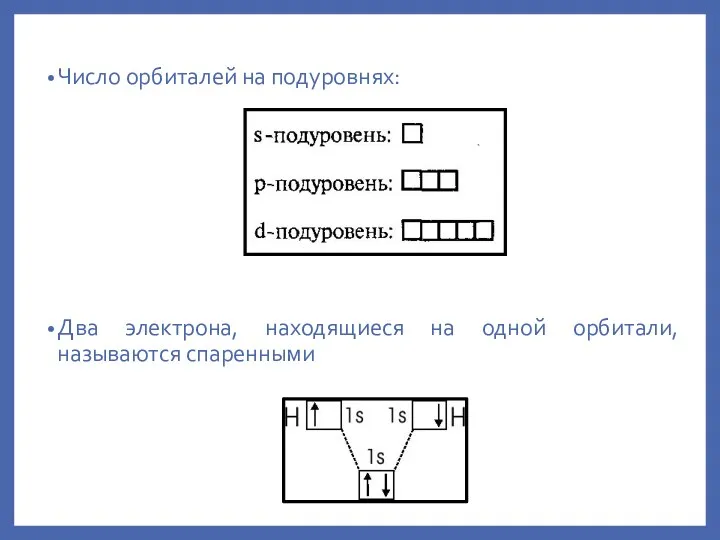
- 25. Число орбиталей на подуровнях: Два электрона, находящиеся на одной орбитали, называются спаренными
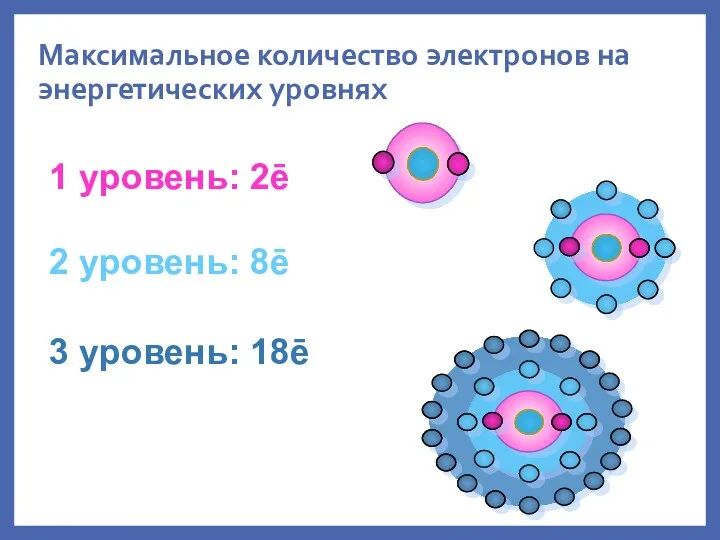
- 26. 1 уровень: 2ē Максимальное количество электронов на энергетических уровнях 2 уровень: 8ē 3 уровень: 18ē
- 27. Электронные конфигурации атомов Чтобы правильно изображать электронные конфигурации атомов, нужно знать: Число электронов в атоме (равно
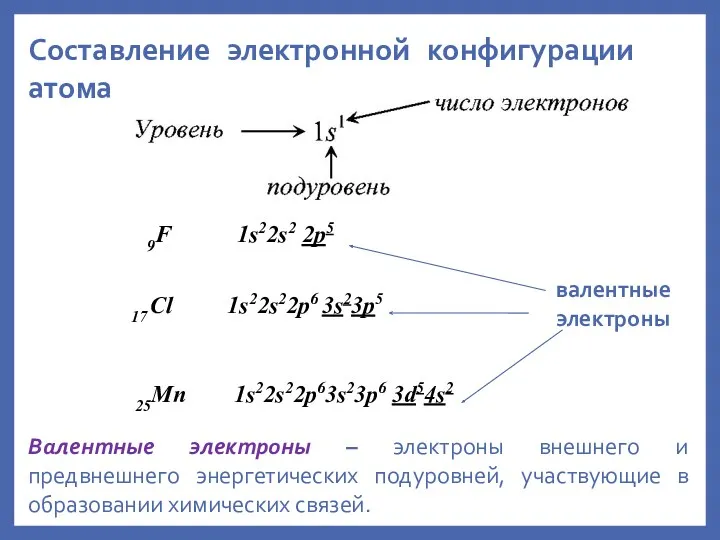
- 28. 25Mn 1s22s22p63s23p6 3d54s2 Составление электронной конфигурации атома 9F 1s22s2 2p5 17 Cl 1s22s22p6 3s23p5 валентные электроны
- 29. «Проскок» электрона Внешние оболочки с конфигурациями d4 и d9 нестабильны и стремятся перейти в устойчивые заполненные
- 30. Периодический закон Д.И. Менделеева Свойства химических элементов, а также формы и свойства их соединений находятся в
- 31. Периодическая система химических элементов (ПСХЭ) – это графическое отражение периодического закона. Различают короткопериодную и длиннопериодную.
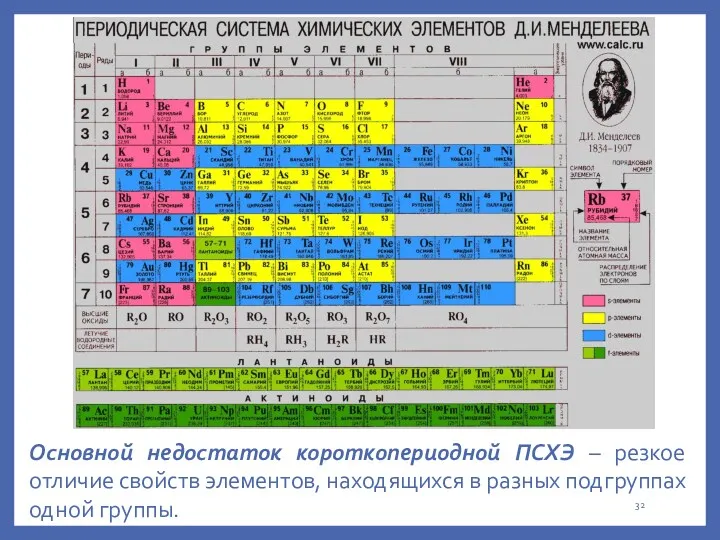
- 32. Основной недостаток короткопериодной ПСХЭ – резкое отличие свойств элементов, находящихся в разных подгруппах одной группы.
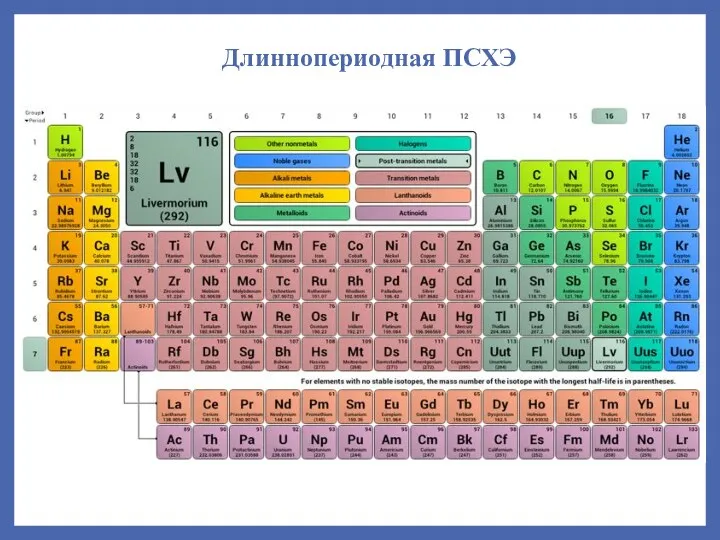
- 33. Длиннопериодная ПСХЭ
- 34. Период – горизонтальный ряд химических элементов, расположенных в порядке возрастания их порядкового номера, начиная со щелочного
- 35. Группа – вертикальный ряд элементов в ПСХЭ. Группа состоит из двух подгрупп – главной (обозначается А)
- 36. Свойства атомов Металличность – способность атомов отдавать электроны. Способность к отдаче электронов количественно определяется потенциалом ионизации.
- 38. Валентность – это способность атомов химических элементов образовывать строго определенное число связей в соединении. Число связей,
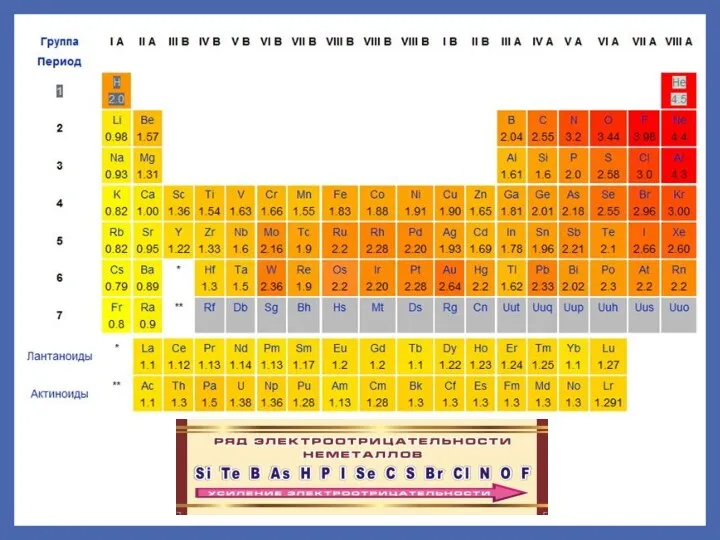
- 39. Характеристики химических элементов закономерно изменяются в группах и периодах. В периодах (с увеличением порядкового номера) увеличивается
- 40. В группах (с увеличением порядкового номера): увеличивается заряд ядра; увеличивается радиус атомов. Только в А-группах: уменьшается
- 42. Скачать презентацию


























 Типы химических реакций
Типы химических реакций Закон сохранения массы веществ
Закон сохранения массы веществ Современная химия. (Лекция 6)
Современная химия. (Лекция 6) Зиянды организмдерге қарсы органикалық және органикалық емес қосылыстарды қолдануға негізделген тәсіл
Зиянды организмдерге қарсы органикалық және органикалық емес қосылыстарды қолдануға негізделген тәсіл Кристаллические решетки
Кристаллические решетки Аналитические химические реакции. Классификация аналитических химических реакций
Аналитические химические реакции. Классификация аналитических химических реакций Материаловедение и технологии конструкционных материалов
Материаловедение и технологии конструкционных материалов Хімічний склад жувальної гумки
Хімічний склад жувальної гумки Мыльное чудо своими руками. История мыловарения. Изготовление мыла в домашних условиях
Мыльное чудо своими руками. История мыловарения. Изготовление мыла в домашних условиях Элементы триады железа: Fe, Co, Ni. (Лекция 16)
Элементы триады железа: Fe, Co, Ni. (Лекция 16) Техника безопасности в химической лаборатории и на уроках химии
Техника безопасности в химической лаборатории и на уроках химии Моющие средства
Моющие средства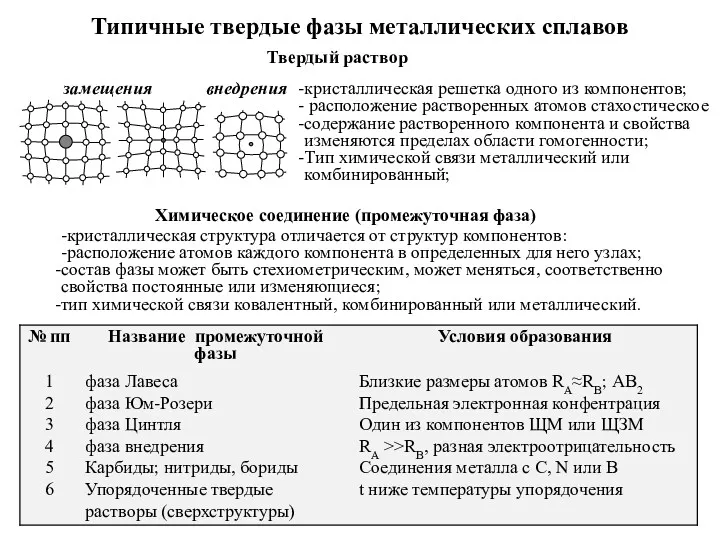 Типичные твердые фазы металлических сплавов
Типичные твердые фазы металлических сплавов Гигиена питания школьников
Гигиена питания школьников Классификация химических реакций
Классификация химических реакций Геохимия литосферы
Геохимия литосферы Гомополисахариды (углеводы растений)
Гомополисахариды (углеводы растений) Простые вещества. Металлы и неметаллы
Простые вещества. Металлы и неметаллы Полифенолды қосылыстар. Флавоноидтар
Полифенолды қосылыстар. Флавоноидтар Физико-химические свойства белков. Количественные (колориметрические) методы определения концентрации белка
Физико-химические свойства белков. Количественные (колориметрические) методы определения концентрации белка Гидролиз солей
Гидролиз солей Необоротні і оборотні хімічні процеси. Хімічна рівновага. Принцип Ле Шательє
Необоротні і оборотні хімічні процеси. Хімічна рівновага. Принцип Ле Шательє Введение. Развитие химической технологии как науки
Введение. Развитие химической технологии как науки Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Щелочные металлы IА группы. Литий
Щелочные металлы IА группы. Литий Окисно-відновні реакції. 9 клас
Окисно-відновні реакції. 9 клас Пластмассы, синтетические каучуки
Пластмассы, синтетические каучуки Роль химии в создании новых материалов
Роль химии в создании новых материалов