Содержание
- 2. Понятие "атом" пришло к нам из далекой античности ( в переводе с греческого "атом" означает "
- 3. Доказательства сложности строения атома. 1891г. - ирландский физик Стони ввёл понятие "электрон" для обозначения частиц, электризующих
- 4. Модели строения атома. - - - - - - - - - - - + +
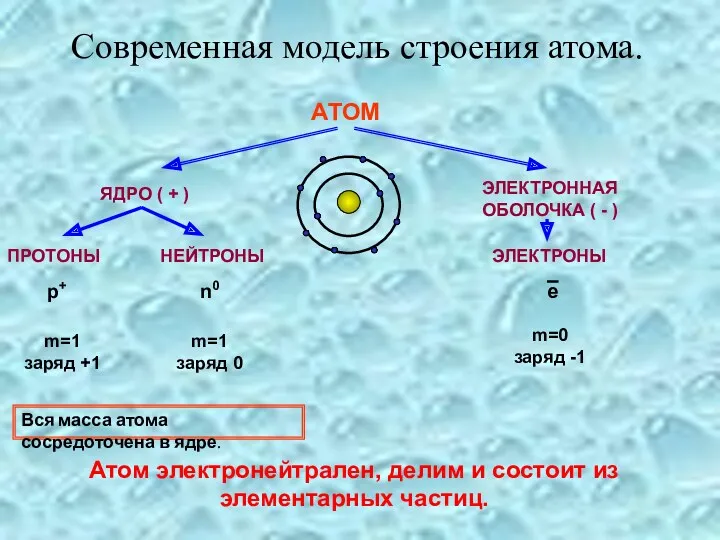
- 5. Современная модель строения атома. АТОМ ЯДРО ( + ) ЭЛЕКТРОННАЯ ОБОЛОЧКА ( - ) ПРОТОНЫ НЕЙТРОНЫ
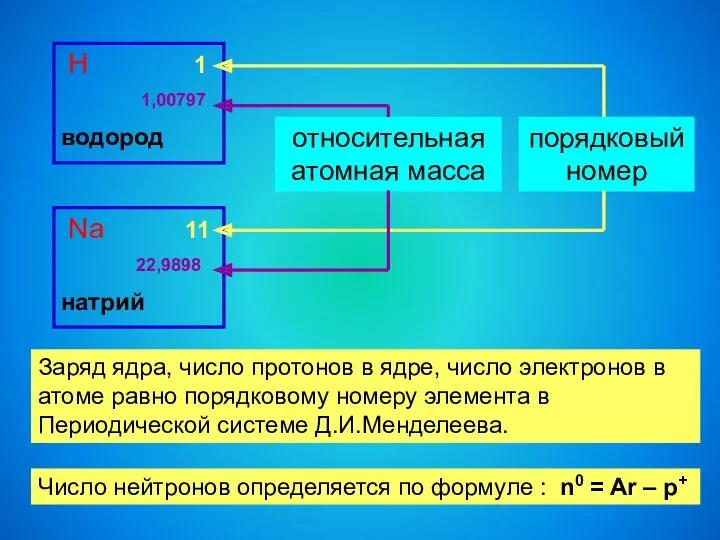
- 6. Н 1 1,00797 водород Na 11 22,9898 натрий порядковый номер относительная атомная масса Заряд ядра, число
- 7. H p+ 1 ē 1 n0 0 Na p+ 11 ē 11 n0 12 Определите число
- 8. ? Что произойдет, если изменить число протонов в ядре, т.е. заряд атомного ядра ? Ответ :
- 9. Строение электронных оболочек атомов. Каждый электрон в атоме обладает запасом энергии ( Е связи). Электроны, имеющие
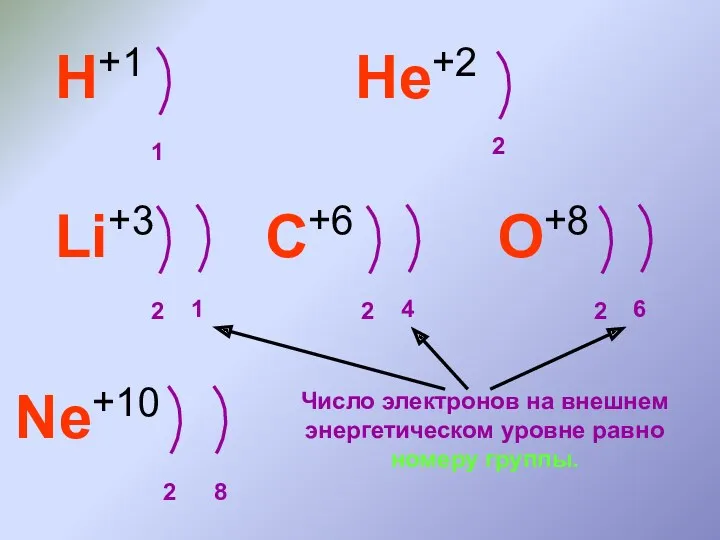
- 10. H+1 1 He+2 2 Li+3 2 1 C+6 2 4 O+8 2 6 Ne+10 8 2
- 11. H+1 1 He+2 2 Li+3 2 1 C+6 2 4 O+8 2 6 Ne+10 8 2
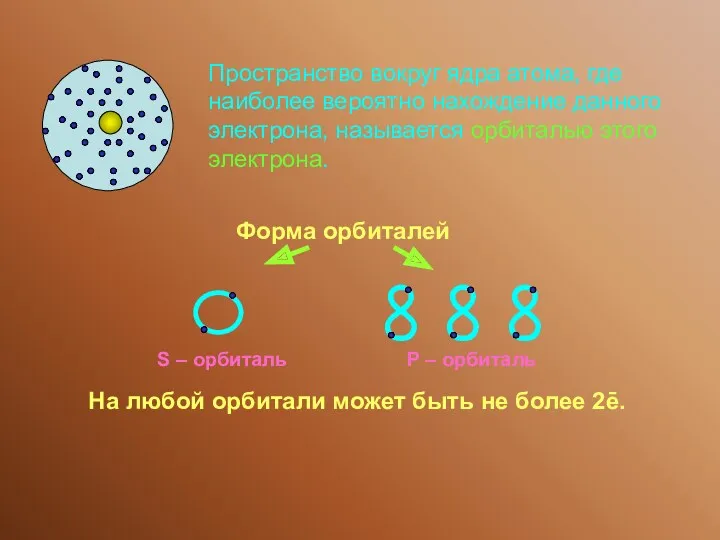
- 12. ∞ Пространство вокруг ядра атома, где наиболее вероятно нахождение данного электрона, называется орбиталью этого электрона. Форма
- 13. Электронные формулы. H+1 1 1S1 № эн. уровня форма орбитали число ē на данной орбитали He+2
- 14. Напишите распределение электронов по энергетическим уровням и электронные формулы для следующих атомов. Mg+12 2 8 2
- 15. Ковалентная связь. Определение Ковалентная химическая связь — это связь, возникающая между атомами за счет образования общих
- 16. Ковалентная связь. Механизмы образования Механизм образования такой связи может быть обменным и донорно-акцепторным. I. Обменный механизм
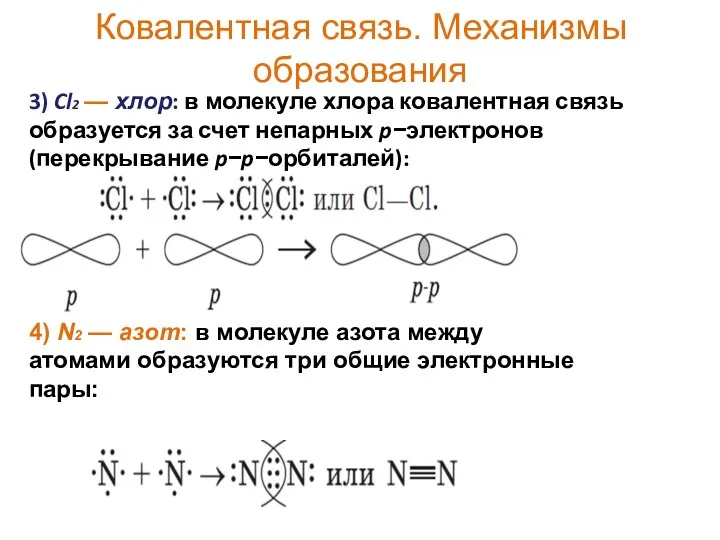
- 17. Ковалентная связь. Механизмы образования 3) Cl2 — хлор: в молекуле хлора ковалентная связь образуется за счет
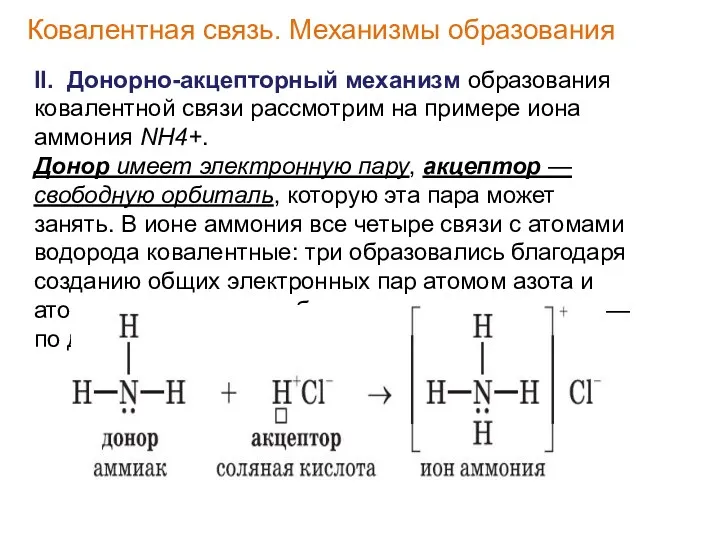
- 18. II. Донорно-акцепторный механизм образования ковалентной связи рассмотрим на примере иона аммония NH4+. Донор имеет электронную пару,
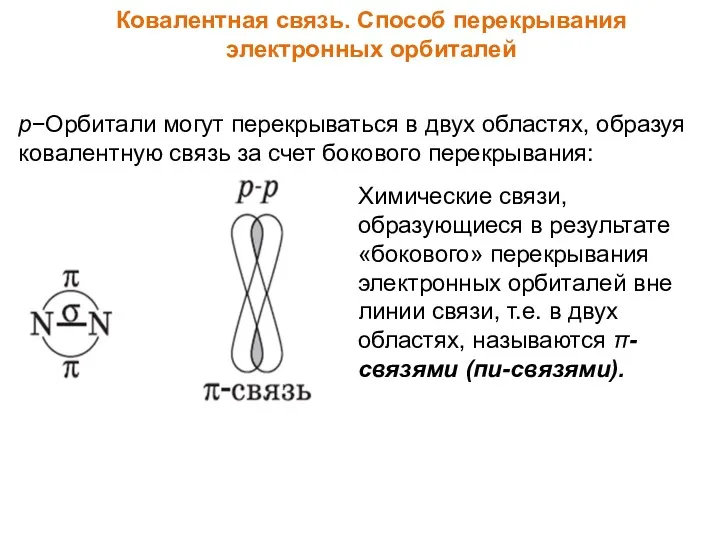
- 19. Ковалентные связи можно классифицировать по способу перекрывания электронных орбиталей. Химические связи, образующиеся в результате перекрывания электронных
- 20. Ковалентная связь. Способ перекрывания электронных орбиталей p−Орбитали могут перекрываться в двух областях, образуя ковалентную связь за
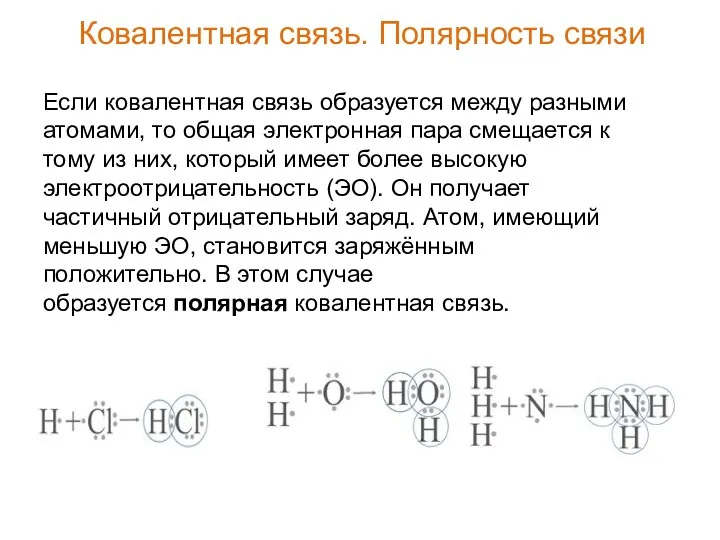
- 21. Ковалентная связь. Полярность связи Ковалентные связи можно классифицировать по смещению их к одному из связанных атомов.
- 22. Если ковалентная связь образуется между разными атомами, то общая электронная пара смещается к тому из них,
- 23. Полярность ковалентной связи — это значения частичных зарядов на связанных атомах. Полярность ковалентной связи зависит от
- 24. Ковалентная связь. Длина связи Важнейшими характеристиками ковалентной связи являются длина, полярность и прочность. Эти характеристики определяют
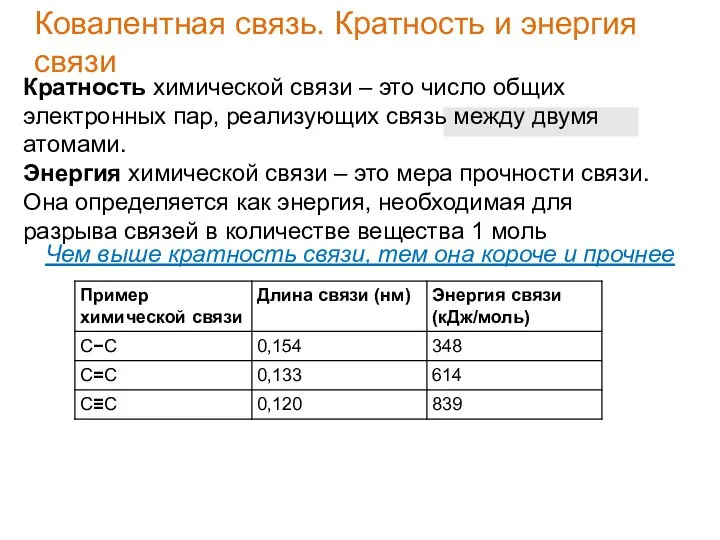
- 25. Кратность химической связи – это число общих электронных пар, реализующих связь между двумя атомами. Энергия химической
- 26. Ковалентная связь. Прочность связи Прочность ковалентной связи — устойчивость общей электронной пары к разрыву. Прочность связи
- 28. Скачать презентацию
















 Явления, происходящие с веществами
Явления, происходящие с веществами Оксиды. Классификация. Химические и физические свойства
Оксиды. Классификация. Химические и физические свойства Общая и неорганическая химия. Классы неорганических соединений. Способы выражения состава растворов
Общая и неорганическая химия. Классы неорганических соединений. Способы выражения состава растворов Степень окисления
Степень окисления Галогены. Физические свойства галогенов
Галогены. Физические свойства галогенов Валентные возможности атомов химических элементов
Валентные возможности атомов химических элементов Фунгициды. Достоинства и недостати
Фунгициды. Достоинства и недостати Застосування неметалів
Застосування неметалів Органическая химия. Ацетилен
Органическая химия. Ацетилен Дослідження якісного складу солей. Практична робота №1
Дослідження якісного складу солей. Практична робота №1 Термохимия. Термохимические уравнения
Термохимия. Термохимические уравнения Растворы. Лекция 1
Растворы. Лекция 1 Композиционные материалы
Композиционные материалы Химия. ОГЭ
Химия. ОГЭ Кристаллические решетки
Кристаллические решетки Бериллий. Строение элемента. Физические и химические свойства. Способы получения. Применение. Интересные факты. Опыты
Бериллий. Строение элемента. Физические и химические свойства. Способы получения. Применение. Интересные факты. Опыты Изомерия. Виды изомерии
Изомерия. Виды изомерии Понятие Химический элемент
Понятие Химический элемент Кристаллография и основы кристаллохимии
Кристаллография и основы кристаллохимии Гетероциклические соединения
Гетероциклические соединения Получение и установление состава кристаллогидрата фосфата цинка
Получение и установление состава кристаллогидрата фосфата цинка Основания. Химические свойства оснований. Сильные и слабые основания
Основания. Химические свойства оснований. Сильные и слабые основания Химиялық реакциялардың типтері
Химиялық реакциялардың типтері Дисперсные системы
Дисперсные системы Энергетика химических процессов. Энтропия и энергия Гиббса
Энергетика химических процессов. Энтропия и энергия Гиббса Крохмаль і целюлоза. Полімерна будова, властивості, застосування
Крохмаль і целюлоза. Полімерна будова, властивості, застосування Кремний и его соединения
Кремний и его соединения Способы разделения смесей
Способы разделения смесей