Содержание
- 2. Содержание Энтропия Второе начало термодинамики Энергия Гиббса. Термодинамическая возможность прохождения химической реакции Влияние температуры на направление
- 3. Энтропия (S) Предложена Клаузиусом как функция, изменение которой равно отношению теплоты, поглощенной системой, к абсолютной температуре:
- 4. Термодинамическая вероятность состояния Состояние системы можно характеризовать значениями параметров (температура, давление, объем), которые определяют макросостояние системы
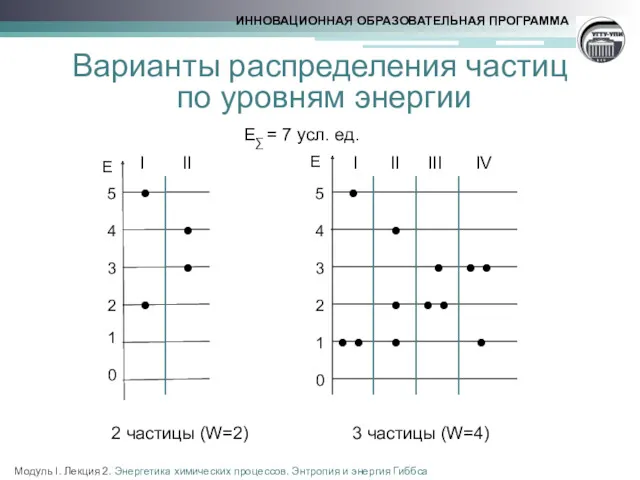
- 5. Варианты распределения частиц по уровням энергии E∑ = 7 усл. ед. 2 частицы (W=2) 3 частицы
- 6. Энтропия - мера термодинамической вероятности состояния системы Формула Больцмана: k – постоянная Больцмана R – универсальная
- 7. Уменьшением энтропии сопровождаются процессы, связанные с увеличением упорядоченности: охлаждение, кристаллизация, конденсация веществ; реакции с уменьшением объема
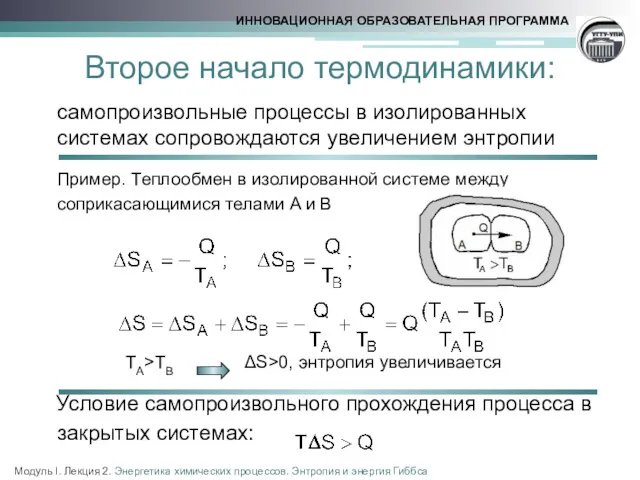
- 8. Второе начало термодинамики: самопроизвольные процессы в изолированных системах сопровождаются увеличением энтропии Пример. Теплообмен в изолированной системе
- 9. Расчет изменения энтропии химической реакции в стандартных условиях Энтропия реакции равна разности сумм энтропий продуктов реакции
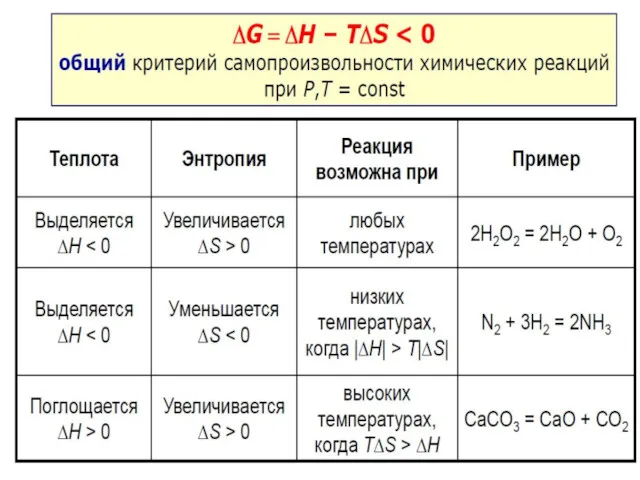
- 10. Энергия Гиббса Самопроизвольное прохождение химической реакции в закрытой системе (р, Т = const) возможно при условии
- 11. Энергия Гиббса – критерий возможности самопроизвольного прохождения химических реакций Процессы, для которых ΔG ΔG>0 – термодинамически
- 12. Влияние температуры на направление химической реакции 1. ΔH Пример: N2 + 3H2 = 2NH3 2. ΔH>0,
- 14. Расчет стандартной энергии Гиббса химической реакции В справочниках – значения стандартных энергий Гиббса образования веществ (ΔG0обр,
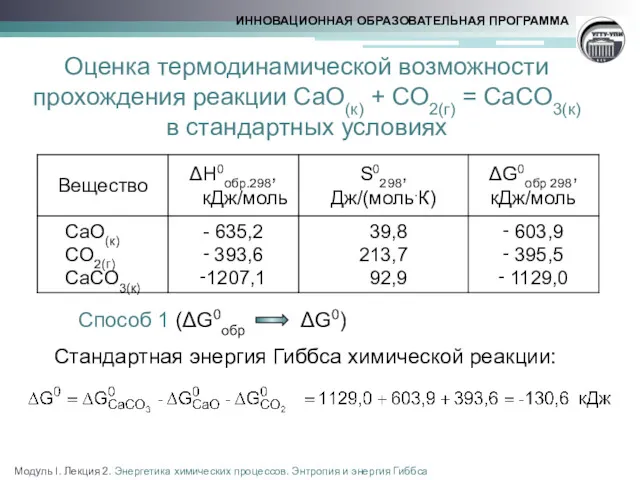
- 15. Оценка термодинамической возможности прохождения реакции CaO(к) + CO2(г) = CaCO3(к) в стандартных условиях Способ 1 (ΔG0обр
- 16. Оценка термодинамической возможности прохождения реакции CaO(к) + CO2(г) = CaCO3(к) в стандартных условиях Способ 2 (ΔH0обр
- 17. Заключение Согласно II началу термодинамики самопроизвольные процессы в изолированных системах сопровождаются увеличением энтропии Энтропия по своему
- 19. Скачать презентацию












 Структура реального кристалла
Структура реального кристалла Современные методы физико-химической биологии
Современные методы физико-химической биологии Закон сохранения массы веществ
Закон сохранения массы веществ Резина и её свойства . Полимеры и их использование
Резина и её свойства . Полимеры и их использование Липиды (Жиры)
Липиды (Жиры) Неметаллы. Общая характеристика
Неметаллы. Общая характеристика Углеводороды. Значение углеводородов
Углеводороды. Значение углеводородов Химические свойства органических веществ
Химические свойства органических веществ 20230419_alkiny_uglub
20230419_alkiny_uglub Углеводороды. Алканы
Углеводороды. Алканы Сложные эфиры. 10 класс
Сложные эфиры. 10 класс Органічні розчинники
Органічні розчинники Липиды (жиры)
Липиды (жиры) Химия и биологическая роль элементов VIIА-группы
Химия и биологическая роль элементов VIIА-группы Скорость химических реакций
Скорость химических реакций Origin of petroleum dilemma
Origin of petroleum dilemma Закон сохранения массы веществ. Уравнения химических реакций
Закон сохранения массы веществ. Уравнения химических реакций Некоторые d-элементы
Некоторые d-элементы Валентные состояния атома углерода
Валентные состояния атома углерода Химический элемент фтор
Химический элемент фтор Общие классификации смазочных материалов
Общие классификации смазочных материалов Растворы. Способы выражения концентрации растворенного вещества
Растворы. Способы выражения концентрации растворенного вещества Структурно-механические свойства дисперсных систем
Структурно-механические свойства дисперсных систем Жидкие кристаллы
Жидкие кристаллы Металлы и неметаллы
Металлы и неметаллы Кислотно-основное титрование в неводных средах
Кислотно-основное титрование в неводных средах Изохинолин туындыларының дәрілік заттарын талдау
Изохинолин туындыларының дәрілік заттарын талдау Физико-химические свойства алкенов
Физико-химические свойства алкенов