Содержание
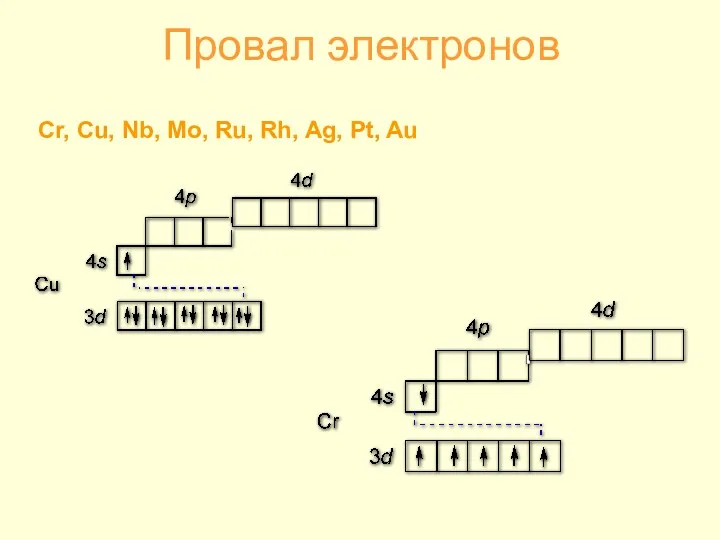
- 3. Провал электронов Cr, Cu, Nb, Mo, Ru, Rh, Ag, Pt, Au
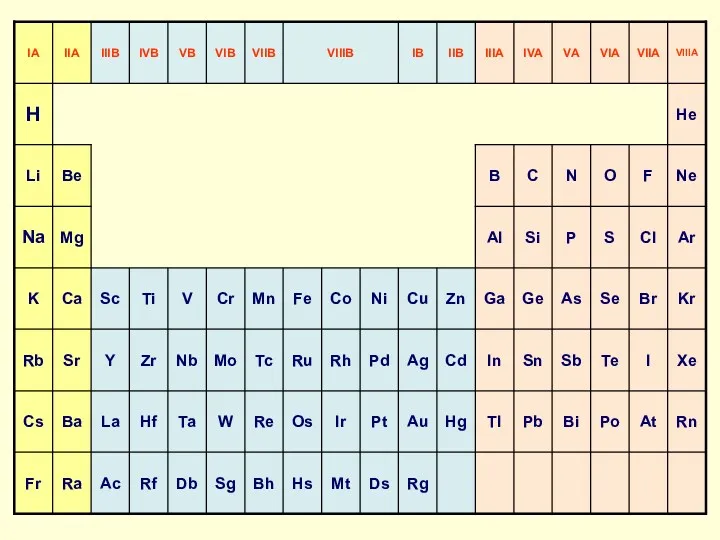
- 4. d-Элементы
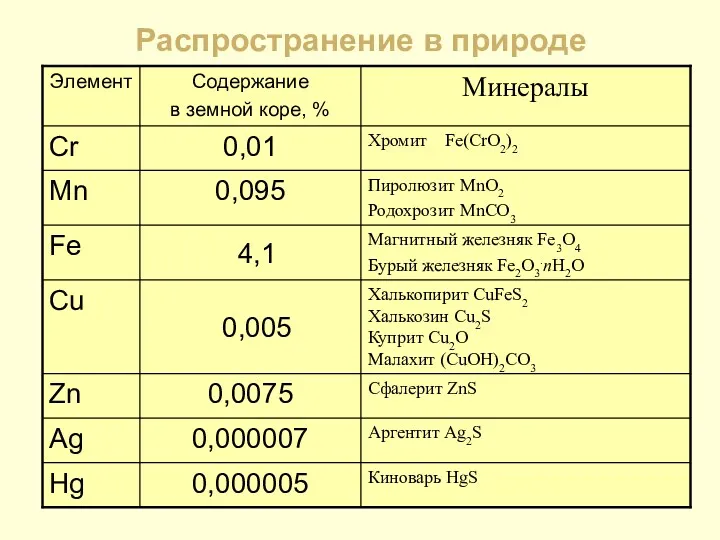
- 5. Распространение в природе
- 6. М и н е р а л ы Лимонит Fe2O3∙nH2O Магнетит Fe3O4 Сфалерит ZnS Смитсонит ZnCO3
- 7. Минералы Малахит (CuOH)2CO3 Крокоит PbCrO4 Хромит (Fe,Cr2)O4
- 8. Минералы Киноварь HgS Пиролюзит MnO2 Серебро Ag
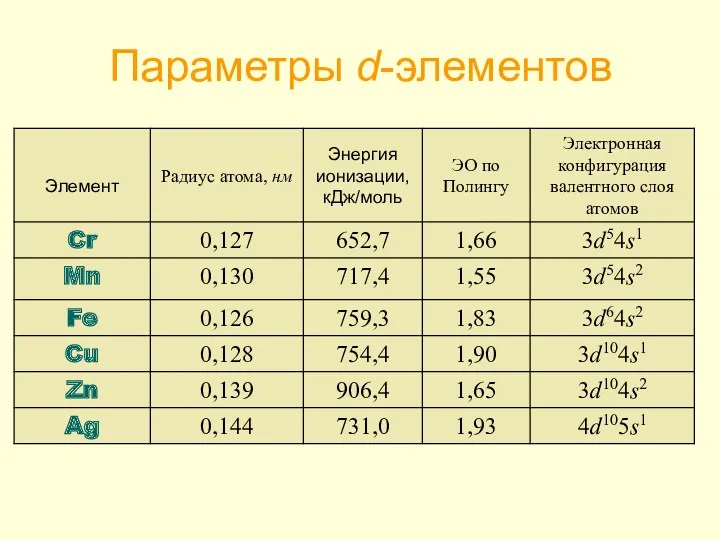
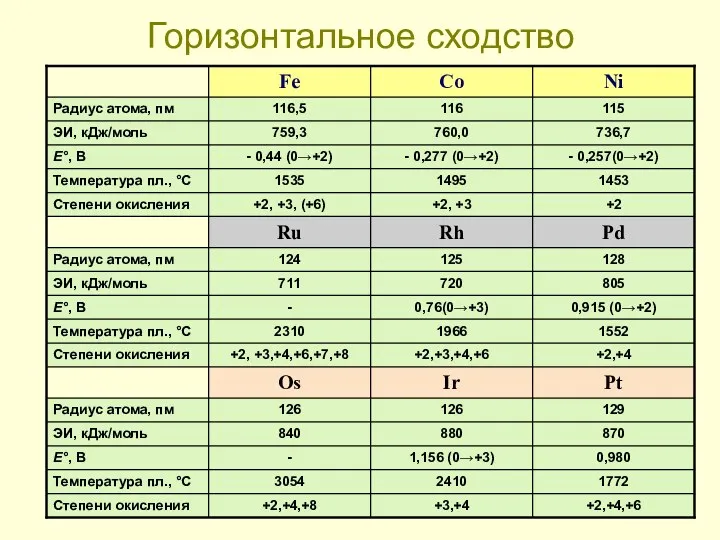
- 9. Параметры d-элементов
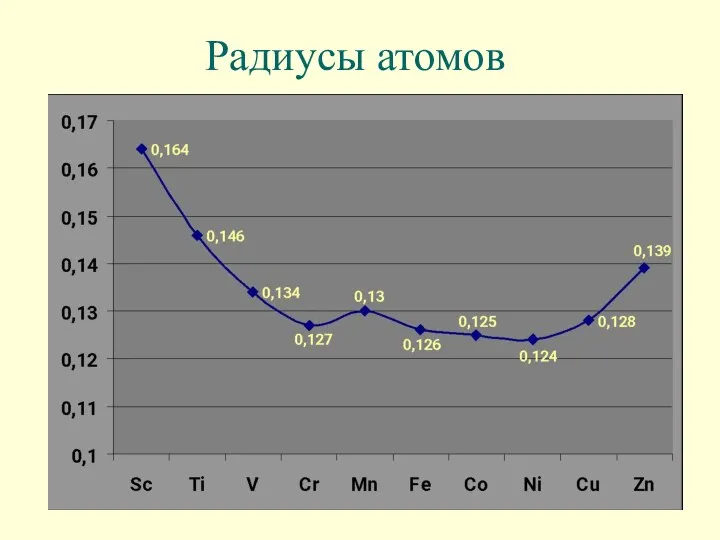
- 10. Радиусы атомов
- 11. Радиусы атомов, нм Лантаноидное f-сжатие
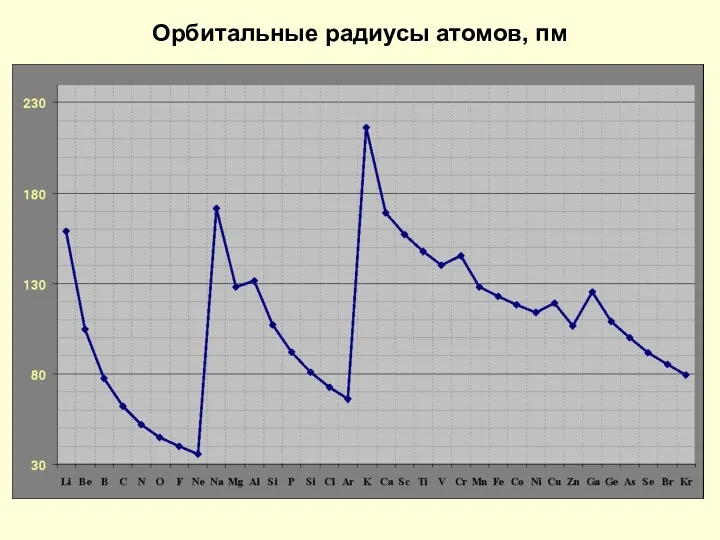
- 12. Орбитальные радиусы атомов, пм
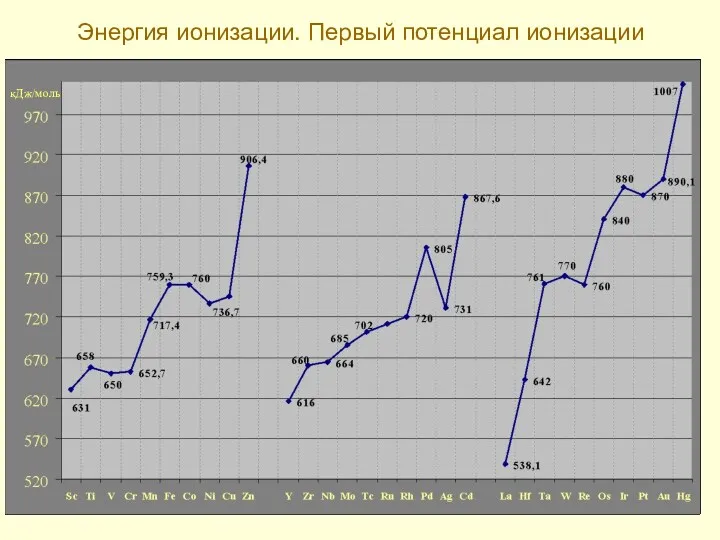
- 13. Энергия ионизации. Первый потенциал ионизации кДж/моль
- 14. Энергия ионизации. Второй потенциал ионизации кДж/моль
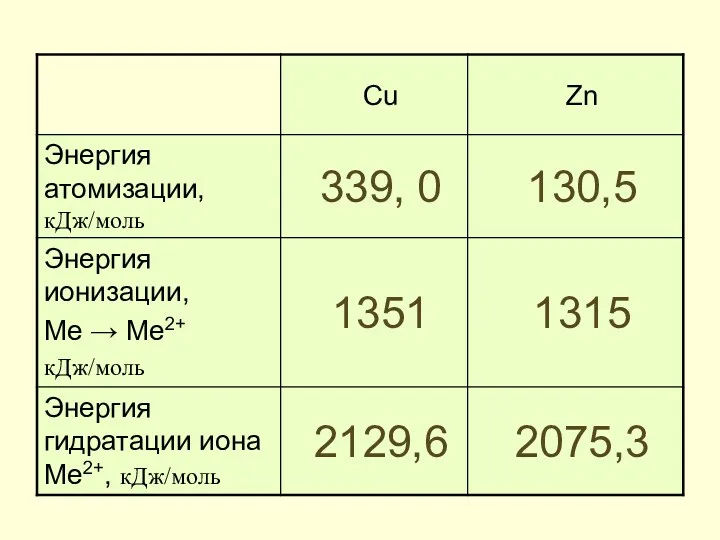
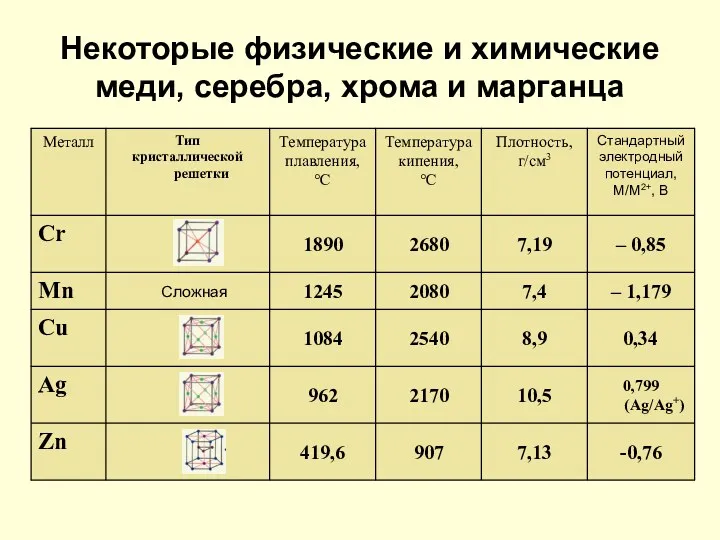
- 16. Некоторые физические и химические меди, серебра, хрома и марганца
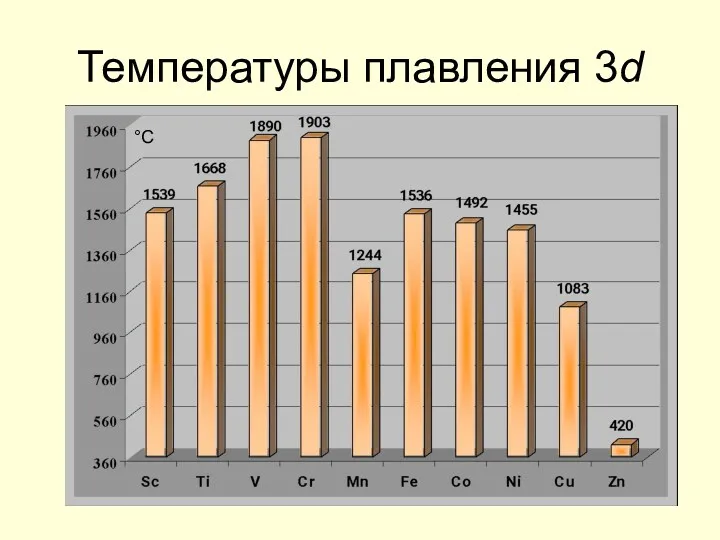
- 17. Температуры плавления 3d °С
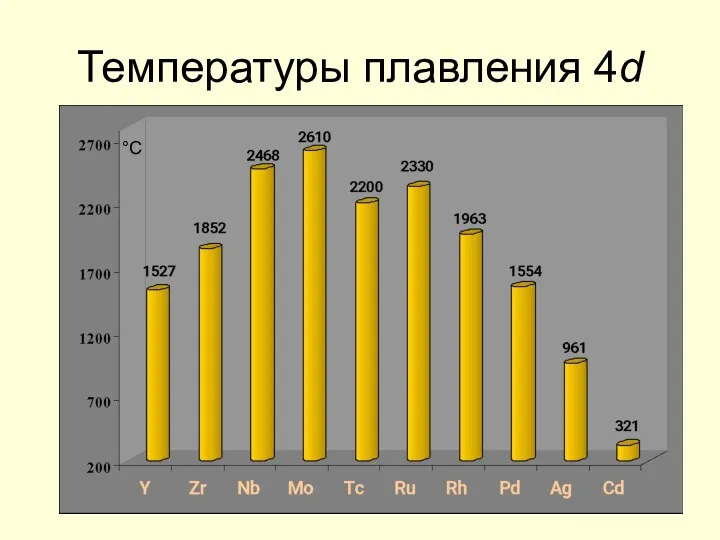
- 18. Температуры плавления 4d °С
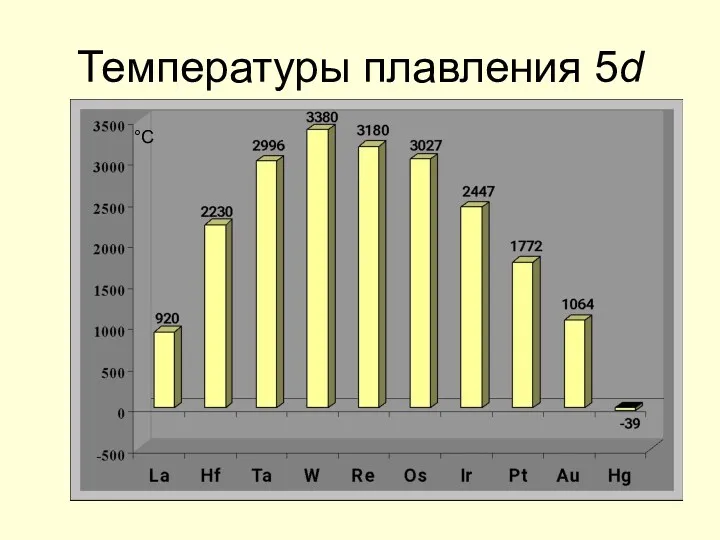
- 19. Температуры плавления 5d °С
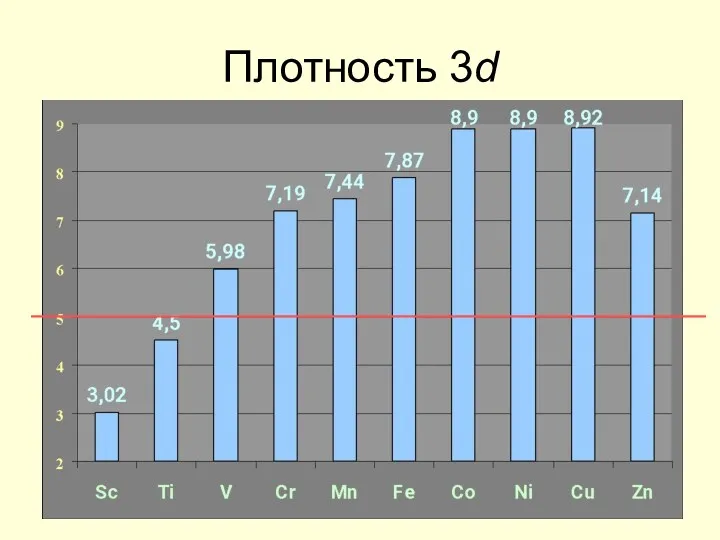
- 20. Плотность 3d
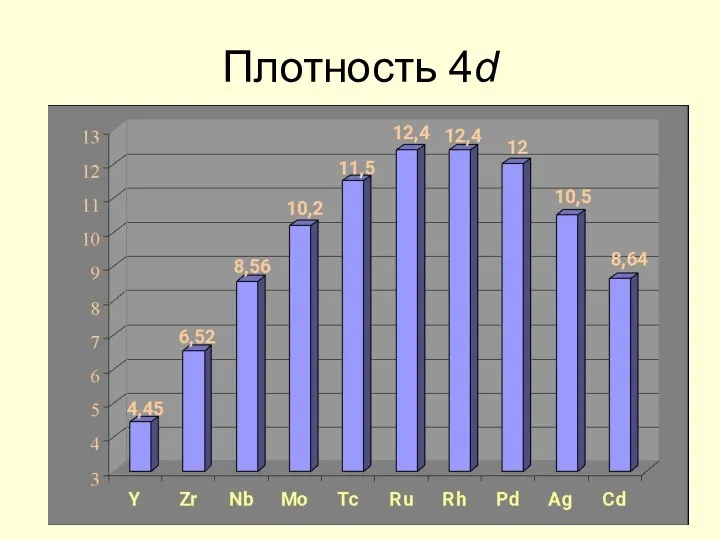
- 21. Плотность 4d
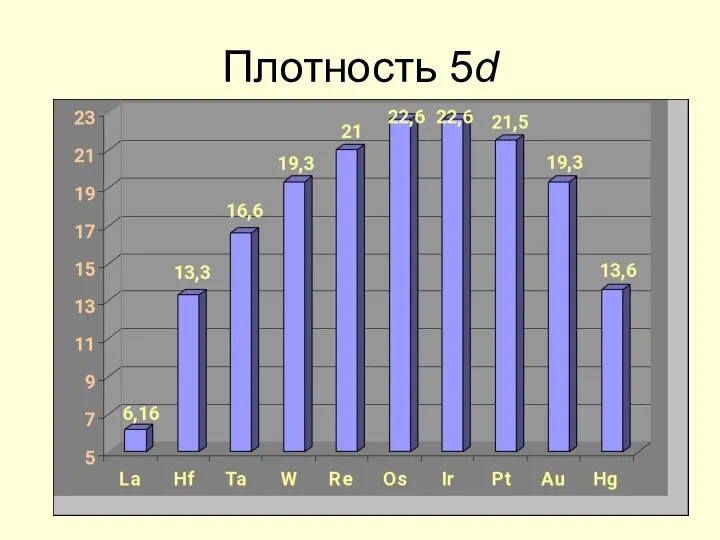
- 22. Плотность 5d
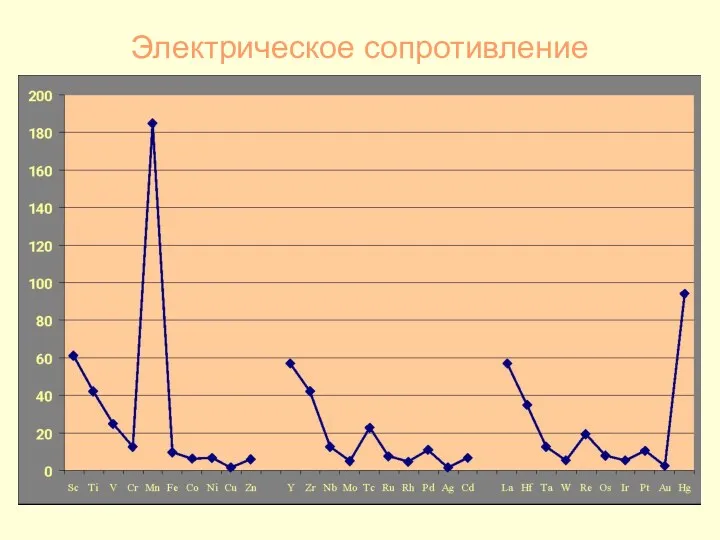
- 23. Электрическое сопротивление
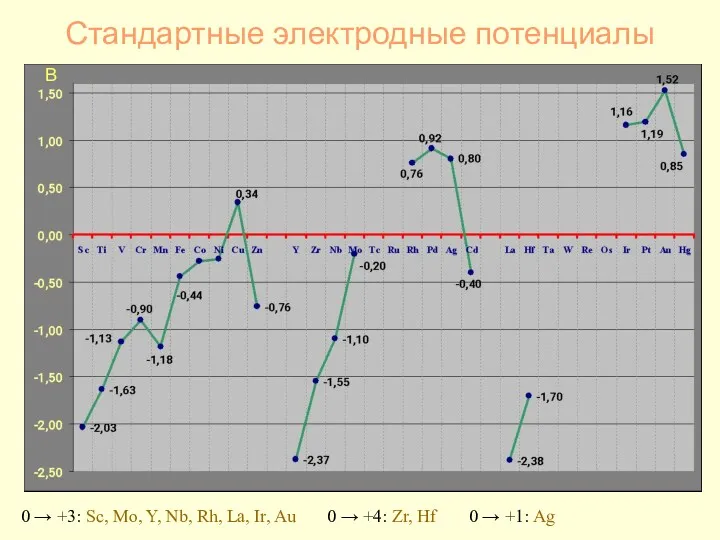
- 24. Стандартные электродные потенциалы В 0 → +3: Sc, Mo, Y, Nb, Rh, La, Ir, Au 0
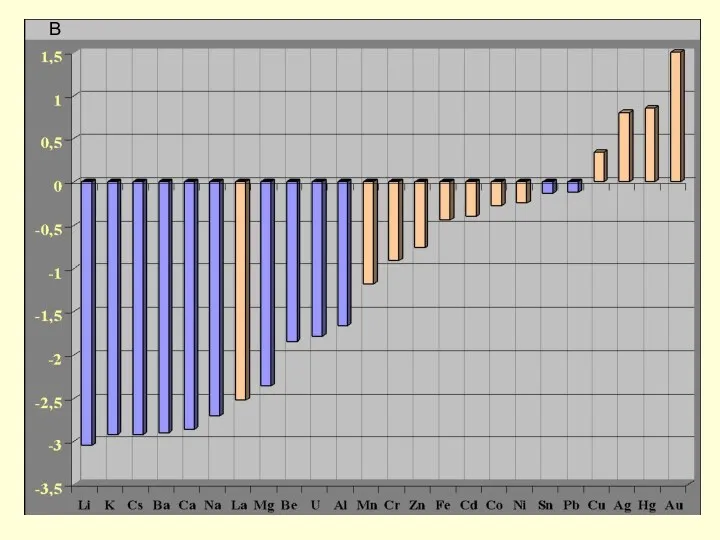
- 25. В
- 26. Горизонтальное сходство
- 27. Устойчивость высшей степени окисления 4Cr(порошок) + 3O2 = 2Cr2O3 (медленно) 2Mo + 3O2 = 2MoO3 (600-700
- 28. Химические свойства меди 2Cu + O2 = 2CuO Cu + Cl2 = CuCl2 2Cu + S
- 29. Химические свойства серебра 2Ag + Cl2 = 2AgCl 2Ag + S = Ag2S 2Ag + 2H2SO4
- 30. Химические свойства цинка Zn + H2O (пар) = ZnO + H2 Zn + 2HCl = ZnCl2
- 31. Химические свойства ртути 2Hg + 2H2SO4 = Hg2SO4 + SO2 + 2H2O Hg + 2H2SO4 =
- 32. Химические свойства хрома Cr + H2SO4 (разб.) = CrSO4 + H2↑ 4Cr (порошок) + 3O2 =
- 33. Химические свойства марганца Mn + Cl2 = MnCl2 Mn + O2 = MnO2 Mn + S
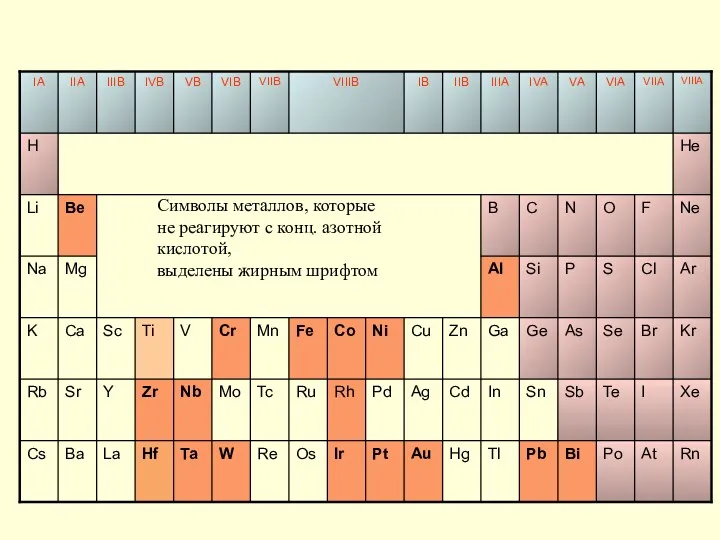
- 34. Символы металлов, которые не реагируют с конц. азотной кислотой, выделены жирным шрифтом
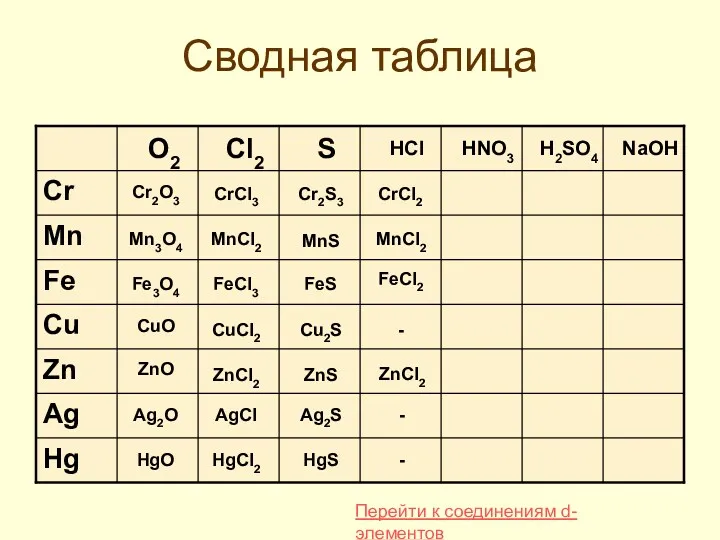
- 35. Сводная таблица Cr2O3 Mn3O4 Fe3O4 CuO ZnO Ag2O HgO CrCl3 MnCl2 FeCl3 CuCl2 ZnCl2 AgCl HgCl2
- 36. Окраска высших оксидов d-элементов
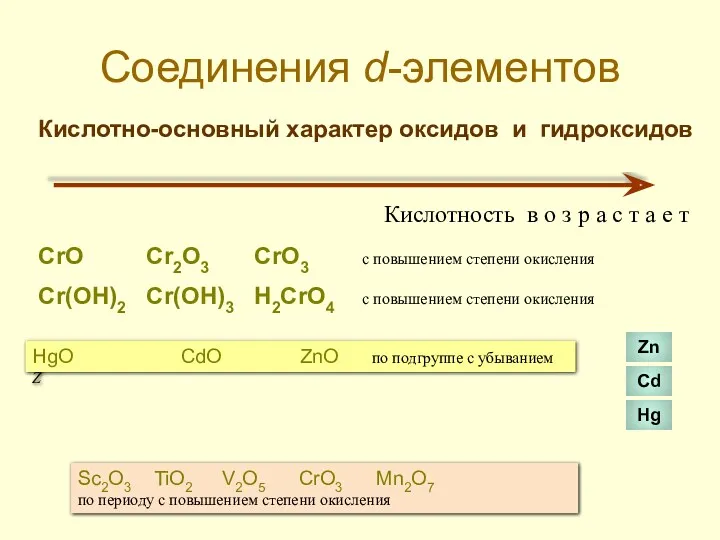
- 37. Соединения d-элементов Кислотно-основный характер оксидов и гидроксидов Кислотность в о з р а с т а
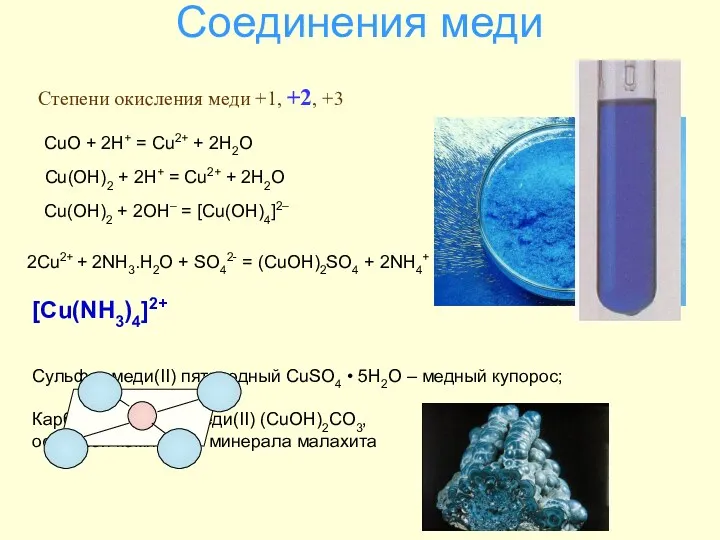
- 38. Соединения меди Cu(OH)2 + 2H+ = Cu2+ + 2H2O Cu(OH)2 + 2OH– = [Cu(OH)4]2– Сульфат меди(II)
- 39. Полезная информация к практикуму 2Cu2+ + [Fe(CN)6]4- = Cu2[Fe(CN)6]↓ Cu2+ + S2- = CuS↓ CuS +
- 40. Соединения серебра Степени окисления серебра +1, +2, +3 Ag2O 2AgNO3 + 2NaOH = Ag2O↓ +2NaNO3 +
- 41. Соединения хрома Хром был открыт в минерале крокоите PbCrO4 Луи Вокленом в 1797 г.
- 42. Соединения хрома Cr(OH)2 + 2H+ = Cr2+ + 2H2O 4CrCl2 + 4HCl + O2 = 4CrCl3
- 43. Соединения марганца MnCO3 = MnO + CO2↑ MnO2 + H2 = MnO + H2O MnO +
- 44. Окислительные свойства перманганата 2KMnO4 + 5K2SO3 + 3H2SO4 = 2MnSO4 + 6K2SO4 + 3H2O 2KMnO4 +
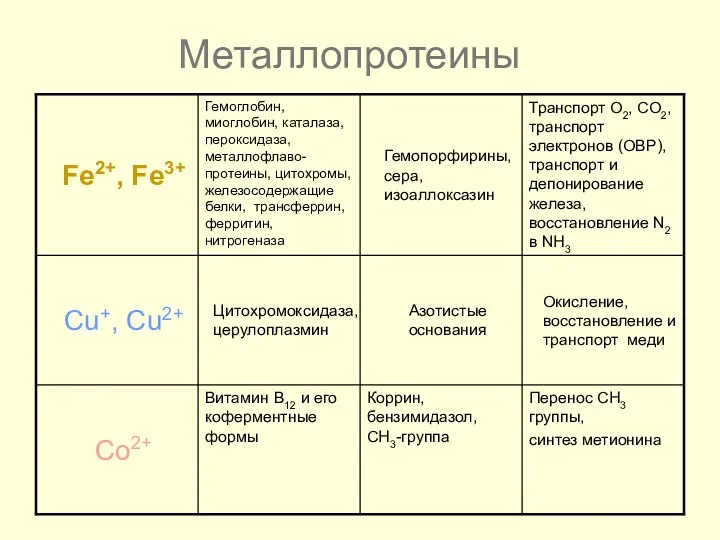
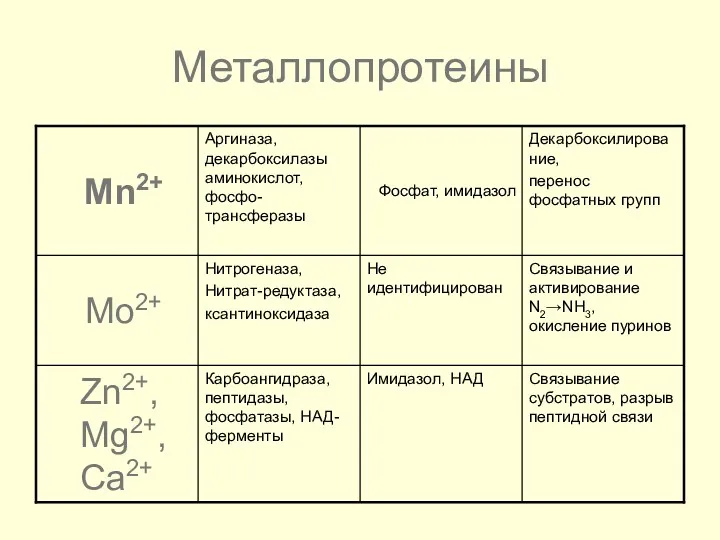
- 45. Металлопротеины
- 46. Металлопротеины
- 47. Применение
- 49. Скачать презентацию














![Полезная информация к практикуму 2Cu2+ + [Fe(CN)6]4- = Cu2[Fe(CN)6]↓ Cu2+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/347515/slide-38.jpg)






 Молекулы и атомы
Молекулы и атомы Окислительные свойства концентрированной серной кислоты
Окислительные свойства концентрированной серной кислоты Формальная кинетика. Предмет химической кинетики
Формальная кинетика. Предмет химической кинетики Аммиак. Состав вещества
Аммиак. Состав вещества Чистые вещества и смеси
Чистые вещества и смеси Поверхностно-активные вещества (ПАВ). Классификация, свойства и условия применения
Поверхностно-активные вещества (ПАВ). Классификация, свойства и условия применения Органічні речовини в живій природі. Рівні структурної органшзації
Органічні речовини в живій природі. Рівні структурної органшзації Тіршілік гетерофункционалды қосылыстар
Тіршілік гетерофункционалды қосылыстар Общая характеристика элементов V группы главной подгруппы
Общая характеристика элементов V группы главной подгруппы Актуальные вопросы содержания контрольных измерительных материалов ЕГЭ в 2019 г
Актуальные вопросы содержания контрольных измерительных материалов ЕГЭ в 2019 г Теория растворов. Диффузия в растворах. Коллигативные свойства растворов
Теория растворов. Диффузия в растворах. Коллигативные свойства растворов Природный газ
Природный газ Методы контроля и анализа веществ
Методы контроля и анализа веществ Окисно-відновні реакції. Процеси окиснення, відновлення, окисник та відновник
Окисно-відновні реакції. Процеси окиснення, відновлення, окисник та відновник Вирощування кристалів солей
Вирощування кристалів солей Углерод. Аллотропные состояния углерода
Углерод. Аллотропные состояния углерода Химические реакции. Классификация химических реакций
Химические реакции. Классификация химических реакций Лекция № 7. Конкурентные реакции у насыщенного атома
Лекция № 7. Конкурентные реакции у насыщенного атома Растворы. Типы растворов
Растворы. Типы растворов Мир камня. Чувашский национальный музей
Мир камня. Чувашский национальный музей Харчові добавки
Харчові добавки Горечи. Лекция 3
Горечи. Лекция 3 Атомно-кристаллическое строение
Атомно-кристаллическое строение Свойства органических соединений
Свойства органических соединений Устойчивость дисперсных систем
Устойчивость дисперсных систем Органічні речовини як основа сучасних матеріалів. Пластмаси, синтетичні каучуки, гума, штучні й синтетичні волокна
Органічні речовини як основа сучасних матеріалів. Пластмаси, синтетичні каучуки, гума, штучні й синтетичні волокна Атмосфера. Химия стратосферы
Атмосфера. Химия стратосферы Комплексные (или координационные) соединения
Комплексные (или координационные) соединения