3. Взаимодействие серной кислоты с металлами:
Разбавленная серная кислота ведет себя, как
обычная кислота. Активные металлы, стоящие в ряду напряжений левее водорода
Li, К, Ca, Na, Mg, Al, Mn, Zn, Fe, Co, Ni, Sn, Pb, H2, Cu, Hg, Ag, Au
вытесняют водород из разбавленной серной кислоты. Мы видим пузырьки водорода при добавлении разбавленной серной кислоты в пробирку с цинком.
H2SO4 + Zn = Zn SO4 + H2 ↑
Медь стоит в ряду напряжений после водорода – поэтому разбавленная серная кислота не действует на медь.
http://files.school-collection.edu.ru/dlrstore/9a897ea8-64e1-3877-def6-aba91







 Химический состав клетки. Неорганические вещества
Химический состав клетки. Неорганические вещества Боевые отравляющие вещества
Боевые отравляющие вещества Классификация неорганических веществ. Оксиды и основания
Классификация неорганических веществ. Оксиды и основания Классы неорганических веществ (лекция № 4/5)
Классы неорганических веществ (лекция № 4/5) Констукционные и функциональные волокнистые композиты
Констукционные и функциональные волокнистые композиты Периодические системы химических элементов
Периодические системы химических элементов Классификация органических соединений. Тема 8
Классификация органических соединений. Тема 8 Алкины. Понятие алкинов. Формула алкинов
Алкины. Понятие алкинов. Формула алкинов Генетическая классификация горных пород
Генетическая классификация горных пород Токсикология и анализ спиртов
Токсикология и анализ спиртов Классификация нефтей и товарных нефтепродуктов. Основные свойства нефтепродуктов
Классификация нефтей и товарных нефтепродуктов. Основные свойства нефтепродуктов Электролитическая диссоциация кислот, солей и оснований Степень электролитической диссоциации. Сильные и слабые электролиты
Электролитическая диссоциация кислот, солей и оснований Степень электролитической диссоциации. Сильные и слабые электролиты Решение задач. Способы выражения состава раствора
Решение задач. Способы выражения состава раствора Мембранное материаловедение
Мембранное материаловедение Классификация органических соединений. Урок химии в 10 классе
Классификация органических соединений. Урок химии в 10 классе Оксиды. 9 класс
Оксиды. 9 класс Липиды и обмен липидов
Липиды и обмен липидов Массовая доля вещества в растворе. 8 класс
Массовая доля вещества в растворе. 8 класс Водород
Водород Системы электрохимической защиты объектов трубопроводного транспорта. Нормативы
Системы электрохимической защиты объектов трубопроводного транспорта. Нормативы Нуклеиновые кислоты
Нуклеиновые кислоты Хроматографические методы анализа
Хроматографические методы анализа Тепловой эффект химических реакций
Тепловой эффект химических реакций Кристаллические решетки
Кристаллические решетки Оксиды. Формулы оксидов ( 8 класс)
Оксиды. Формулы оксидов ( 8 класс) Химия в строительстве
Химия в строительстве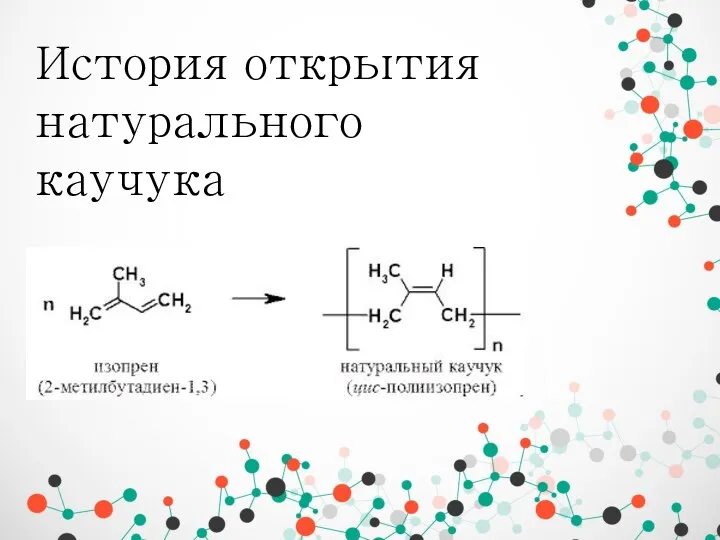 История открытия натурального каучука
История открытия натурального каучука Физические и химические свойства воды
Физические и химические свойства воды