Электролитическая диссоциация кислот, солей и оснований Степень электролитической диссоциации. Сильные и слабые электролиты презентация
Содержание
- 2. Цели урока: Дать определение кислотам, солям и основаниям с точки зрения Теории электролитической диссоциации Уметь записывать
- 3. ЗАДАНИЕ Составьте возможные уравнения электролитической диссоциации кислот в водных растворах. 1) HCl 2) HNO3 3) Н2SiO3
- 4. Проверим Возможные уравнения электролитической диссоциации кислот в водных растворах. 1) HCl H+ + Cl- 2) HNO3
- 5. ЗАДАНИЕ Составьте возможные уравнения электролитической диссоциации оснований в водных растворах. 1) NaOH 2) KOH 3) Fe(OH)2
- 6. Проверим Возможные уравнения электролитической диссоциации оснований в водных растворах. 1) NaOH Na+ + OH- 2) KOH
- 7. ЗАДАНИЕ Составьте возможные уравнения электролитической диссоциации солей в водных растворах. 1) NaCl 2) KNO3 3) BaSO4
- 8. Проверим Возможные уравнения электролитической диссоциации солей в водных растворах. 1) NaCl Na+ + Cl- 2) KNO3
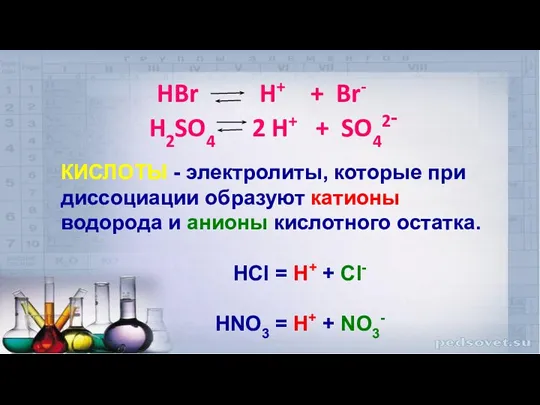
- 9. HBr H+ + Br- H2SO4 2 H+ + SO42- КИСЛОТЫ - электролиты, которые при диссоциации образуют
- 10. Лабораторный опыт № 1 «Выявление катионов водорода» В пробирки налейте 1—2 мл раствора соляной кислоты В
- 11. Общие характерные свойства кислот обусловлены присутствием катионов водорода Н+ Кислоты окрашивают все индикаторы в красный цвет
- 12. Многоосновные кислоты диссоциируют ступенчато H3PO4 (фосфорная кислота) 1) Образование дигидрофосфат-ионов H3PO4 ↔ H+ + H2PO4- 2)
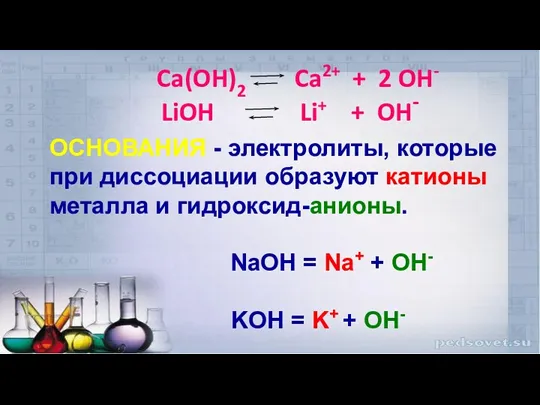
- 13. Ca(OH)2 Ca2+ + 2 OH- LiOH Li+ + OH- ОСНОВАНИЯ - электролиты, которые при диссоциации образуют
- 14. Лабораторный опыт № 2 «Выявление гидроксид анионов» В пробирки налейте 1—2 мл растворов гидроксида натрия, В
- 16. Общие свойства оснований обусловлены присутствием гидроксид-ионов ОН- Основания (щёлочи) окрашивают бесцветный фенолфталеин в малиновый цвет, а
- 17. Многокислотные основания диссоциируют ступенчато Ba(OH)2 (гидроксид бария) 1) Образование гидроксо-ионов бария Ba(OH)2 ↔ OH- + BaOH+
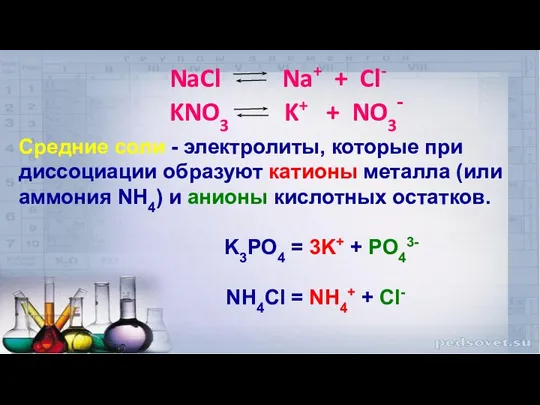
- 18. NaCl Na+ + Cl- KNO3 K+ + NO3- Средние соли - электролиты, которые при диссоциации образуют
- 19. Лабораторный опыт № 3 «Выявление общих свойств у солей» В пробирки налейте по 1—2 мл растворов
- 21. Кислые соли – электролиты, диссоциирующие на катион металла и сложный анион, в состав которого входят атомы
- 22. Основные соли – электролиты, которые при диссоциации образуют анионы кислотного остатка и сложные катионы, состоящие из
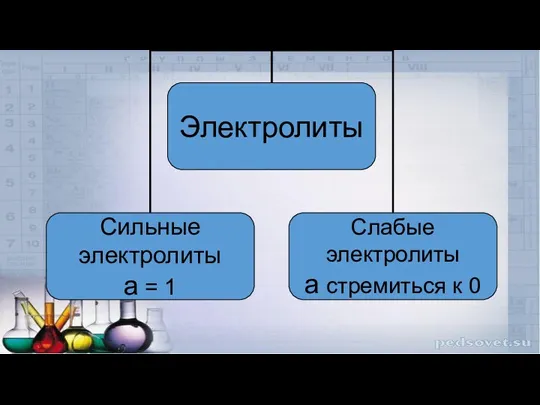
- 23. Количественная характеристика электролитической диссоциации Степень электролитической диссоциации – отношение числа частиц, распавшихся на ионы, к общему
- 24. слабые > 30 % сильные 2 − 30 % средней силы Степень электролитической диссоциации зависит от
- 26. Сильные электролиты: 1) все растворимые соли; 2) сильные кислоты (H2SO4, HCl, HNO3); 3) все щелочи (NaOH,
- 27. Электролиты средней силы: 1) кислоты (H3РO4, HNO2);
- 28. Слабые электролиты: слабые кислоты (H2S, H2CO3, H2SO3); водный раствор аммиака NH3* H2O; 3) вода
- 29. Электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка. Электролиты, которые при диссоциации образуют
- 30. Домашнее задание: Параграф 3 и 4 записать и выучить № 4-7 стр. 16, 4,5 и задачи
- 32. Скачать презентацию

























 Техники ювелирного дела. Введение в предмет. Общие сведения
Техники ювелирного дела. Введение в предмет. Общие сведения Современные проблемы молекулярной биологии
Современные проблемы молекулярной биологии Цикл трикарбоновых кислот (Ц.Кребса). Подсчёт суммарного энергетического эффекта аэробного окисления глюкозы
Цикл трикарбоновых кислот (Ц.Кребса). Подсчёт суммарного энергетического эффекта аэробного окисления глюкозы Речовини. Молекули. Атоми
Речовини. Молекули. Атоми Процесс в химическом реакторе
Процесс в химическом реакторе 20231104_prezentatsiya_teoriya_elektroliticheskoy_dissotsiatsii
20231104_prezentatsiya_teoriya_elektroliticheskoy_dissotsiatsii Каталитический риформинг
Каталитический риформинг Купрум. Знаходження в періодичній системі
Купрум. Знаходження в періодичній системі Непредельные углеводороды. Алкены
Непредельные углеводороды. Алкены Массовая доля вещества в растворе
Массовая доля вещества в растворе Анионы. Группы анионов
Анионы. Группы анионов Углерод и его свойства. 9 класс
Углерод и его свойства. 9 класс Физико-химия полимеров и их растворов
Физико-химия полимеров и их растворов Химический состав клетки
Химический состав клетки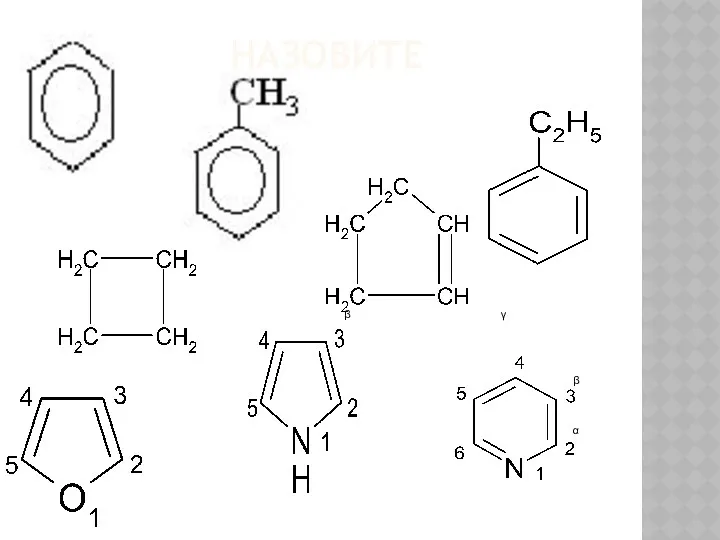 Общие сведения о гетероциклах
Общие сведения о гетероциклах Побочная подгруппа. 8 группы
Побочная подгруппа. 8 группы Проект узла регенерации растворителя уксусной кислоты производства терефталевой кислоты
Проект узла регенерации растворителя уксусной кислоты производства терефталевой кислоты Лекция 5. Нуклеофильное замещение при насыщенном атоме углерода
Лекция 5. Нуклеофильное замещение при насыщенном атоме углерода Пниктогены - элеметны VA группы
Пниктогены - элеметны VA группы Неметаллы: общая характеристика. 9 класс
Неметаллы: общая характеристика. 9 класс Полиэтилен
Полиэтилен Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Кислоты. Состав кислот
Кислоты. Состав кислот Спектрофометрия
Спектрофометрия Углерод и его свойства
Углерод и его свойства d997-13229e5e
d997-13229e5e Теория электролитической диссоциации
Теория электролитической диссоциации Реакции ионного обмена
Реакции ионного обмена