Содержание
- 2. Цель : сформировать представления о свойствах углерода, уметь составлять схемы строения атома, аллотропии и его биологической
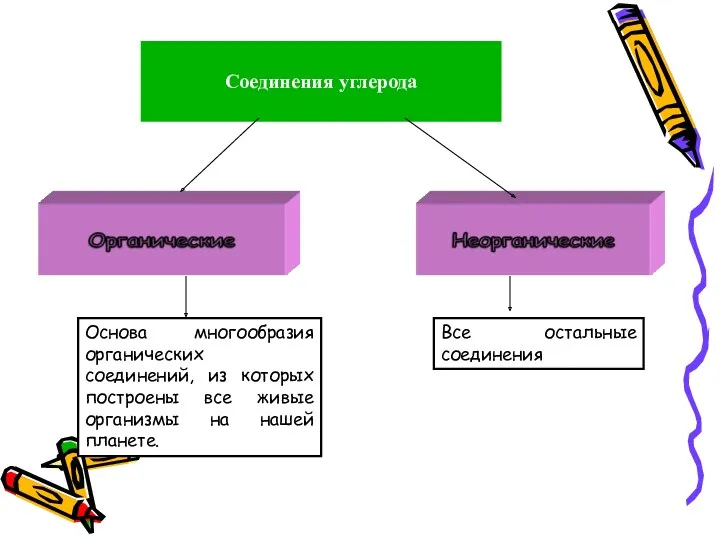
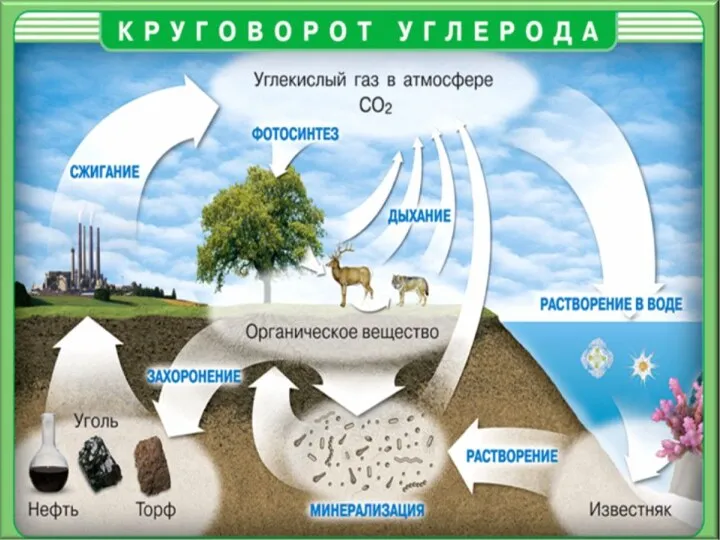
- 3. Соединения углерода Основа многообразия органических соединений, из которых построены все живые организмы на нашей планете. Все
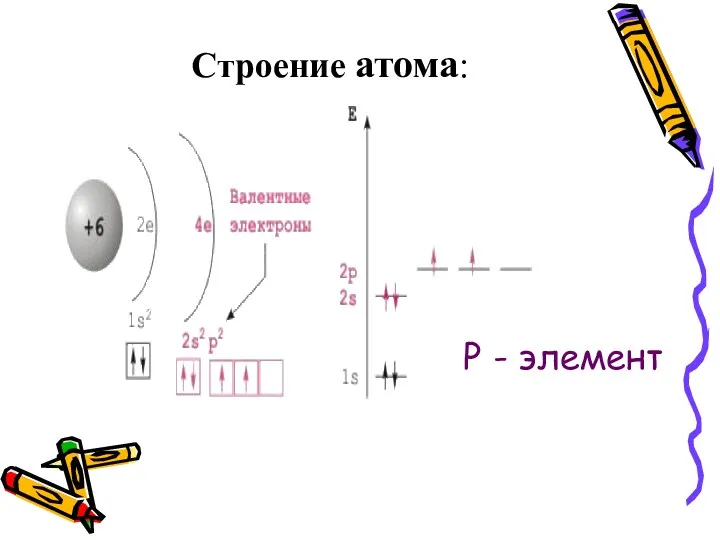
- 4. Строение атома Углерод (Carboneum-рождающий уголь) Химический элемент IV группы периодической системы Менделеева-неметалл Атомный номер 6 На
- 5. Строение атома: Р - элемент
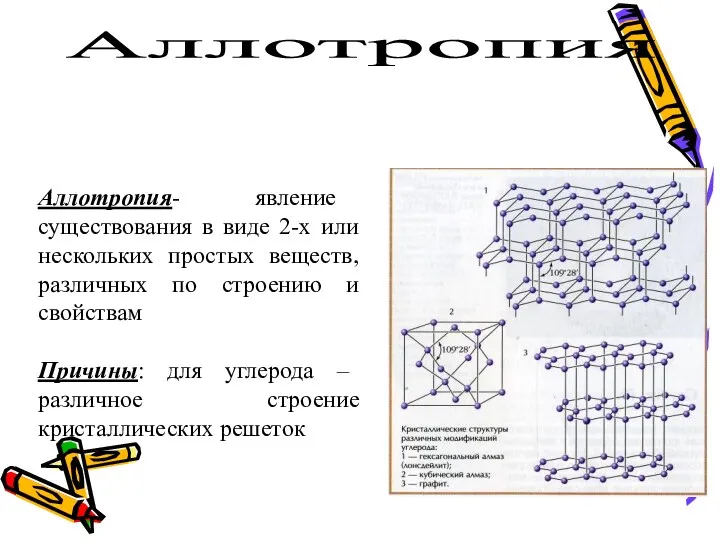
- 6. АЛЛОТРОПИЯ - способность атомов одного химического элемента образовывать несколько простых веществ. ?
- 7. Аллотропия Аллотропия- явление существования в виде 2-х или нескольких простых веществ, различных по строению и свойствам
- 8. Аллотропные модификации Алмаз – бесцветное, прозрачное, сильно преломляющее свет вещество. Алмаз тверже всех найденных в природе
- 9. Аллотропные модификации Графит – устойчивая при нормальных условиях аллотропная модификация углерода, имеет серо-черный цвет и металлический
- 10. Аморфный углерод Активированный уголь - пористое вещество, которое получают из различных углеродсодержащих материалов органического происхождения: древесный
- 11. - свойство углерода удерживать на пористой поверхности растворенные вещества и газы. Применяют для очистки, разделения и
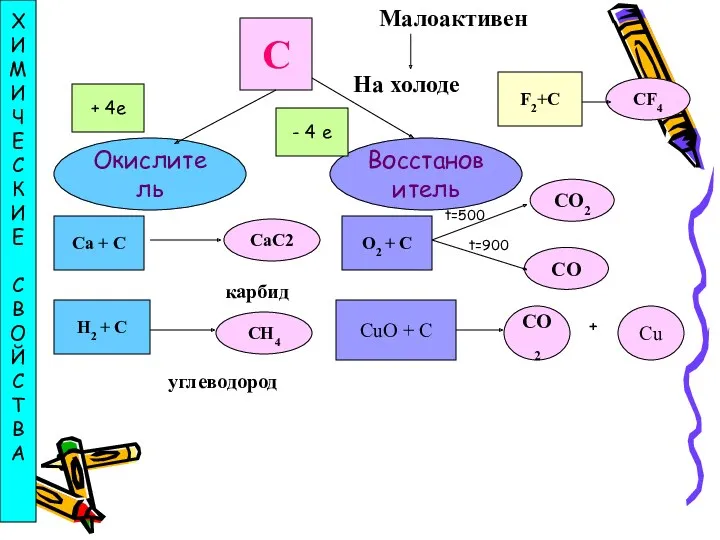
- 12. Химические свойства углерода При нагревании углерод соединяется с кислородом, образуя оксид углерода (IV), или углекислый газ:
- 13. Углерод — сильный восстановитель. При нагревании с водяным паром он вытесняет из воды водород: Н2O +
- 14. С Малоактивен На холоде Окислитель Восстановитель Х И М И Ч Е С К И Е
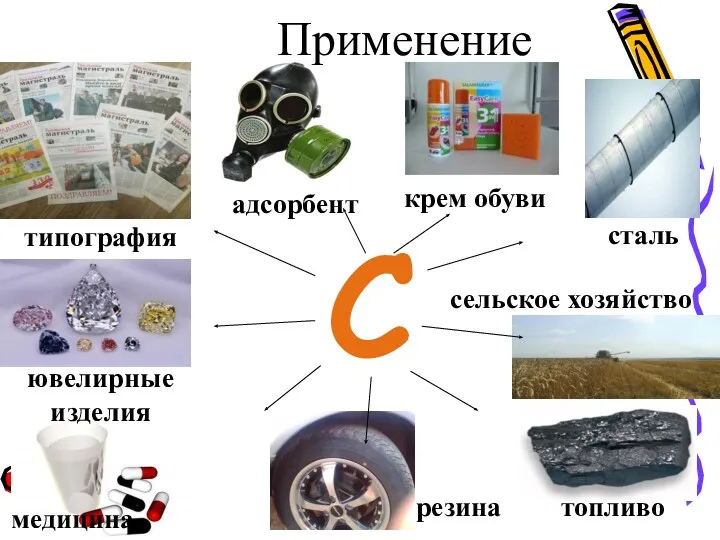
- 15. С сталь сельское хозяйство топливо медицина типография ювелирные изделия адсорбент резина крем обуви Применение
- 17. Какое значение имеют для тебя знания и умения, полученные на уроке? Не очень важны Важные Очень
- 18. Как ты оцениваешь полученные сегодня знания? Не осознанные Осознанные Глубокие
- 20. Скачать презентацию











 Основания. 8 класс
Основания. 8 класс Контрольная работа по дисциплине Физическая химия. Раздел: Электрохимия
Контрольная работа по дисциплине Физическая химия. Раздел: Электрохимия Поняття про побутові хімікати
Поняття про побутові хімікати Цинковое покрытие
Цинковое покрытие Кремний и его соединения. Аллотропные модификации
Кремний и его соединения. Аллотропные модификации Р-элементы VI A группы. Свойства их соединений
Р-элементы VI A группы. Свойства их соединений Группы сходных химических элементов
Группы сходных химических элементов Кислород
Кислород Кислород. Строение молекулы кислорода. Получение кислорода. Взаимодействие с кислородом простых и сложных веществ
Кислород. Строение молекулы кислорода. Получение кислорода. Взаимодействие с кислородом простых и сложных веществ Свойства фосфора
Свойства фосфора Бытовая химическая грамотность
Бытовая химическая грамотность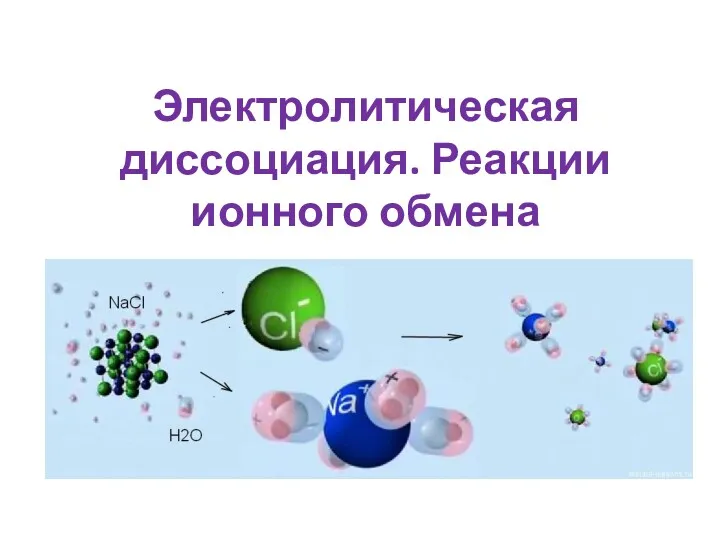 Электролитическая диссоциация. Реакции ионного обмена
Электролитическая диссоциация. Реакции ионного обмена Алмазы. Бриллианты
Алмазы. Бриллианты Пластмаси. Класифікація пластмас
Пластмаси. Класифікація пластмас Арены. Бензол
Арены. Бензол Камни и Скорпион
Камни и Скорпион Наноматериалы. Свойства наноматериалов. Особенности свойств
Наноматериалы. Свойства наноматериалов. Особенности свойств Силикаты. Гранат. Берилл
Силикаты. Гранат. Берилл Reactors for catalytic alkylation
Reactors for catalytic alkylation Электрохимия. Электропроводность растворов. Электродные потенциалы. Гальванические элементы
Электрохимия. Электропроводность растворов. Электродные потенциалы. Гальванические элементы Домашнее задание по теме Химические свойства альдегидов, их получение
Домашнее задание по теме Химические свойства альдегидов, их получение Кинетика процессов твердофазного взаимодействия
Кинетика процессов твердофазного взаимодействия Тяжёлая вода
Тяжёлая вода Fiber-Sludge-Sulfur-Beton (FiSHSB)
Fiber-Sludge-Sulfur-Beton (FiSHSB) Двовимірний ямр. Приклади
Двовимірний ямр. Приклади Чистые вещества и смеси
Чистые вещества и смеси Понятие о спиртах. 9 класс
Понятие о спиртах. 9 класс Методы титрования. Перманганатометрия. (Лекция 24)
Методы титрования. Перманганатометрия. (Лекция 24)