Содержание
- 2. Определение оснований Ме(ОН)n КОН Ca(ОН)2 Al(ОН)3 Ba(ОН)2 KOH → K1+ + OH- Ba(ОН)2 → Ba2+ +
- 3. Классификация оснований Число гидроксильных групп Однокислотные Многокислотные КОН NaOH LiOH Ba(ОН)2 Fe(OH)3 Cu(OH)2 Заряд гидроксильной группы
- 4. Растворимость Растворимые в воде Нерастворимые в воде Щелочи Металлы I А и II А групп (искл.
- 5. Сильные и слабые основания
- 6. Получение оснований Щелочи 2Na + 2H2O → 2NaOH + H2 K2O + H2O → 2KOH Активный
- 7. Нерастворимые в воде основания Реакция обмена = соль + щелочь CuSO4 +2NaOH → Na2SO4 + Cu(OH)2↓
- 8. Химические свойства оснований Щелочи изменяют окраску индикаторов Лакмус Метиловый оранжевый Фенолфталеиновый Синий Желтый Малиновый
- 9. Фенолфталеиновый в щелочах малиновый Индикатор фиксирует наличие ионов ОН- в растворе щелочи рН рН = 7
- 12. Индикатор Изменение рН среды
- 14. Щелочи реагируют с кислотными оксидами
- 15. 6NaOH + P2O5 → 2Na3PO4 + 3H2O Н3 PO4 Н2 CO3 Щелочь Кислотный оксид + Вода
- 16. Нерастворимые основания при нагревании разлагаются 2Fe(OH)3 → Fe2O3 + 3H2O Гидроксид Оксид металла Вода +
- 18. Скачать презентацию
 Полимеры. Пластмассы. Волокна
Полимеры. Пластмассы. Волокна Лекция 7. Электрофильное замещение в ароматических системах
Лекция 7. Электрофильное замещение в ароматических системах Драгоценные камни
Драгоценные камни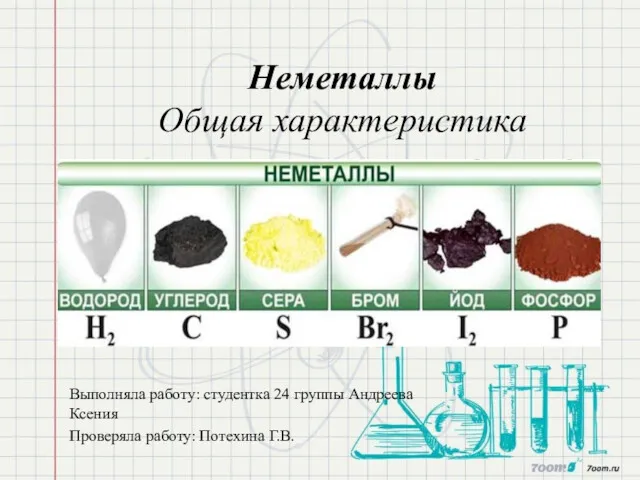 Неметаллы. Общая характеристика
Неметаллы. Общая характеристика ФОСФОР и его соединения
ФОСФОР и его соединения Химические свойства основных неорганических соединений в свете ЭД и ОВР. 9 класс
Химические свойства основных неорганических соединений в свете ЭД и ОВР. 9 класс Carbohydrates and their metabolism. Digestion of carbohydrates
Carbohydrates and their metabolism. Digestion of carbohydrates Лихеоиндикация. Экологические аспекты переработки полимеров
Лихеоиндикация. Экологические аспекты переработки полимеров Строение, кристаллизация и превращения в металлических материалах
Строение, кристаллизация и превращения в металлических материалах Химия в косметологии
Химия в косметологии Нефть и газ
Нефть и газ Оксид серы (IV). Сернистая кислота
Оксид серы (IV). Сернистая кислота Химический элемент кремний
Химический элемент кремний 20190407_stroenie_molekuly_metana
20190407_stroenie_molekuly_metana Цинковое покрытие
Цинковое покрытие Теории химической кинетики Лекция 5
Теории химической кинетики Лекция 5 Кислородсодержащие органические соединения. Спирты
Кислородсодержащие органические соединения. Спирты Бинарные соединения
Бинарные соединения Иондар және олардың түзілуі
Иондар және олардың түзілуі Пластификаторы и пластификация полимеров
Пластификаторы и пластификация полимеров Химический состав клетки
Химический состав клетки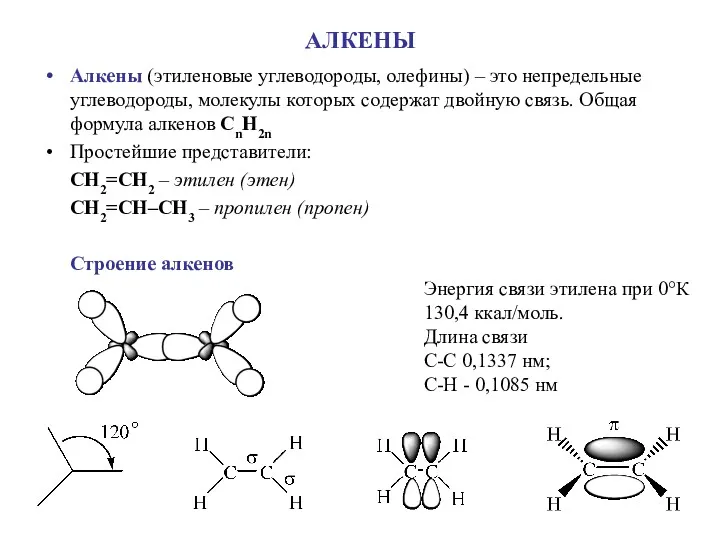 Алкены (этиленовые углеводороды, олефины)
Алкены (этиленовые углеводороды, олефины) Властивості вуглеводів. Лабораторна робота 3
Властивості вуглеводів. Лабораторна робота 3 Химический элемент. Неон
Химический элемент. Неон Хімія металургійних процесів. Теорія сплавів
Хімія металургійних процесів. Теорія сплавів Бром
Бром Železo. Železo je polymorfní kov, který se vyskytuje ve více modifikacích
Železo. Železo je polymorfní kov, který se vyskytuje ve více modifikacích Бензин: догадкии реальность
Бензин: догадкии реальность