Содержание
- 2. Цель урока: Повторить и закрепить знания учащихся о свойствах кислотных оксидов и кислот. Рассмотреть свойства соединения
- 3. Получение оксидов 1. Горение веществ (Окисление кислородом) а) простых веществ Mg +O2=2MgO S+O2=SO2 б) сложных веществ
- 4. 1)Сероводород горит на воздухе голубым пламенем при этом образуется сернистый газ или оксид серы(IV) 2H2S-2 +
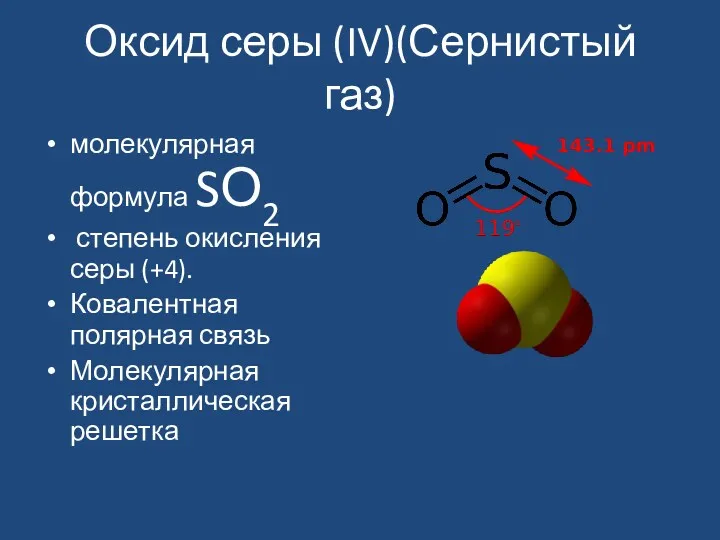
- 5. Оксид серы (IV)(Сернистый газ) молекулярная формула SО2 степень окисления серы (+4). Ковалентная полярная связь Молекулярная кристаллическая
- 6. Электронный баланс 1)S-2 -6е→ S+4 Восстановитель O2+4е → 2O -2 Окислитель 2) S0 -4е→ S+4 Восстановитель
- 7. Определение плотности по воздуху. Д воздух -? М(Воздух)= 29 г/моль М(H2S)=64г/моль Д воздух = 64:29=2,21 Д
- 8. Получение сернистого газа в промышленности. сжигание серы или обжиг сульфидов, в основном — пирита: 4FeS2+ 11O2
- 9. Получение оксида серы (IV) в лабораторных условиях воздействием сильных кислот на сульфиты и гидросульфиты. Образующаяся сернистая
- 10. Физические свойства. Оксид серы (IV), или сернистый газ, при нормальных условиях представляет собой бесцветный газ с
- 11. Нахождение в природе
- 12. Химические свойства кислотных оксидов ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТНЫХ ОКСИДОВ 1. Кислотный оксид +Вода= Кислота (р. соединения) СO2
- 13. Химические свойства оксида серы (IV) 1. Кислотный оксид +Вода= Кислота SO2 + H2O = H2SO3 2.
- 14. Химические свойства кислот 1. Изменяют окраску индикатора. 2.Реагируют с металлами в ряду активности до H2 (искл.
- 15. Уравнение диссоциации сернистой кислоты. H2SО3 → H+ + HSО3 - HSО3 - ↔ H+ + SО3
- 16. Качественная реакция на сульфиты. Взаимодействие соли с сильной кислотой, при этом выделяется газ с резким запахом
- 17. Окислительные свойства оксида серы (IV). 2H2S-2 + S +4O2 → 2H2O + 3S 0 S+4 +4е→
- 18. Восстановительные свойства оксида серы (IV) 2SO2+ O2 = 2SO2 SO2 + Br2 + 2H2O = H2
- 19. Применение оксида серы (IV). Большая часть оксида серы (IV) используется для производства серной кислоты. Используется также
- 20. Физиологическое действие на организм. SO2 очень токсичен. Симптомы при отравлении сернистым газом — насморк, кашель, охриплость,
- 21. Воздействие на атмосферу. Из-за образования в больших количествах в качестве отходов диоксид серы является одним из
- 23. Скачать презентацию



















 Характеристика химического элемента по его положению в ПСХЭ Д.И. Менделеева
Характеристика химического элемента по его положению в ПСХЭ Д.И. Менделеева История органической химии. Характерные особенности органических соединений
История органической химии. Характерные особенности органических соединений Сероводород, сернистый водород
Сероводород, сернистый водород Взрывчатые вещества. Пероксид ацетона и пикриновая кислота
Взрывчатые вещества. Пероксид ацетона и пикриновая кислота Массовая доля вещества в растворе
Массовая доля вещества в растворе Водород и щелочные металлы
Водород и щелочные металлы Диеновые углеводороды
Диеновые углеводороды Соединения химических элементов. Валентность и степень окисления элементов
Соединения химических элементов. Валентность и степень окисления элементов Закон сохранения массы веществ
Закон сохранения массы веществ Химия и косметика
Химия и косметика Лекция 5. Нуклеофильное замещение при насыщенном атоме углерода
Лекция 5. Нуклеофильное замещение при насыщенном атоме углерода Химические свойства легкоплавких металлов
Химические свойства легкоплавких металлов Углерод, как химический элемент и простое вещество
Углерод, как химический элемент и простое вещество Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Графит
Графит Природный газ
Природный газ Бром
Бром Узагальнення й систематизація знань з теми Початкові хімічні поняття (1 частина)
Узагальнення й систематизація знань з теми Початкові хімічні поняття (1 частина) Основания. Состав, классификация, свойства, получение
Основания. Состав, классификация, свойства, получение Химиялық ыдыстарды тазалау
Химиялық ыдыстарды тазалау Подготовка к ВПР по химии. 8 класс
Подготовка к ВПР по химии. 8 класс Неметаллы: общая характеристика. 9 класс
Неметаллы: общая характеристика. 9 класс Особенности применения проблемных моделей обучения на уроках химии
Особенности применения проблемных моделей обучения на уроках химии Хімічний склад жувальної гумки
Хімічний склад жувальної гумки Задачи на массовую долю растворённого вещества в растворе
Задачи на массовую долю растворённого вещества в растворе Ароматические углеводороды (Арены)
Ароматические углеводороды (Арены) Пластмаси. Властивості пластмас. Склад пластичних мас. Види пластмаси
Пластмаси. Властивості пластмас. Склад пластичних мас. Види пластмаси Валентные возможности атомов химических элементов
Валентные возможности атомов химических элементов