Содержание
- 2. Що таке тіло? Фізичне тіло – будь який предмет, який має розмір і форму. 2.Що таке
- 3. Із наведеного переліку визначити назви речовин і тіл: А. Скло. Б.Колба. В.Пробірка. Г.Цвях. Д.Стіл. Е.Алюміній.
- 4. Речовини: А. Скло Е. Алюміній Тіла: Б. Колба В. Пробірка Г. Цвях Д. Стіл Перевіряємо відповідь
- 5. Речовини бувають чистими, але найчастіше вони утворюють суміш. Чим вони відмінні?
- 6. Перевіряємо відповідь Чиста речовина — це речовина індивідуальна, яка не містить домішок інших речовин. Вона складається
- 7. Із наведеного переліку визначити назви чистих речовин і сумішей: А. Кисень. Б. Повітря. В. Молоко. Г.
- 8. Перевіряємо відповідь Чисті речовини Суміші А. Кисень. Г. Залізо. Б. Повітря. В. Молоко. Д. Грунт
- 9. З яких частинок складаються речовини? Речовини складаються з атомів, молекул, йонів.
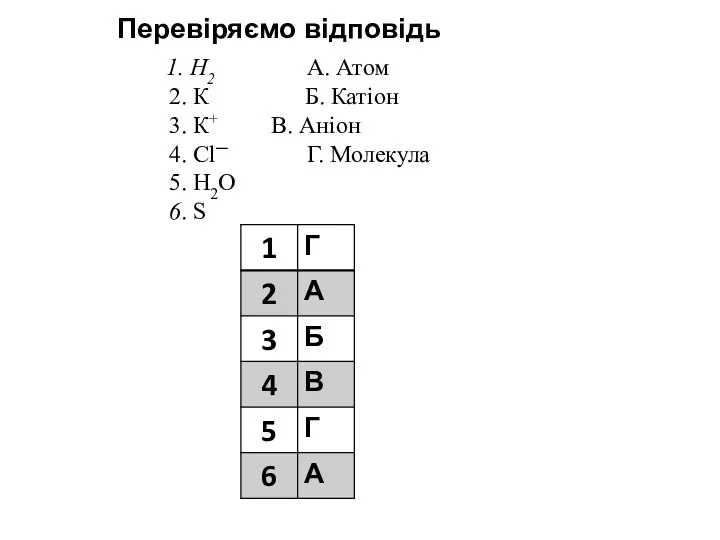
- 10. Встановіть відповідність між позначенням частинки та її назвою: 1. Н2 А. Атом 2. К Б. Катіон
- 11. 1. Н2 А. Атом 2. К Б. Катіон 3. К+ В. Аніон 4. Cl─ Г. Молекула
- 12. Для кожної матеріальної частинки можна визначити масу. В хімії замість абсолютних мас, виміряних в г чи
- 13. Запишіть відносні атомні маси таких елементів: Карбон, Фосфор, Ферум, Нітроген. Перевіряємо відповідь Ar (С) = 12
- 14. Задача У скільки разів атом Магнію важчий за атом Карбону?
- 15. Задача У скільки разів атом Магнію важчий за атом Карбону? Ar (Mg) = 24 Ar (С)
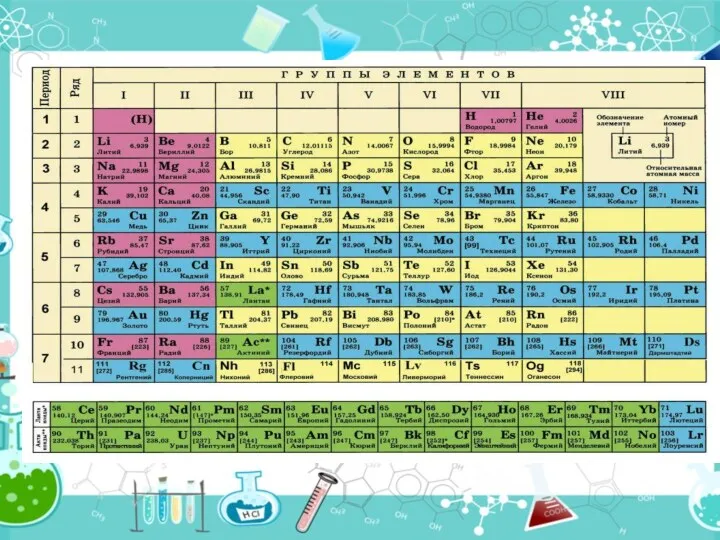
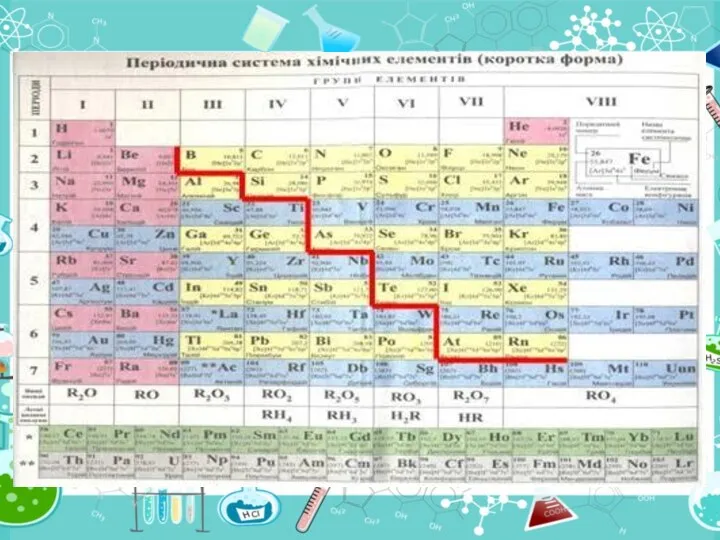
- 16. Періодична система – таблиця, якою користуються в будь-якій хімічній лабораторії. Пригадайте будову ПС. Періодична система складається
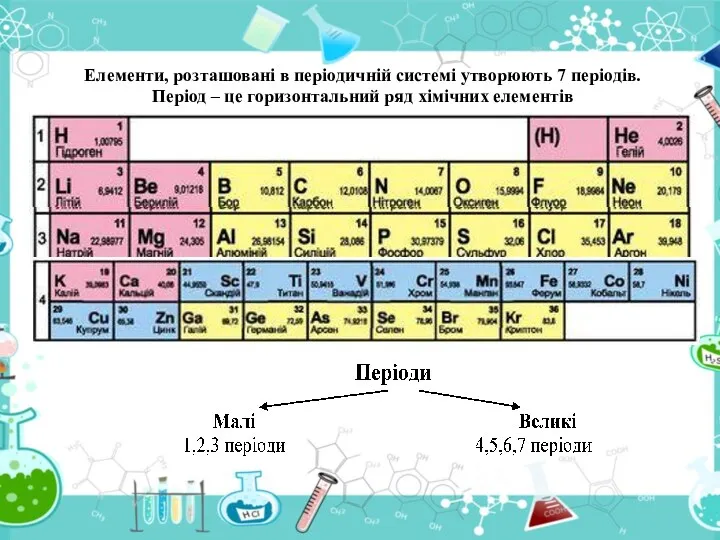
- 18. Елементи, розташовані в періодичній системі утворюють 7 періодів. Період – це горизонтальний ряд хімічних елементів
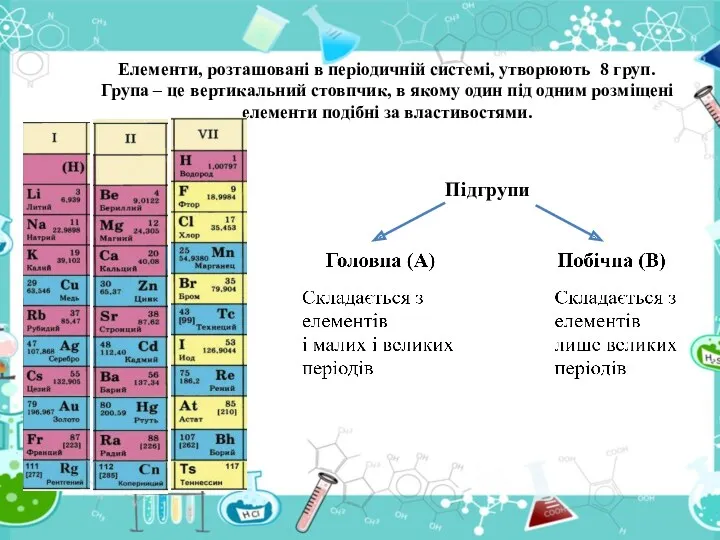
- 19. Елементи, розташовані в періодичній системі, утворюють 8 груп. Група – це вертикальний стовпчик, в якому один
- 20. Де в ПС знаходяться Mg, K, Mn? Перевіряємо відповідь Mg знаходиться в 3 періоді, ІІ групі,
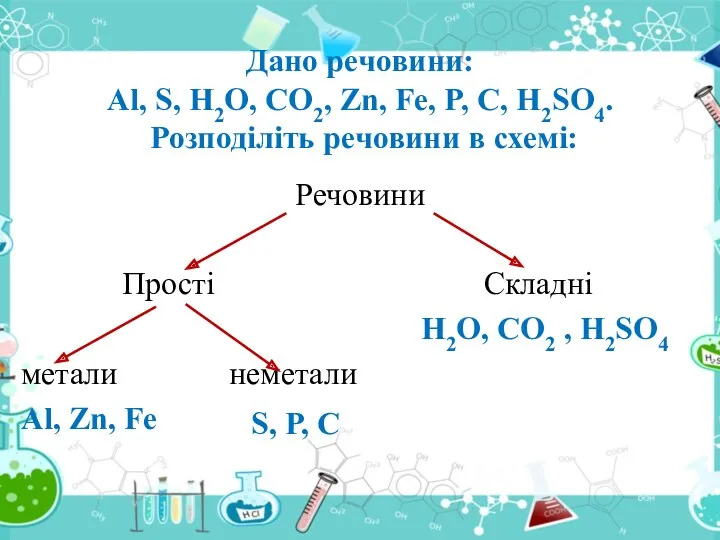
- 21. Атоми хімічних елементів сполучаються між собою, утворюючи сполуки. На які 2 групи можна поділити речовини за
- 22. Як поділяються прості речовини? Прості речовини поділяються на метали (K, Na, Fe, Cu) і неметали (S,
- 24. Речовини Прості Складні H2O, CO2 , H2SO4 метали неметали Al, Zn, Fe Дано речовини: Al, S,
- 25. Що таке формула? Хімічна формула — умовний запис, що відображає якісний і кількісний склад речовини. Якісний
- 26. Порівняти якісний і кількісний склад речовин, формула яких СO2 та СO СO2 та СO подібні якісним
- 27. Що означають записи: О - 2О - О2 - 2О2 - СО2 - 2СО2 - один
- 28. Встановити відповідність: 1. Один атом Гідрогену А. 2Н 2. Одна молекула водню Б. Н 3. Два
- 29. Перевіряємо відповідь 1. Один атом Гідрогену А. 2Н 2. Одна молекула водню Б. Н 3. Два
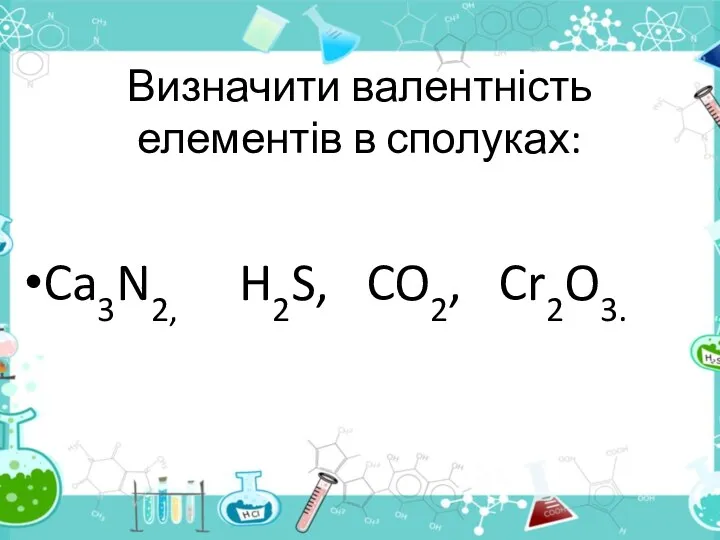
- 30. Що називається валентністю? Вале́нтність — це властивість атомів одного хімічного елемента з'єднуватися з певним числом атомів
- 31. Визначити валентність елементів в сполуках: Ca3N2, H2S, CO2, Cr2O3.
- 32. Перевіряємо відповідь ІІ І ІІ ІІ Ca3N2, H2S, CO2, Cr2O3 Записуємо відому валентність одного з елементів.
- 33. Скласти формули: II ІІ ІІІ V VІ Al S, Cu N, Cl O, S O
- 34. Перевіряємо відповідь II ІІ ІІІ V VІ Al S, Cu N, Cl O, S O Над
- 36. Скачать презентацию


























 Крахма́л (C6H10O5)n
Крахма́л (C6H10O5)n Закон сохранения массы. Химические уравнения
Закон сохранения массы. Химические уравнения Химические волокна
Химические волокна Классификация химических реакций
Классификация химических реакций Щелочные металлы
Щелочные металлы Промышленное производство аммиака
Промышленное производство аммиака Л3. Учение о растворах (Химия)
Л3. Учение о растворах (Химия) Биологически важные реакции карбонильных соединений. Масс-спектрометрия
Биологически важные реакции карбонильных соединений. Масс-спектрометрия Что такое химия. Техника безопасности. Интересные факты (урок 1)
Что такое химия. Техника безопасности. Интересные факты (урок 1) Создание косметических средств
Создание косметических средств Химия аминокислот, пептидов и белков
Химия аминокислот, пептидов и белков Натуральные, искуственные и синтетические материалы
Натуральные, искуственные и синтетические материалы АЛКАНЫ 9 класс
АЛКАНЫ 9 класс Оксиды. Классификация. Химические и физические свойства
Оксиды. Классификация. Химические и физические свойства Калийные Удобрения
Калийные Удобрения Актуальные вопросы содержания контрольных измерительных материалов ЕГЭ в 2019 г
Актуальные вопросы содержания контрольных измерительных материалов ЕГЭ в 2019 г Сплави алюмінію. Характеристики та застосування
Сплави алюмінію. Характеристики та застосування Structural, substructural properties and chemical composition
Structural, substructural properties and chemical composition Количество вещества. Моль
Количество вещества. Моль Общая характеристика углеводов: глюкоза
Общая характеристика углеводов: глюкоза Комплексные соединения и лигандообменные равновесия
Комплексные соединения и лигандообменные равновесия Галогены. Общая характеристика галогенов
Галогены. Общая характеристика галогенов Аммиак
Аммиак Технология переработки полимеров
Технология переработки полимеров Тепловой эффект химических реакций. Расчёты по термохимическим уравнениям (ТХУ)
Тепловой эффект химических реакций. Расчёты по термохимическим уравнениям (ТХУ) Алюминий и его соединения
Алюминий и его соединения Периодический закон Д.И. Менделеева. Периодическая система химических элементов
Периодический закон Д.И. Менделеева. Периодическая система химических элементов Непредельные углеводороды. Алкены
Непредельные углеводороды. Алкены