Слайд 2

Содержание
1.Определение
2.Номенклатура алкенов
3.Изомерия алкенов
4.Строение алкенов
5.Получение алкенов
6.Физические свойства
7.Химические свойства
8.Применение алкенов
Слайд 3

Определение
Алкены – непредельные углеводороды, в молекулах которых между атомами углерода
имеется одна двойная связь.
Общая формула: СnH2n , где n ≥2
Слайд 4
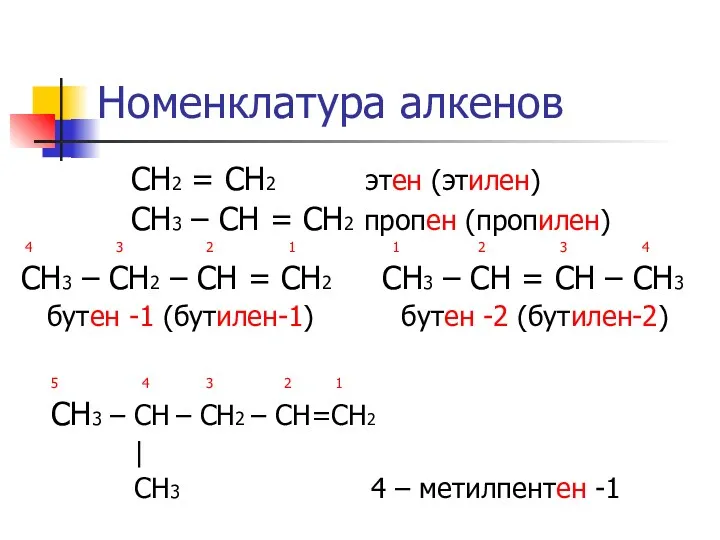
Номенклатура алкенов
СН2 = СН2 этен (этилен)
СН3 – СН =
СН2 пропен (пропилен)
4 3 2 1 1 2 3 4
СН3 – СН2 – СН = СН2 СН3 – СН = СН – СН3
бутен -1 (бутилен-1) бутен -2 (бутилен-2)
5 4 3 2 1
СН3 – СН – CH2 – CH=CH2
|
CH3 4 – метилпентен -1
Слайд 5
Слайд 6

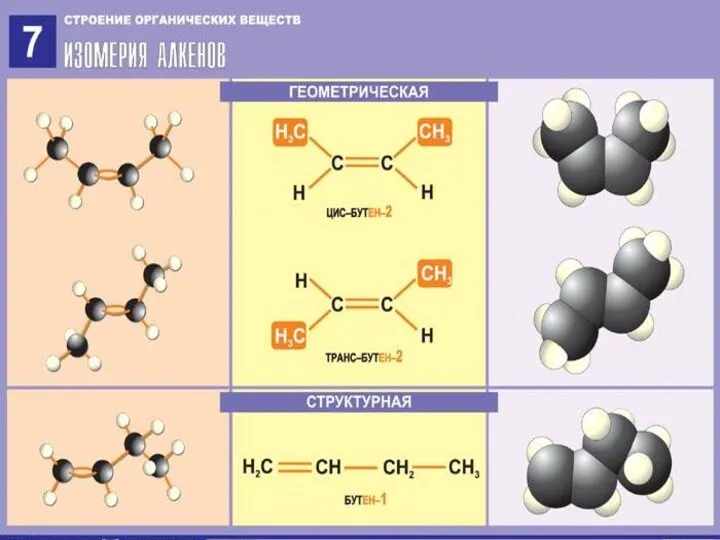
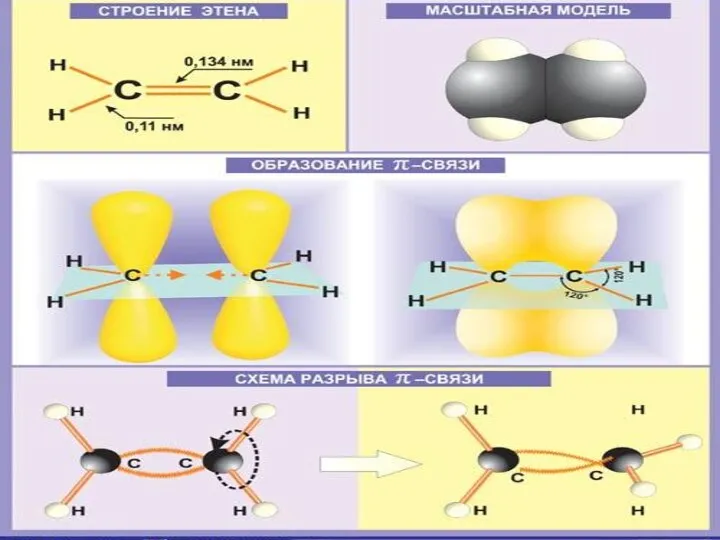
Строение алкенов
СН2 = СН2 этилен (этен)
Двойная связь: σ-связь+π-связь
Тип гибридизации: sp²
Валентный угол: 120°
Форма молекулы:
плоскостная (треугольная)
Слайд 7
Слайд 8
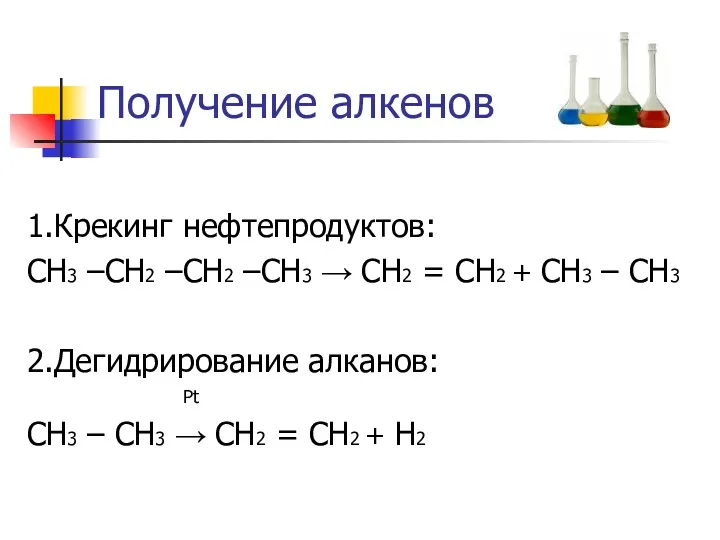
Получение алкенов
1.Крекинг нефтепродуктов:
СН3 –СН2 –СН2 –СН3 → СН2 = СН2 +
СН3 – СН3
2.Дегидрирование алканов:
Pt
СН3 – СН3 → СН2 = СН2 + Н2
Слайд 9
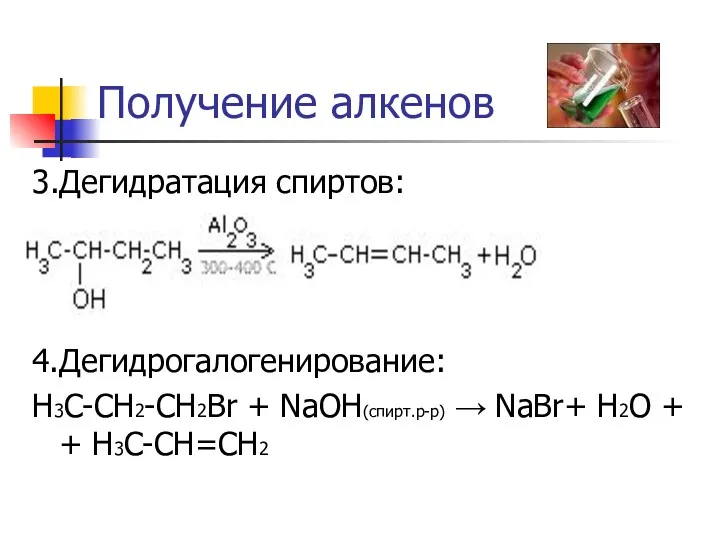
Получение алкенов
3.Дегидратация спиртов:
4.Дегидрогалогенирование:
H3C-CH2-CH2Br + NaOH(спирт.р-р) → NaBr+ H2O + + H3C-CH=CH2
Слайд 10
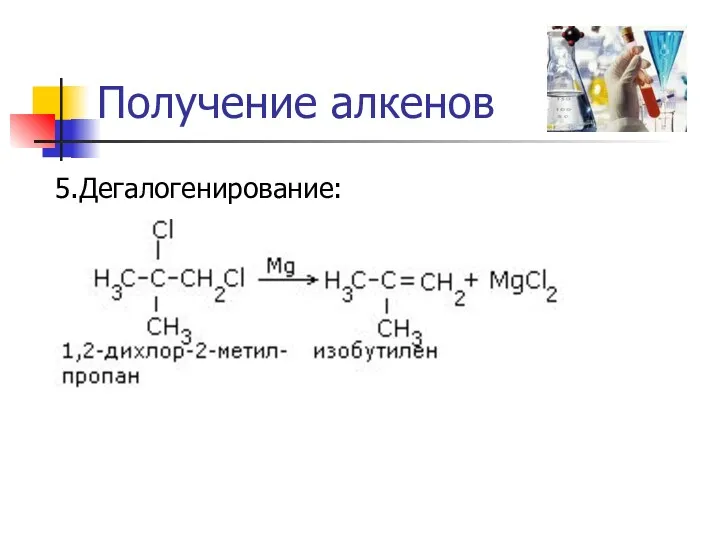
Получение алкенов
5.Дегалогенирование:
Слайд 11

Физические свойства
Этен,пропен, бутен – газы
С5Н10 – С16Н32 - жидкости
Высшие
алкены – тв.вещества
Слайд 12

Химические свойства
I.Реакции присоединения:
1.Гидрирование :
CH2=CH-CH3+Н2 → CH3-CH2-CH3
2.Галогенирование:
CH2=CH-CH3+Cl2 → CH2Cl-CHCl-CH3
3.Гидрогалогенирование:
CH2=CH-CH3+НCl
→ CH3-CHCl-CH3
Слайд 13
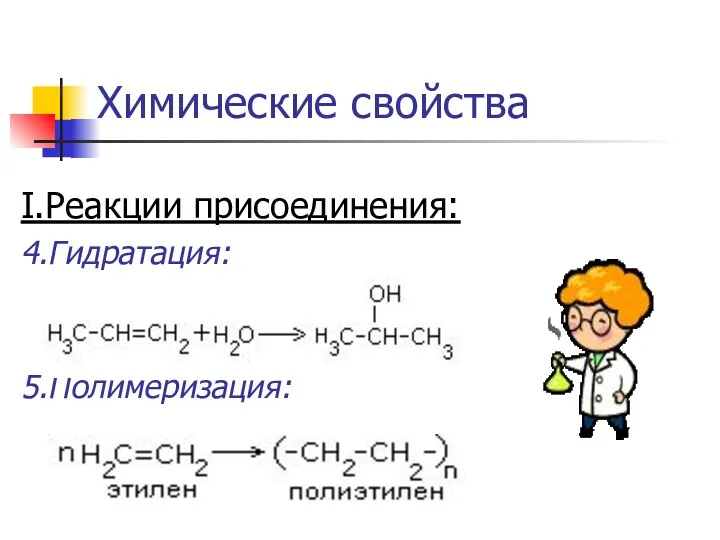
Химические свойства
I.Реакции присоединения:
4.Гидратация:
5.Полимеризация:
Слайд 14

Химические свойства
II.Реакции окисления:
1.Полное окисление (горение):
С2Н4 + 3О2 → 2СО2 +
2Н2О
2.Неполное окисление:
3С2Н4 + 2KMnO4 +4Н2О →3HOCH2-CH2OH +
+2MnO2 + 2KOH
Слайд 15















 The chemistri of life and the micro universe
The chemistri of life and the micro universe Подготовка проб к анализу в лаборатории. Продолжение. Лекция 5
Подготовка проб к анализу в лаборатории. Продолжение. Лекция 5 Вуглеводи
Вуглеводи Происхождение химических элементов
Происхождение химических элементов Карбоновые кислоты
Карбоновые кислоты Будова атома. Ядро й електронні оболонки. Склад атомних ядер
Будова атома. Ядро й електронні оболонки. Склад атомних ядер Изомерия. Виды изомерии
Изомерия. Виды изомерии Растворы. Лекция №5
Растворы. Лекция №5 Тема 2. Электронный энергетический спектр как фундаментальная характеристика твердого тела. Перестройка энергетического спектра
Тема 2. Электронный энергетический спектр как фундаментальная характеристика твердого тела. Перестройка энергетического спектра Химическое равновесие и условия его смещения
Химическое равновесие и условия его смещения Наноалотропи карбону: класифікація, одержання та застосування
Наноалотропи карбону: класифікація, одержання та застосування Многообразие карбоновых кислот
Многообразие карбоновых кислот Бескислородные керамические материалы
Бескислородные керамические материалы Цинк. Нахождение в природе
Цинк. Нахождение в природе Особенности строения, реакционной способности и методы синтеза азотсодержащих соединений
Особенности строения, реакционной способности и методы синтеза азотсодержащих соединений Кондуктометрия. Кондуктометрия әдісі. Электрохимиялық әдістер
Кондуктометрия. Кондуктометрия әдісі. Электрохимиялық әдістер Экспериментальные методы измерения изотерм адсорбции. Лекция 4
Экспериментальные методы измерения изотерм адсорбции. Лекция 4 Процессы и операции формообразования. Металлургия цветных металлов
Процессы и операции формообразования. Металлургия цветных металлов Чистые вещества и смеси
Чистые вещества и смеси Бензол и его гомологи
Бензол и его гомологи 20230205_okislitelno-vosstanovitelnye_reaktsii
20230205_okislitelno-vosstanovitelnye_reaktsii Ароматические углеводороды (арены)
Ароматические углеводороды (арены) Химические волокна
Химические волокна Удивительный мир камня
Удивительный мир камня Химические свойства соляной кислоты
Химические свойства соляной кислоты Основные разделы химии
Основные разделы химии Проект познавательно-исследовательской деятельности. Удивительная соль
Проект познавательно-исследовательской деятельности. Удивительная соль Калийные Удобрения
Калийные Удобрения