Содержание
- 2. Повторение основных вопросов курса 8 класса. Чистые вещества и смеси. Химический элемент и простое вещество. Физические
- 3. Чистые вещества и смеси Выпишите в два столбика названия чистых веществ и смесей: спиртовой раствор йода,
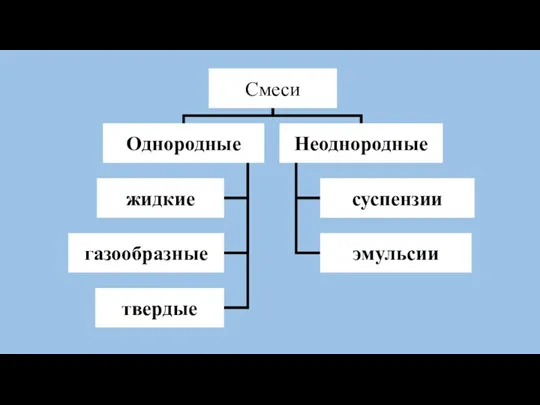
- 5. Методы разделения смесей Гомогенных Гетерогенных Выпаривание Фильтрование (кристаллизация) Дистилляция Отстаивание (перегонка) Хроматография Действие магнитом
- 6. Химический элемент и простое вещество В каком высказывании речь идёт о химическом элементе, а в каком
- 7. Классификация неорганических веществ простые сложные состоят из атомов одного химического элемента состоят из атомов нескольких химических
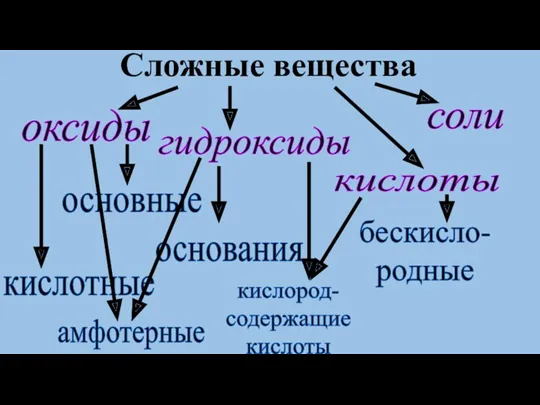
- 8. оксиды основные кислотные соли гидроксиды кислоты основания кислород- содержащие кислоты бескисло- родные Сложные вещества амфотерные
- 9. 1. Определите принадлежность веществ к определённым классам. Ответ объясните. CuO, H2SO4 , Fe(OH)2 , Al2O3, NaCl,
- 10. Химические свойства основных оксидов 1. + вода → растворимое основание 2. + кислотный оксид → соль
- 11. Химические свойства амфотерных оксидов 1. + вода → - 2. + кислотный оксид → соль 3.
- 12. Химические свойства оснований + кислота → соль + вода ( реакция нейтрализации ) щёлочь + кислотный
- 13. Химические свойства кислот + Ме (до Н) → соль + Н2↑ + основные оксиды→соль + вода
- 15. Скачать презентацию










 Кристаллическое строение и кристаллизация металлов
Кристаллическое строение и кристаллизация металлов Бережём планету вместе. Нефть
Бережём планету вместе. Нефть Органіка. Органічні речовини
Органіка. Органічні речовини Благородные газы
Благородные газы Растворы и свойства растворов. Лекция 3
Растворы и свойства растворов. Лекция 3 Типы химических реакций
Типы химических реакций Ионное произведение воды. Водородный показатель воды
Ионное произведение воды. Водородный показатель воды Новинки СН старт: июль 2016 Профессиональная химия PRO service
Новинки СН старт: июль 2016 Профессиональная химия PRO service Вклад М.В. Ломоносова в развитие науки химия
Вклад М.В. Ломоносова в развитие науки химия Сложные углеводы. Олигосахариды и полисахариды
Сложные углеводы. Олигосахариды и полисахариды Состояние атмосферного воздуха в Ярославской области
Состояние атмосферного воздуха в Ярославской области Драгоценные камни
Драгоценные камни Натрий алкилсульфонаттарын алу. №4 лекция
Натрий алкилсульфонаттарын алу. №4 лекция CaSO4 кристаллының ас жазықтығына проекциясының құрылымдық моделі
CaSO4 кристаллының ас жазықтығына проекциясының құрылымдық моделі Алкадиены. Циклоалканы. Лекция № 5
Алкадиены. Циклоалканы. Лекция № 5 Химический тренажер. Химические элементы
Химический тренажер. Химические элементы Осадительное титрование. (Лекция 27)
Осадительное титрование. (Лекция 27) Объёмная доля компонента смеси
Объёмная доля компонента смеси Роль воды в химических реакциях
Роль воды в химических реакциях Термокаталитические процессы. Каталитический крекинг. Классификация и основные факторы процесса
Термокаталитические процессы. Каталитический крекинг. Классификация и основные факторы процесса Предмет и задачи химии. Вещества и их свойства. (Продолжение)
Предмет и задачи химии. Вещества и их свойства. (Продолжение) Углеводы. (Лекция 7)
Углеводы. (Лекция 7) Показатели жесткости воды
Показатели жесткости воды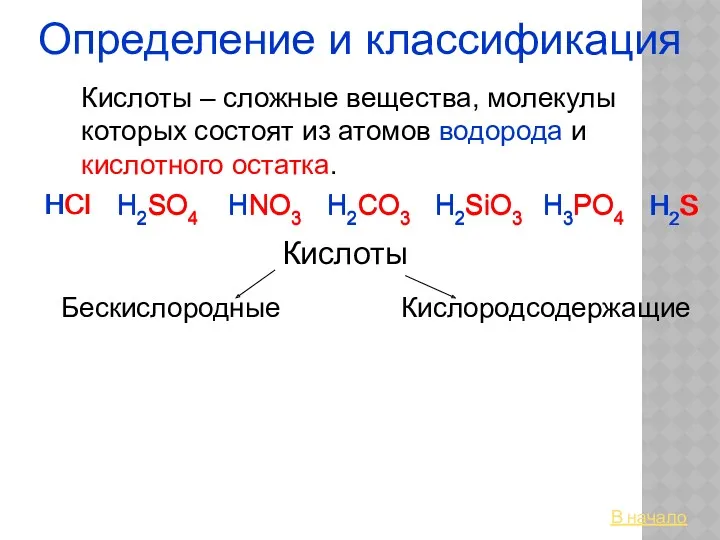 Кислоты. Определение и классификация
Кислоты. Определение и классификация Приёмы обращения с лабораторным оборудованием
Приёмы обращения с лабораторным оборудованием Нуклеиновые кислоты
Нуклеиновые кислоты Радиохимия
Радиохимия Элементы химической термодинамики. 1 и 2 законы термодинамики. Химическое равновесие
Элементы химической термодинамики. 1 и 2 законы термодинамики. Химическое равновесие