Слайд 2

Слайд 3

Критерии успеха
Учащийся достиг цели обучения, если:
- знает ионное произведение воды и
что оно равно Kw = [H+] [OH-]
- умеет вычислять рН сильного основания и концентрацию гидроксид ионов
- знает и объясняет вывод уравнения Ka и Kb на основании, что слабые кислоты и основания диссоциируют в водных растворах частично
- умеет вычислять рН слабых кислот и оснований используя Ka и Kb
- умеет использовать уравнение pKw = pKa + pKb
Слайд 4

Опрос
1. Что такое водородный показатель?
2. Как можно его вычислить?
3.
Чему равен рН сильной кислоты?
4. Как можно вычислить концентрацию ионов водорода по значению рН?
5. Вычислите рН 0,05М раствора азотной кислоты
6. Вычислите рН 2М раствора серной кислоты
7. Определите концентрацию раствора бромоводородной кислоты если рН раствора равен 3
8. Определите количество серной кислоты в 200 мл 0,1М его раствора
Слайд 5

Тема урока
1. Дистиллированная вода проводит электрический ток? Почему?
2. Чем является вода по
теории Брэнстеда-Лоури? Объясните свой ответ, приведите уравнение реакции.
3. Напишите уравнение диссоциации воды
4. Как вы думаете в какую сторону смещена равновесие диссоциации воды
5. Напишите выражение константы равновесия для воды.
6. Можем ли определить концентрацию молекул воды? Почему?
Слайд 6

Групповая работа
Практическое значение ионного произведения воды велико, так как оно позволяет
при известной кислотности (щёлочности) любого раствора (то есть при известной концентрации [H+] или [OH−]) найти соответственно концентрации [OH−] или [H+])
Kw = [H+]·[OH−]
10−14 = [H+]·[OH−]
14 = рН + рОН
Первичная проверка степени усвоение материала учениками.
Что называется ионным произведением воды?
Чему оно равно?
Как влияет температура на ионное произведение воды?
Слайд 7

Проверка усвоения темы
Первичная проверка степени усвоение материала учениками.
a) Напишите уравнение, показывающее
равновесие, которое происходит, когда пропановая кислота растворяется в воде.
b) Напишите выражение для Ka для пропановой кислоты.
c) Как определить pKa.
d) Значение Ka для этановой кислоты составляет 1,74 × 10-5 моль дм-3. Чему равна значение pKa (до 3 значащих цифр)?
e) Две кислоты имеют следующие значения для Ka:
кислота А: 6,32 × 10-5 моль дм-3
кислота В: 1,50 × 10-4 моль дм-3
Какая кислота является более сильной кислотой?
f) Две разные кислоты имеют следующие значения pKa:
кислота C: 3,24
кислота D: 5,66
Какая кислота является более сильной кислотой?
Слайд 8

Решение задач
Задача. Вычислить рН 0,1М раствора уксусной кислоты (CH3COOH), если константа
кислотности Ка(CH3COOH) =1.7 x 10-5 moldm-3
CH3COOH(aq) + H2O(l) == CH3COO- + H3O+(aq)
Ka = [H3O+][ CH3COO-]
[CH3COOH]
Так как [H3O+] = [CH3COO-]
[H3O+][CH3COO-] = [H3O+]2.
Концентрация диссоциированной кислоты достаточно мала по сравнению с первоначальной концентрацией слабой кислоты, поэтому, ей можно пренебречь:
[CH3COOH] = 0.1 moldm-3.
[H3O+]2 = Ka x 0.1,
тогда [H3O+] = √Ka x 0.1 = 1.304·10-3 moldm-3
pH = -lg1.304·10-3 = 2.9







 Fiber-Sludge-Sulfur-Beton (FiSHSB)
Fiber-Sludge-Sulfur-Beton (FiSHSB) Подготовка к ГИА. А9. Химические свойства простых веществ: металлов и неметаллов
Подготовка к ГИА. А9. Химические свойства простых веществ: металлов и неметаллов Ионные уравнения реакции
Ионные уравнения реакции Поддержание заданного качества свинцового теплоносителя для энергетических ядерных реакторов
Поддержание заданного качества свинцового теплоносителя для энергетических ядерных реакторов Химический состав земной коры
Химический состав земной коры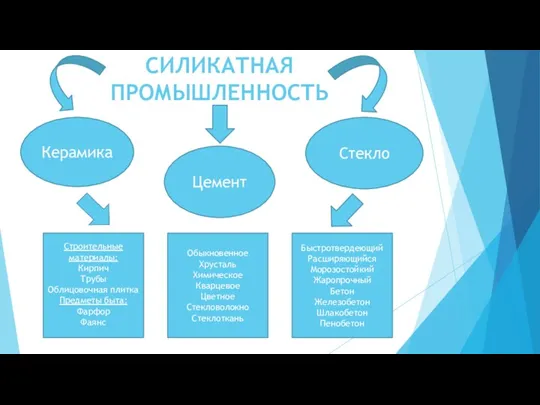 Силикатная промышленность
Силикатная промышленность Алкены. Этиленовые углеводороды, олефины
Алкены. Этиленовые углеводороды, олефины Расчеты по химическим уравнениям
Расчеты по химическим уравнениям Переработка тяжелых нефтей, битумов и нефтяных остатков
Переработка тяжелых нефтей, битумов и нефтяных остатков Лабораторная работа Исследование состава молока
Лабораторная работа Исследование состава молока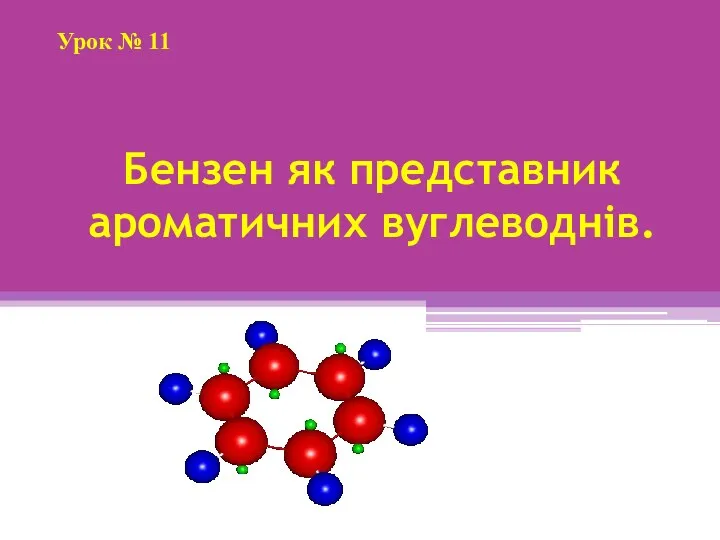 Бензен як представник ароматичних вуглеводнів
Бензен як представник ароматичних вуглеводнів Производство серной кислоты контактным способом
Производство серной кислоты контактным способом Азотовмісні сполуки
Азотовмісні сполуки Алкены (олефины). 10 профиль. Лекция №1
Алкены (олефины). 10 профиль. Лекция №1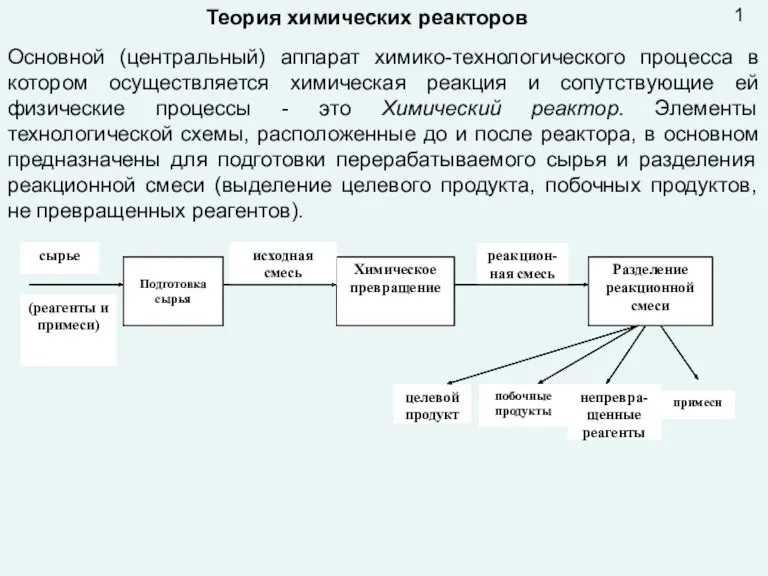 Презентация лекция 9 Реактора
Презентация лекция 9 Реактора Кислоты. Классификация кислот
Кислоты. Классификация кислот Титриметрические методы количественного определения лекарственных веществ
Титриметрические методы количественного определения лекарственных веществ Неметаллы. Особенности строения атомов неметаллов
Неметаллы. Особенности строения атомов неметаллов Сущность процесса электролиза
Сущность процесса электролиза Эквиваленты веществ. Жидкое состояние, растворы
Эквиваленты веществ. Жидкое состояние, растворы Каучук. Открытие каучука
Каучук. Открытие каучука Химическая технология ситаллов и композитов. Прессование
Химическая технология ситаллов и композитов. Прессование Молярный объем газов. 8 класс
Молярный объем газов. 8 класс Производство аммиака и азотной кислоты
Производство аммиака и азотной кислоты Вводные понятия к установке кристаллов
Вводные понятия к установке кристаллов Щелочноземельные металлы. Металлы II А подгруппы
Щелочноземельные металлы. Металлы II А подгруппы Каталитические процессы нефтепереработки
Каталитические процессы нефтепереработки Химические свойства. Оксиды, основания, кислоты и соли
Химические свойства. Оксиды, основания, кислоты и соли