VIII век – арабский алхимик Аджабир ибн Хайян
получил «кислые газы»
из «зеленого камня»
(железного купороса).
IX век – персидский алхимик Ар-Рази получал
прокаливанием смеси медного и железного купороса
XIII век – европейский алхимик Альберт Магнус усовершенствовал способ.
XV век – алхимики 300 лет получали серную кислоту из пирита FeS2
В середине XVIII столетия было обнаружено, что свинец не растворяется в серной кислоте, поэтому стеклянное оборудование заменили на металлическое
1740-46 г.г. – был построен первый сернокислотный завод в Англии с использованием свинцовых камер.
1926 г. – в СССР построена первая башенная установка на Полевском металлургическом заводе (Урал) - малоэффективна.
1903 г. – запуск первой в России контактной установки на Тентелеевском химическом заводе (Петербург), к 1913 г. работало 6 систем (производство до 5 тыс.т.). Далее контактная система получила распространение во всём мире (Германия, Англия, США…)
История развития производства





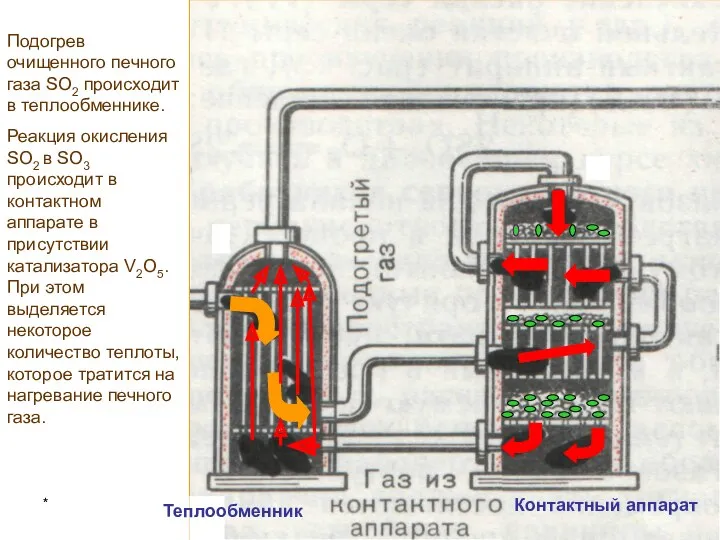

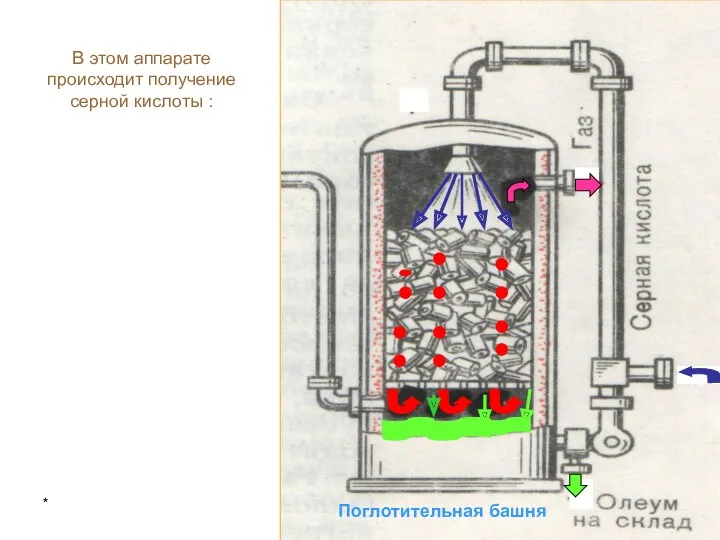

 Закон сохранения массы веществ
Закон сохранения массы веществ Свойства неорганических веществ. (Задание 37. ЕГЭ по химии)
Свойства неорганических веществ. (Задание 37. ЕГЭ по химии) Диаграммы фазового равновесия. Правило фаз
Диаграммы фазового равновесия. Правило фаз Материаловедение. Силикатные материалы
Материаловедение. Силикатные материалы Карбонильные соединения
Карбонильные соединения Штучні та природні речовини
Штучні та природні речовини Нуклейн қышқылдары
Нуклейн қышқылдары Соли (12 класс)
Соли (12 класс) Лекция 6. Алициклические углеводороды (циклоалканы, нафтены)
Лекция 6. Алициклические углеводороды (циклоалканы, нафтены) Аммиак
Аммиак Кристаллическое состояние вещества
Кристаллическое состояние вещества Как заменить всю химическую косметику натуральной
Как заменить всю химическую косметику натуральной Атомно-молекулярное учение. (Лекция 1)
Атомно-молекулярное учение. (Лекция 1) Минералды тыңайтқыштар өндірісі
Минералды тыңайтқыштар өндірісі Адсорбция на границе твердое тело - раствор
Адсорбция на границе твердое тело - раствор Наноматериалы. Свойства наноматериалов. Особенности свойств
Наноматериалы. Свойства наноматериалов. Особенности свойств Соединения химических элементов
Соединения химических элементов Класифікація неорганічних сполук, їхній склад і номенклатура
Класифікація неорганічних сполук, їхній склад і номенклатура Химическая кинетика
Химическая кинетика Классификация неорганических веществ
Классификация неорганических веществ Насичені одноатомні спирти, їх фізичні та хімічні властивості. Одержання етанолу
Насичені одноатомні спирти, їх фізичні та хімічні властивості. Одержання етанолу Введение. Методы и средства обучения химии
Введение. Методы и средства обучения химии Неметаллы. Обобщающий урок. 9 класс
Неметаллы. Обобщающий урок. 9 класс Химические уравнения
Химические уравнения Поляризация электродов
Поляризация электродов Хлороводород..Соляная кислота
Хлороводород..Соляная кислота Валентность химических элементов. 8 класс
Валентность химических элементов. 8 класс Массасы 4,2 г көміртек (IV) оксиді сумен әрекеттескенде қанша грамм көмір қышқылы (Н2СО3) түзілетінін есепте
Массасы 4,2 г көміртек (IV) оксиді сумен әрекеттескенде қанша грамм көмір қышқылы (Н2СО3) түзілетінін есепте