Слайд 2

План
Классификация неорганических веществ.
Металлы и неметаллы.
Оксиды. Их классификация.
Основания и их классификация.
Кислоты и
их классификация.
Соли. Классификация солей. Номенклатура солей.
Бытовые названия некоторых солей.
Слайд 3

Классификация неорганических веществ
К важнейшим классам неорганических веществ относят:
простые вещества (металлы и
неметаллы),
оксиды (кислотные, основные и амфотерные),
гидроксиды (часть кислот, основания, амфотерные гидроксиды),
соли.
Слайд 4

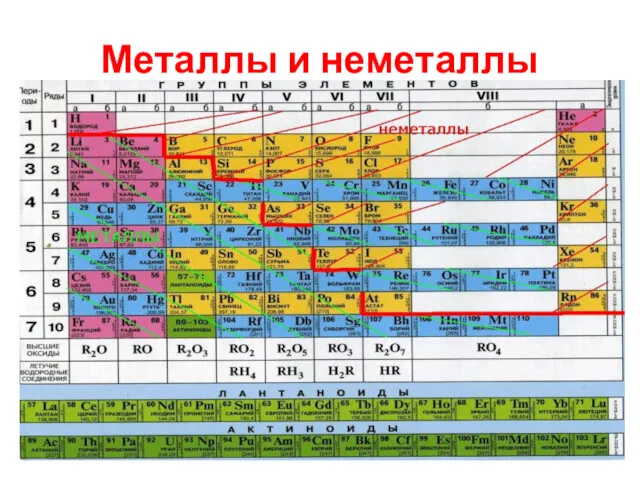
Простые вещества обычно делят на металлы и неметаллы.
Металлы – простые вещества,
в которых атомы связаны между собой металлической связью.
Неметаллы – простые вещества, в которых атомы связаны между собой ковалентными (или межмолекулярными) связями.
Слайд 5
Слайд 6

Амфотерные металлы
По химическим свойствам среди металлов выделяют группу так называемых амфотерных
металлов.
Это название отражает способность этих металлов, их оксидов и гидроксидов реагировать как с кислотами, так и со щелочами.
Цинк, алюминий, хром, марганец, железо.
Слайд 7

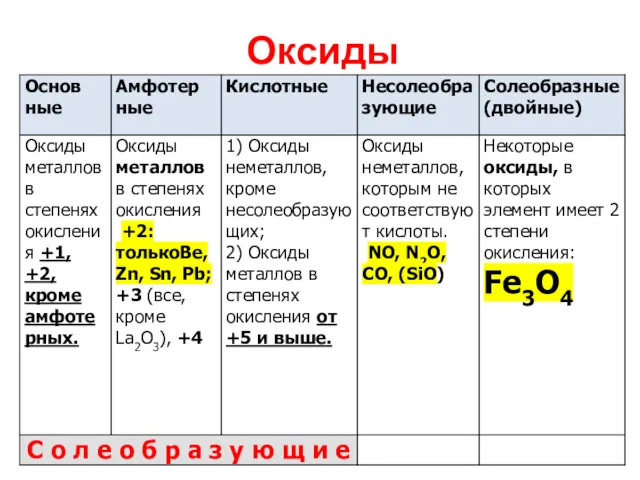
Оксиды
Оксиды – бинарные соединения, одним из двух элементов в которых является
кислород со степенью окисления -2.
Слайд 8
Слайд 9

Каждому солеобразующему оксиду соответствует гидроксид:
Основным оксидам соответствуют основания;
Амфотерным оксидам
– амфотерные гидроксиды,
Кислотным оксидам – кислородсодержащие кислоты.
Слайд 10

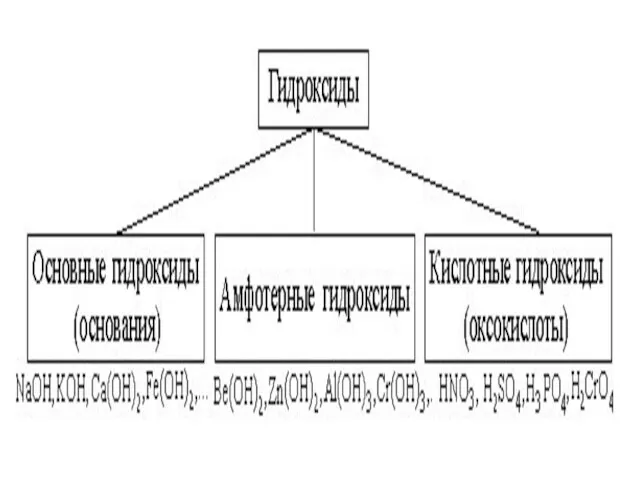
Гидроксиды
Гидроксиды – соединения, в состав которых входит группа Э–О-Н.
И
основания, и кислородсодержащие кислоты, и амфотерные гидроксиды – относятся к ГИДРОКСИДАМ!
Слайд 11
Слайд 12
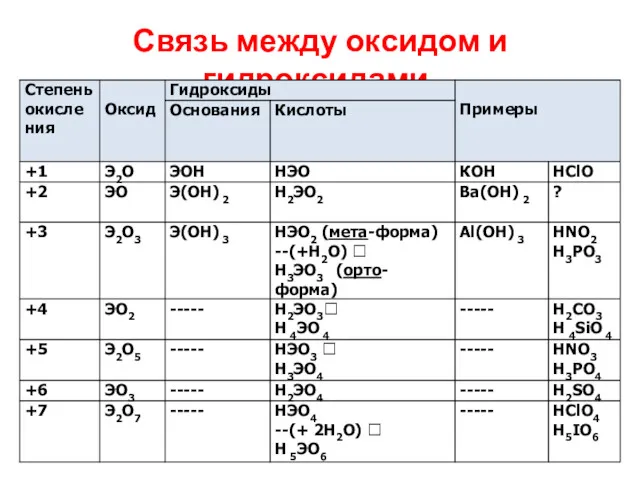
Связь между оксидом и гидроксидами.
Слайд 13

КАК СОСТАВИТЬ ФОРМУЛУ КИСЛОТНОГО ГИДРОКСИДА
А. Если чётная степень окисления элемента в
оксиде: ПРИБАВЛЯЕМ ВОДУ к оксиду. Пример: WO3 –(+H2O)? H2WO4
Б. Если нечетная степень окисления:
Мета-форма кислоты - ОДИН атом водорода: НЭОх
Орто-форма кислоты – отличается от МЕТА-формы на одну молекулу воды. Н3ЭОх+1
Слайд 14

КАК СОСТАВИТЬ ФОРМУЛУ КИСЛОТНОГО ГИДРОКСИДА
Пример: Оксид As2O5, степень окисления мышьяка +5.
Составим формулу кислоты: Н+As+5O-2x
Так как суммарный заряд =0, легко рассчитать, что х=3.
HAsO3 Это МЕТА-форма кислоты - мета-мышьяковая кислота.
Но для фосфора и мышьяка существует и более устойчива ОРТО-форма. Прибавив к мета-форме Н2О, получим H3AsO4. Это орто- мышьяковая кислота.
Слайд 15

Основания
Основания – сложные вещества, содержащие в своем составе гидроксид-ионы ОН- и
при диссоциации образующие в качестве анионов только эти ионы.
Слайд 16

Слайд 17

КИСЛОТНОСТЬ основания
КИСЛОТНОСТЬ основания – это число групп ОН в его формуле:
однокислотные – содержащие только 1 гидроксогруппу
двухкислотные – имеющие 2 гидроксогруппу;
трёхкислотные – с тремя группами ОН.
Слайд 18

Кислоты
Кислоты – сложные вещества, содержащие в своем составе ионы оксония Н+
или при взаимодействии с водой образующие в качестве катионов только эти ионы.
Слайд 19

Классификация кислот по составу
Слайд 20

Классификация кислот по числу атомов водорода.
Слайд 21

Классификация по силе и устойчивости
Слайд 22

Соли
Соли – это сложные вещества, состоящие из одного (нескольких) атомов металла
(или более сложных катионных групп, например, аммонийных групп NН4+) и одного (или нескольких)
Слайд 23

Слайд 24
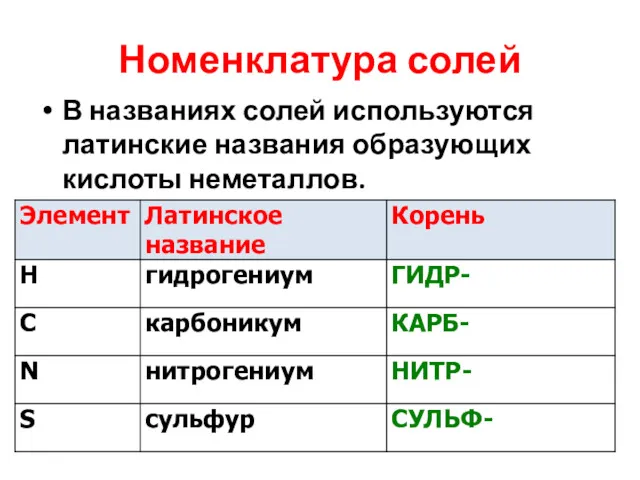
Номенклатура солей
В названиях солей используются латинские названия образующих кислоты неметаллов.
Слайд 25

Построение названий солей
Слайд 26
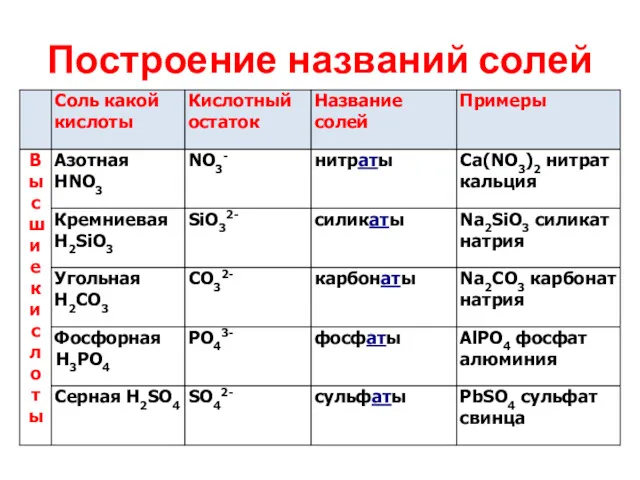
Построение названий солей
Слайд 27
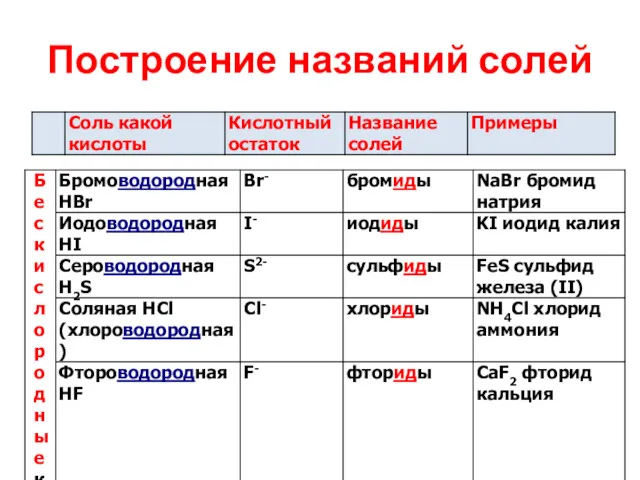
Построение названий солей
Слайд 28
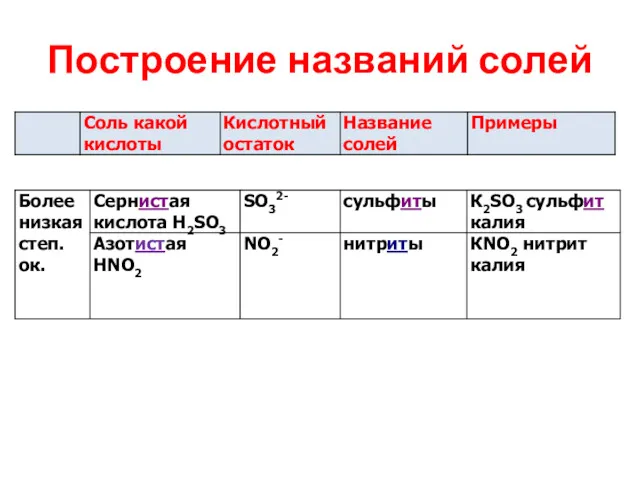
Построение названий солей
Слайд 29

Кислые соли
Кислые соли, помимо ионов металла и кислотного остатка, содержат ионы
водорода. Названия кислых солей содержат приставку "гидро":
NaHCO3 – гидрокарбонат натрия,
K2HPO4 – гидрофосфат калия,
KH2PO4 – дигидрофосфат калия.
Слайд 30

Основные соли
Основные соли, помимо ионов металла и кислотного остатка, содержат гидроксильные
группы.
Основные соли образуются при неполной нейтрализации основания. Названия основных солей образуют с помощью приставки "гидроксо":
Mg(OH)Cl - гидроксохлорид магния (основная соль)
Слайд 31

Двойные соли
Двойные соли – имеют два разных катиона металла или аммония.
В названии их перечисляют через дефис:
(NH4)Fe(SO4)2 – сульфат железа (III)-аммония.
Слайд 32

Смешанные соли
Смешанные соли – имеют два разных аниона кислотных остатков. В
названии их называют через дефис:
СаOCl2 или CaCl(OCl) - хлорид-гипохлорит кальция (традиционное название хлорная известь).
Слайд 33

Комплексные соли
Комплексные соли – содержат сложный комплексный анион (или реже катион),
состоящий из металла-комплексообразователя и нескольких лигандов (отрицательно заряженные ионы или молекулы аммиака или воды).
Пример: K[Al(OH)4] – тетрагидроксоалюминат калия
K4[Fe(CN)6] – гексацианоферрат калия
[Cu(NH3)4]Cl2 – хлорид тетраамминмеди (II)
Слайд 34

Бытовые (тривиальные) названия некоторых солей
Слайд 35

Источники
http://egeigia.ru/all-ege/materialy-ege/himiya/566-ege-him-2012-5


































 Таланты известных химиков
Таланты известных химиков Історичні відомості про способи класифікації хімічних елементів. Поняття про лужні метали, галогени, інертні гази
Історичні відомості про способи класифікації хімічних елементів. Поняття про лужні метали, галогени, інертні гази Заходи з ліквідації наслідків хімічної небезпечної надзвичайної ситуації. Особливості ведення хімічної розвідки та контролю
Заходи з ліквідації наслідків хімічної небезпечної надзвичайної ситуації. Особливості ведення хімічної розвідки та контролю Крахмал. Физические свойства
Крахмал. Физические свойства Хром. Физические свойства и применение
Хром. Физические свойства и применение Алкадиены. Актуализация ранее полученных знаний
Алкадиены. Актуализация ранее полученных знаний Морские льды. Их классификация и закономерности движения
Морские льды. Их классификация и закономерности движения Транспортное обеспечение внесения удобрений
Транспортное обеспечение внесения удобрений Е-числа в школьном буфете
Е-числа в школьном буфете Алкены. Непредельные углеводороды
Алкены. Непредельные углеводороды Ионные уравнения реакций
Ионные уравнения реакций Спирты. Определение. Классификация
Спирты. Определение. Классификация Термодинамика. 1 закон термодинамики
Термодинамика. 1 закон термодинамики Двойной электрический слой, его строение. Электродный потенциал
Двойной электрический слой, его строение. Электродный потенциал Металлы. Особенности строения. Классификация, физические и химические свойства
Металлы. Особенности строения. Классификация, физические и химические свойства Гравиметрические методы анализа
Гравиметрические методы анализа Алкины. Химические и физические свойства алкинов. Строение алкинов
Алкины. Химические и физические свойства алкинов. Строение алкинов Сероводород. Сульфиды
Сероводород. Сульфиды Матеріальний баланс процесу горіння
Матеріальний баланс процесу горіння Фосфор и его соединения. 9 класс
Фосфор и его соединения. 9 класс Кaрбоновые кислоты
Кaрбоновые кислоты Правила работы в лаборатории и приёмы обращения с лабораторным оборудованием (8 класс)
Правила работы в лаборатории и приёмы обращения с лабораторным оборудованием (8 класс) Экоаналитический контроль воздуха
Экоаналитический контроль воздуха Кислоты. Состав кислот
Кислоты. Состав кислот Газовые гидраты
Газовые гидраты Tungsten. (Вольфрам)
Tungsten. (Вольфрам) Реакции подлинности лекарственных веществ
Реакции подлинности лекарственных веществ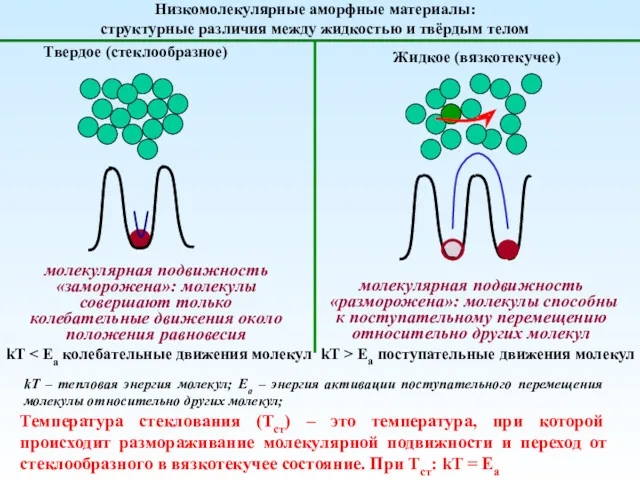 Механика полимеров
Механика полимеров