Содержание
- 2. Задание к занятию по теме «Кaрбоновые кислоты». 1. просмотреть презентацию «Карбоновые кислоты» 2.составить опорный конспект, указав
- 3. Строение Карбоновые кислоты – это вещества, содержащие в молекуле одну или несколько карбоксильных групп. Карбоксильная группа
- 4. Органические кислоты, содержащие в молекуле одну карбоксильную группу, являются одноосновными. Общая формула этих кислот RCOOH. Карбоновые
- 5. В зависимости от природы углеводородного радикала карбоновые кислоты делятся на предельные, непредельные, ароматические. Предельные (или насыщенные)
- 6. Номенклатура и изомерия Название карбоновой кислоты образуется от названия соответствующего алкана с добавлением суффикса –ов, окончания
- 7. Физические свойства предельных одноосновных карбоновых кислот Низшие кислоты, содержащие в молекуле до 4 атомов углерода –
- 8. Молекулы предельных одноосновных карбоновых кислот содержат полярную группу атомов – COOH (карбоксил) и практически неполярный углеводородный
- 9. Химические свойства Диссоциация с образованием катионов водорода и анионов кислотного остатка: CH3 – COOH CH3 –
- 10. Взаимодействие карбоновых кислот со спиртами с образованием сложных эфиров – реакция этерификации: CH3 – C –
- 11. Взаимодействие с основными оксидами: 2RCOOH + СаО = (RCOO)2Ca + Н2О Окисление муравьиной кислоты (эта реакция
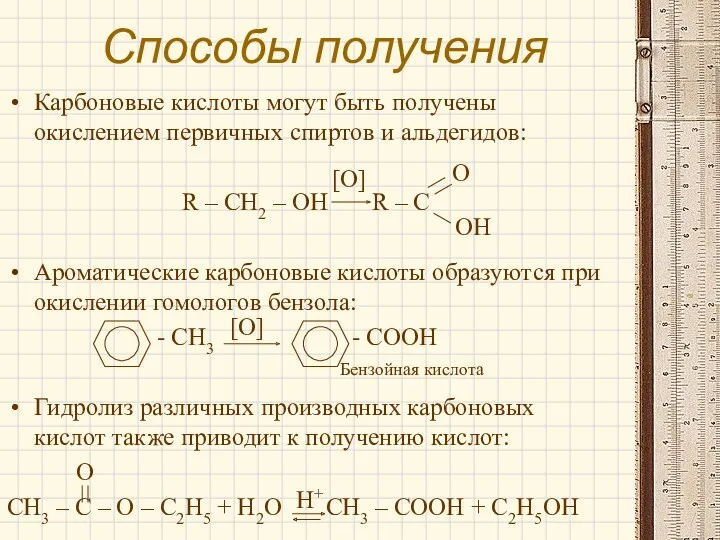
- 12. Способы получения Карбоновые кислоты могут быть получены окислением первичных спиртов и альдегидов: R – CH2 –
- 13. Лабораторный способ получения уксусной кислоты 2CH3COONa +H2SO4---2CH3COOH +Na2SO4
- 14. Применение Муравьиная кислота обладает дезинфицирующим свойством и поэтому находит свое применение в пищевой, кожевенной и фармацевтической
- 15. Уксусная кислота – хороший растворитель многих органических веществ. Используется при крашении, в кожевенном производстве, в лакокрасочной
- 16. Соли пальмитиновой и стеариновой кислот – стеараты и пальмитаты – обладают моющим действием, поэтому их еще
- 17. Проверочная работа
- 18. Проверочная работа по разделу «Спирты. Альдегиды. Карбоновые кислоты» 1. Общая формула предельных одноосновных кислот: 1) СnH2n+1OH
- 20. Скачать презентацию
















 Пропан, C3H8
Пропан, C3H8 Зародження періодичної системи елементів Менделєєва
Зародження періодичної системи елементів Менделєєва Азотная кислота. Получение, свойства. Нитраты, азотные удобрения
Азотная кислота. Получение, свойства. Нитраты, азотные удобрения Атомы, молекулы и ионы. Вещества молекулярного и немолекулярного строения
Атомы, молекулы и ионы. Вещества молекулярного и немолекулярного строения Электролитическая диссоциация
Электролитическая диссоциация Элементарные частицы вещества
Элементарные частицы вещества Каталитический крекинг
Каталитический крекинг Алканы: физические и химические свойства, получение
Алканы: физические и химические свойства, получение Углеводородное сырье: способы переработки
Углеводородное сырье: способы переработки Chemical potential. Chemical potential of an ideal gas
Chemical potential. Chemical potential of an ideal gas Ретросинтез Wickerol A
Ретросинтез Wickerol A Biomass Feedstocks
Biomass Feedstocks Нуклеиновые кислоты, их структурные компоненты
Нуклеиновые кислоты, их структурные компоненты Азотсодержащие гетероциклические соединения
Азотсодержащие гетероциклические соединения Геохимия природных процессов. Геохимическая типизация гранитоидов Л.В. Таусона
Геохимия природных процессов. Геохимическая типизация гранитоидов Л.В. Таусона Химическая реакция – превращение одних веществ в другие
Химическая реакция – превращение одних веществ в другие Первоначальные представления об органических веществах
Первоначальные представления об органических веществах Закон триад. Открытие периодического закона
Закон триад. Открытие периодического закона Подгруппа азота. 9 класс
Подгруппа азота. 9 класс Строение атома. Лекция № 2
Строение атома. Лекция № 2 Щелочные металлы
Щелочные металлы Амины. Общая характеристика, номенклатура, изомерия. Получение. Физико-химические свойства. Отдельные представители
Амины. Общая характеристика, номенклатура, изомерия. Получение. Физико-химические свойства. Отдельные представители Теория электролитической диссоциации
Теория электролитической диссоциации Применение соляной кислоты и её солей
Применение соляной кислоты и её солей Серебро
Серебро Изучение упругости диссоциации карбоната кальция
Изучение упругости диссоциации карбоната кальция Многоатомные спирты
Многоатомные спирты Химические реакции. Реакции обмена
Химические реакции. Реакции обмена