Содержание
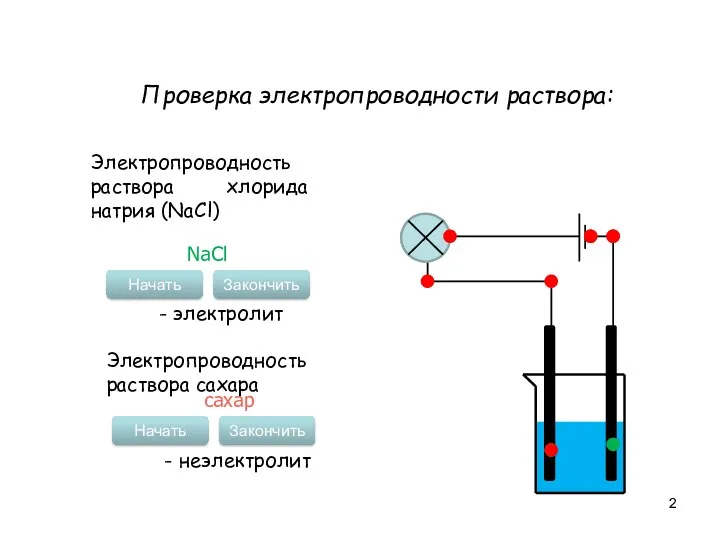
- 2. Проверка электропроводности раствора: Электропроводность раствора хлорида натрия (NaCl) Начать Закончить NaCl - электролит Электропроводность раствора сахара
- 3. Вещества (составить схему стр. 26) Название группы веществ примеры Название группы веществ примеры
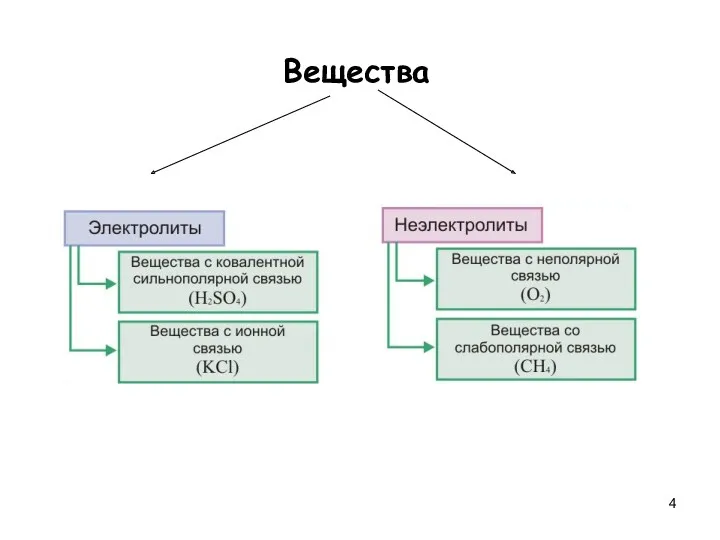
- 4. Вещества
- 5. Задание. Из предложенного списка выбери вещества, которые относятся к электролитам. 1) HCl; 6) H2SO4; 2) N2;
- 6. Электролитическая диссоциация - (написать определение - низ стр. 26, вверх стр.27) Сванте Август Аррениус 1859-1927гг. Шведский
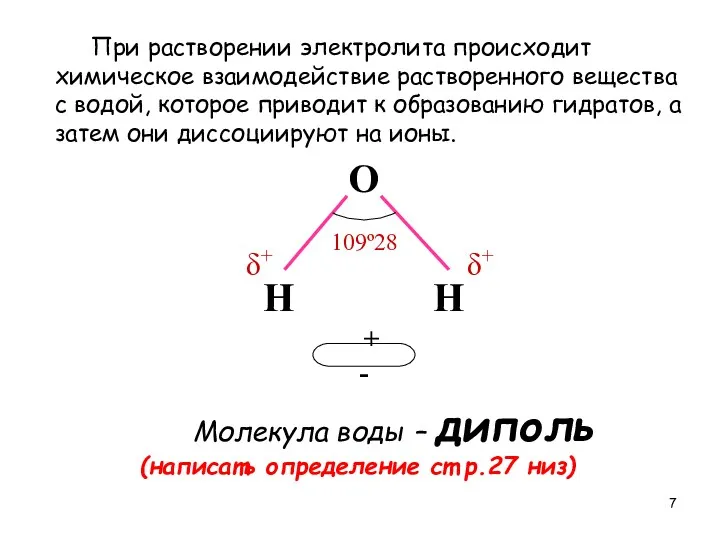
- 7. При растворении электролита происходит химическое взаимодействие растворенного вещества с водой, которое приводит к образованию гидратов, а
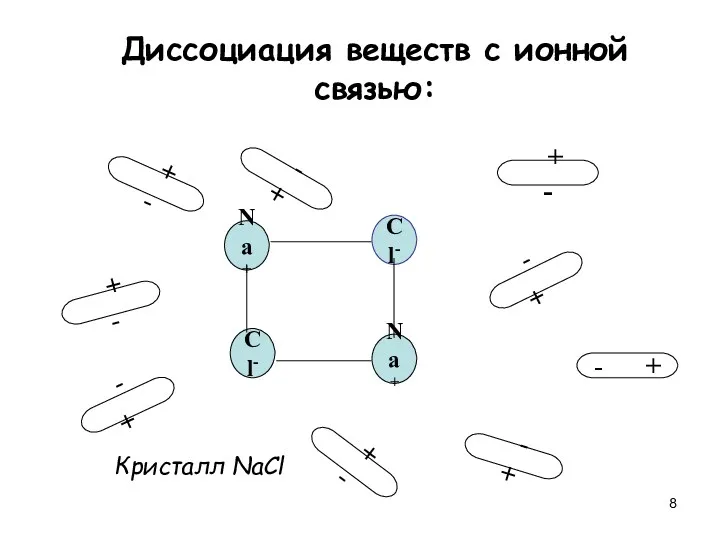
- 8. Диссоциация веществ с ионной связью: Na+ Cl- Cl- Na+ + - + - + - -
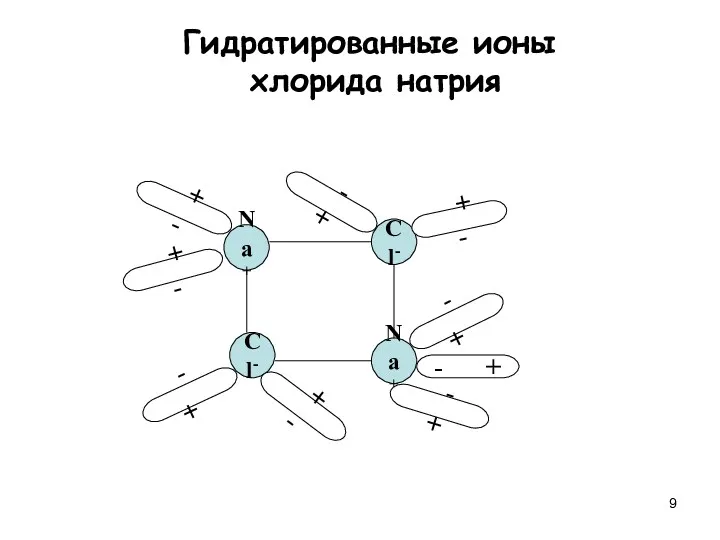
- 9. Na+ Cl- Cl- Na+ + - + - + - - + - + - +
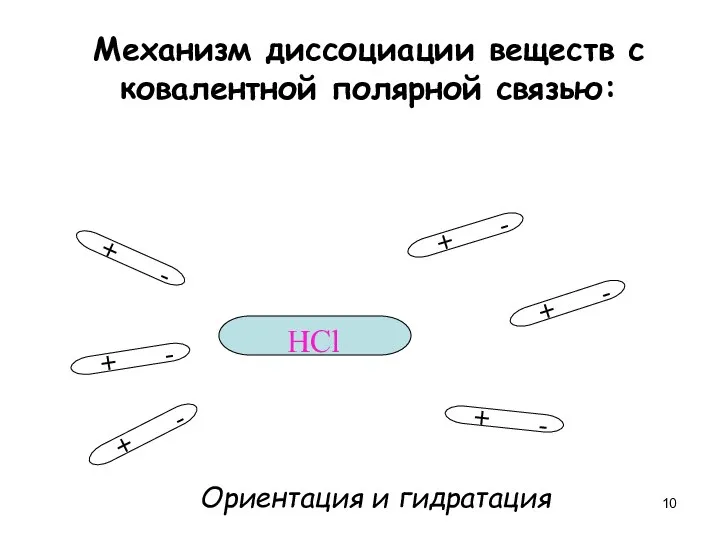
- 10. Механизм диссоциации веществ с ковалентной полярной связью: + - + - + - + - +
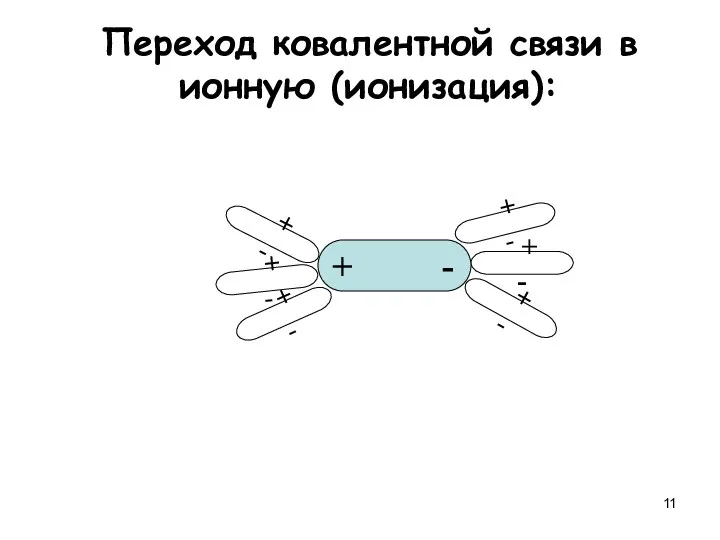
- 11. Переход ковалентной связи в ионную (ионизация): + - + - + - + - + -
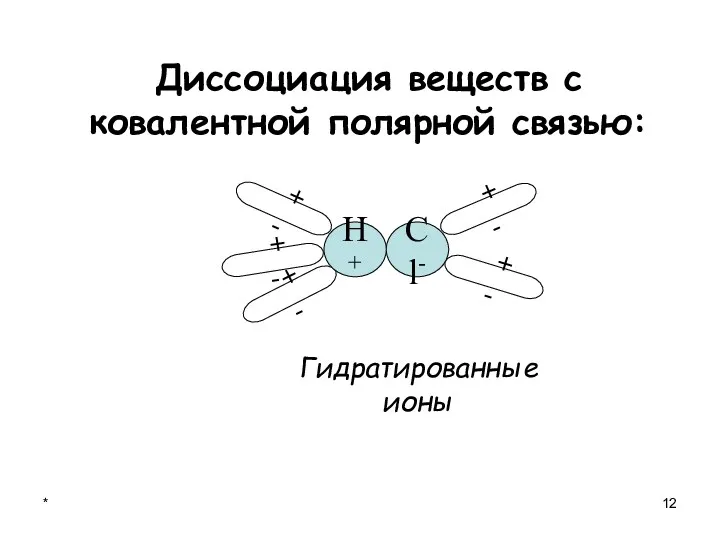
- 12. * Диссоциация веществ с ковалентной полярной связью: + - + - + - + - Гидратированные
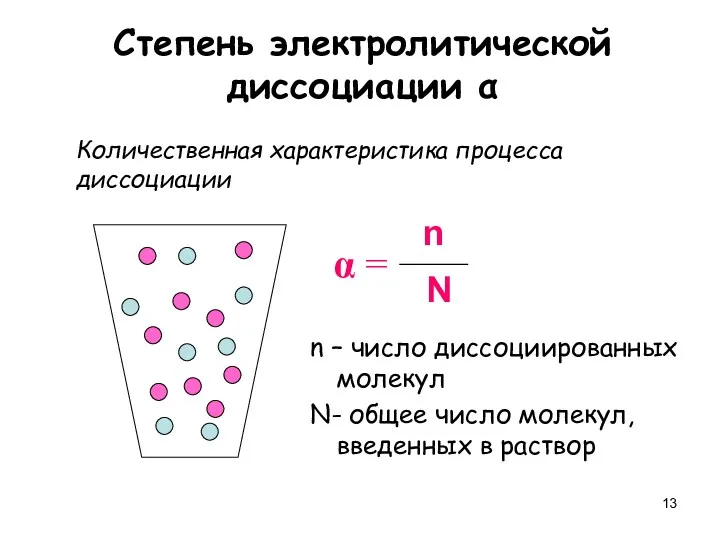
- 13. Степень электролитической диссоциации α Количественная характеристика процесса диссоциации n – число диссоциированных молекул N- общее число
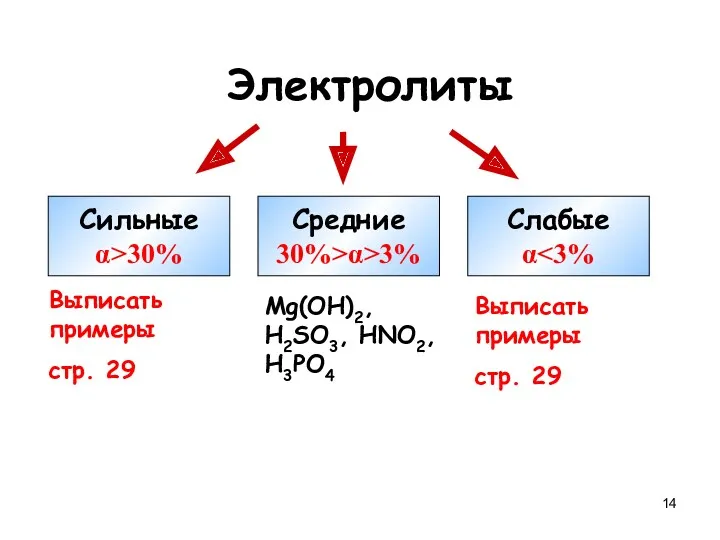
- 14. Электролиты Сильные α>30% Средние 30%>α>3% Слабые α Выписать примеры стр. 29 Mg(OH)2, H2SO3, HNO2, H3PO4 Выписать
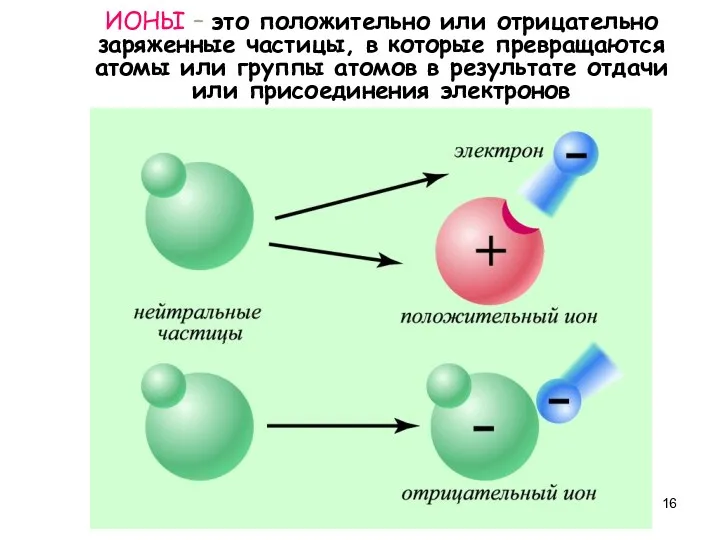
- 16. ИОНЫ – это положительно или отрицательно заряженные частицы, в которые превращаются атомы или группы атомов в
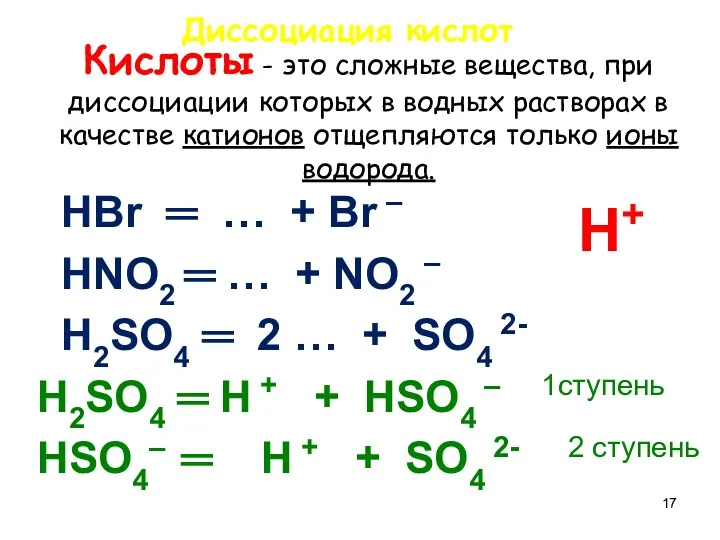
- 17. Кислоты - это сложные вещества, при диссоциации которых в водных растворах в качестве катионов отщепляются только
- 18. Напишите уравнения диссоциации кислот, назовите их HCl = … + … HNO3 = … + …
- 19. Проверка HCl = H + + Cl - HNO3 = H + + NO3 – По
- 20. Основания - это сложные вещества, при диссоциации которых в водных растворах в качестве анионов отщепляются только
- 21. Напишите уравнения диссоциации оснований, назовите их KOH = … + … Ca(OH)2 = … + …
- 22. Проверка KOH = K + + OH – Ca(OH)2 = Ca 2+ + 2OH – LiOH
- 23. Диссоциация солей Соли -это сложные вещества, которые в водных растворах диссоциируют на катионы металла и анионы
- 24. KCl = … + … Na2SO4 = … + … Fe(NO3)3 = … + … Напишите
- 25. KCl = K + + Cl - Na2SO4 = 2 Na + + SO4 2- Fe(NO3)3
- 26. * Задание. Пользуясь таблицей растворимости, определите, водные растворы каких веществ будут диссоциировать на ионы: КСl, CuO,
- 27. Задание. Напишите уравнение диссоциации веществ. 1. KNO3 2. Mg(NO3)2 3. Ba(OH)2 4. HF 5. K2SO4 6.
- 28. Характерные симптомы дефицита химических элементов в организме человека
- 29. * Что называют электролитической диссоциацией? Какие вещества называют электролитами? Какие вещества к ним относятся? Какой тип
- 30. * Задание. Пользуясь таблицей растворимости, определите, водные растворы каких веществ будут диссоциировать на ионы: КСl, CuO,
- 32. Скачать презентацию


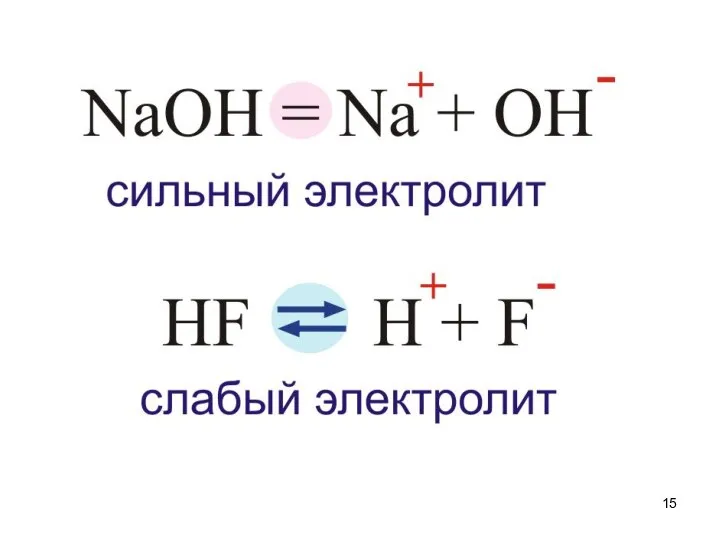













 Углеводы. Моносахариды
Углеводы. Моносахариды Растворы. Общие свойства растворов
Растворы. Общие свойства растворов Бораты и силикаты как матрицы лазеров. Свойства и методы выращивания
Бораты и силикаты как матрицы лазеров. Свойства и методы выращивания Непредельные углеводороды. Алкены
Непредельные углеводороды. Алкены Электрохимическая коррозия металлов
Электрохимическая коррозия металлов Полезные геологические химические соединения. Получение меди из малахита
Полезные геологические химические соединения. Получение меди из малахита Химическая связь
Химическая связь Автомобильные эксплуатационные материалы и экономия топливно-энергетических ресурсов. Автомобильные бензины
Автомобильные эксплуатационные материалы и экономия топливно-энергетических ресурсов. Автомобильные бензины Общие проблемы определения низких концентраций
Общие проблемы определения низких концентраций Составление формул химических соединений
Составление формул химических соединений Water and its properties
Water and its properties Волокна. Классификация волокон
Волокна. Классификация волокон Эмпирические законы кристаллографии
Эмпирические законы кристаллографии Периодический закон Д.И. Менделеева
Периодический закон Д.И. Менделеева Аномальные свойства воды – основа жизни на Земле
Аномальные свойства воды – основа жизни на Земле Силикатная промышленность. 9 класс
Силикатная промышленность. 9 класс Карбоновые кислоты (часть 1)
Карбоновые кислоты (часть 1) Визитка химического элемента. Водород
Визитка химического элемента. Водород Виділення з суміші речовин. Прості речовини
Виділення з суміші речовин. Прості речовини Органические соединения серы
Органические соединения серы Основные классы химических соединений
Основные классы химических соединений Електроліз. Найпоширеніші способи застосування
Електроліз. Найпоширеніші способи застосування Топливный элемент
Топливный элемент Закон минимума Либиха. Ограничивающий фактор
Закон минимума Либиха. Ограничивающий фактор Добування кисню
Добування кисню Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Синтетические моющие средства
Синтетические моющие средства Углеводы. Молекулярные формулы
Углеводы. Молекулярные формулы