Слайд 2

Цели урока
изучить способы получения,
химические свойства
применение алкенов
на примере
непредельного углеводорода - этилена
Слайд 3
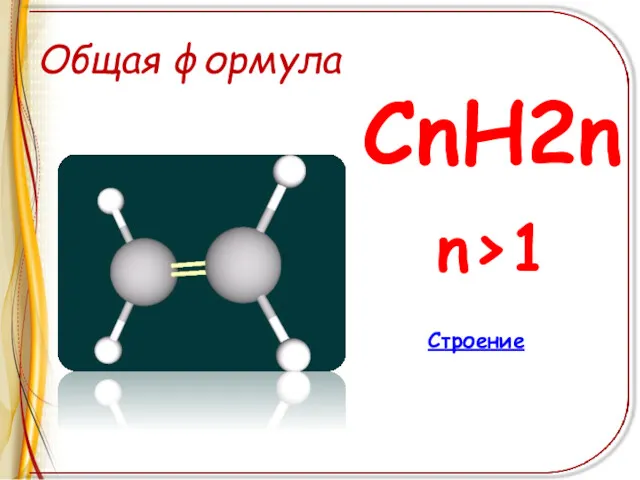
Общая формула
СnH2n
n>1
Строение
Слайд 4
Слайд 5
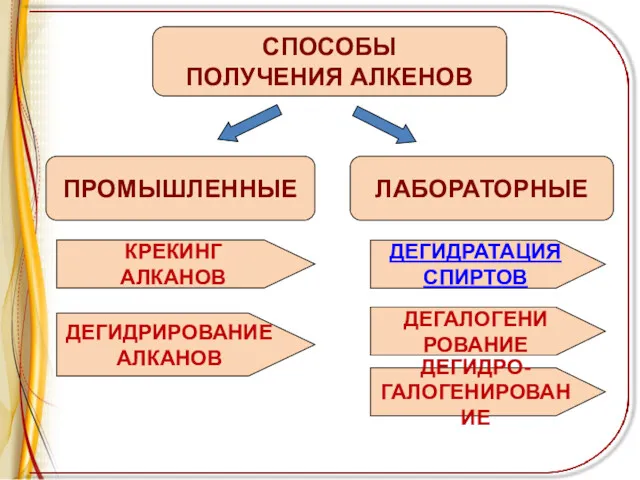
ПРОМЫШЛЕННЫЕ
СПОСОБЫ
ПОЛУЧЕНИЯ АЛКЕНОВ
ЛАБОРАТОРНЫЕ
КРЕКИНГ
АЛКАНОВ
ДЕГИДРИРОВАНИЕ
АЛКАНОВ
ДЕГИДРАТАЦИЯ
СПИРТОВ
ДЕГАЛОГЕНИ
РОВАНИЕ
ДЕГИДРО-
ГАЛОГЕНИРОВАНИЕ
Слайд 6
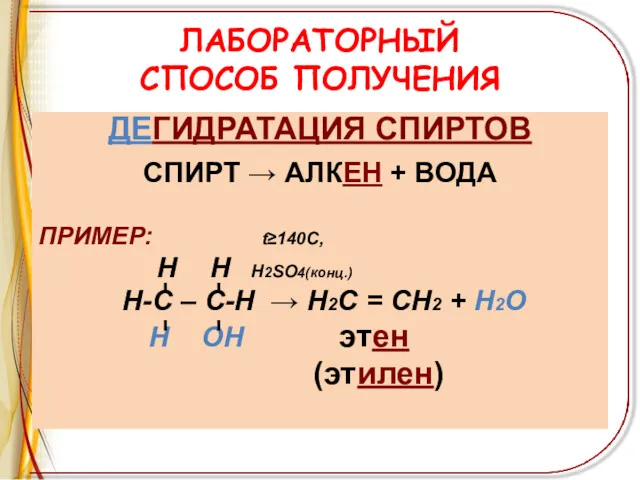
ЛАБОРАТОРНЫЙ
СПОСОБ ПОЛУЧЕНИЯ
ДЕГИДРАТАЦИЯ СПИРТОВ
СПИРТ → АЛКЕН + ВОДА
ПРИМЕР: t≥140C,
Н Н
Н2SO4(конц.)
Н-С – С-Н → Н2С = СН2 + Н2О
Н ОН этен
(этилен)
Слайд 7

Получение алкенов
КРЕКИНГ АЛКАНОВ
АЛКАН → АЛКАН + АЛКЕН
С БОЛЕЕ ДЛИННОЙ С
МЕНЕЕ ДЛИННОЙ
УГЛЕРОДНОЙ УГЛЕРОДНОЙ
ЦЕПЬЮ ЦЕПЬЮ
ПРИМЕР:
t=400-700C
С 10 Н 22→ С5Н 12+ С5Н10
декан пентан пентен
Слайд 8
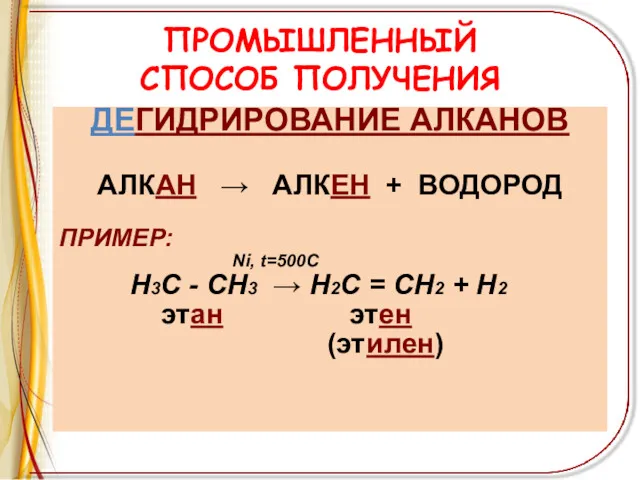
ПРОМЫШЛЕННЫЙ
СПОСОБ ПОЛУЧЕНИЯ
ДЕГИДРИРОВАНИЕ АЛКАНОВ
АЛКАН → АЛКЕН + ВОДОРОД
ПРИМЕР:
Ni, t=500C
Н3С - СН3 → Н2С = СН2 + Н2
этан этен
(этилен)
Слайд 9
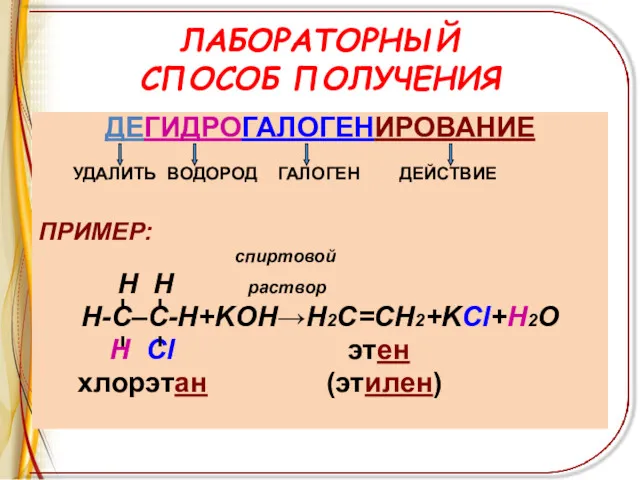
ЛАБОРАТОРНЫЙ
СПОСОБ ПОЛУЧЕНИЯ
ДЕГИДРОГАЛОГЕНИРОВАНИЕ
УДАЛИТЬ ВОДОРОД ГАЛОГЕН ДЕЙСТВИЕ
ПРИМЕР:
спиртовой
H H раствор
Н-С–С-Н+KOH→Н2С=СН2+KCl+H2O
Н
Cl этен
хлорэтан (этилен)
Слайд 10

РЕАКЦИИ ОКИСЛЕНИЯ
ГОРЕНИЕ АЛКЕНОВ
ПРИМЕР:
С2Н4 + 3О2 2СО2 + 2Н2О
Слайд 11

РЕАКЦИИ ОКИСЛЕНИЯ
МЯГКОЕ ОКИСЛЕНИЕ – ВЗАИМОДЕЙСТВИЕ С РАСТВОРОМ ПЕРМАНГАНАТА КАЛИЯ
(реакция
Е.Е.Вагнера)
Н2С=СН2 + [O] + H2O H2C - CH2
OH OH
этиленгликоль
(этандиол-1,2)
! Качественная реакция на непредельность углеводорода – на кратную связь
Слайд 12
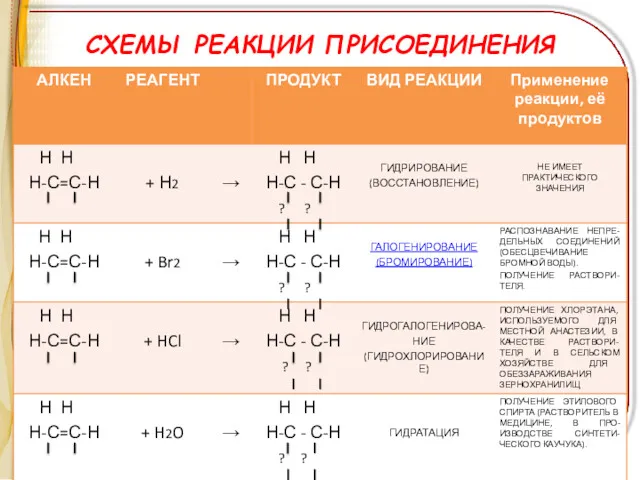
СХЕМЫ РЕАКЦИИ ПРИСОЕДИНЕНИЯ
Слайд 13

РЕАКЦИЯ ПОЛИМЕРИЗАЦИИ
Это процесс соединения одинаковых молекул в более крупные.
ПРИМЕР: n CH2=CH2
(-CH2-CH2-)n
этилен полиэтилен
(мономер) (полимер)
n – степень полимеризации, показывает число молекул, вступивших в реакцию
-CH2-CH2- структурное звено












 Аминокислоты, их строение, изомерия, свойства, применение
Аминокислоты, их строение, изомерия, свойства, применение Изучение процесса коррозии железа (домашний эксперимент)
Изучение процесса коррозии железа (домашний эксперимент) Минералы и горные породы
Минералы и горные породы Сұйықтардағы газ ерітінділері. Генри заңы. Сұйық-сұйық ерітінділердегі бу қысымы. Рауль заңынын ауытқу. Криометрия
Сұйықтардағы газ ерітінділері. Генри заңы. Сұйық-сұйық ерітінділердегі бу қысымы. Рауль заңынын ауытқу. Криометрия Протекание ОВР зависит от рН среды
Протекание ОВР зависит от рН среды Сполуки неметалічних елементів з Гідрогеном
Сполуки неметалічних елементів з Гідрогеном Хром. Химиялық қасиеттері
Хром. Химиялық қасиеттері 20230306_vodorod_ego_fizicheskie_svoystva
20230306_vodorod_ego_fizicheskie_svoystva Закономерности процессов нитрования НЦ
Закономерности процессов нитрования НЦ Основные электрохимические процессы
Основные электрохимические процессы Иодометрия. Комплексиметрия (начало)
Иодометрия. Комплексиметрия (начало) Золото Au (Аурум)
Золото Au (Аурум) Кислородсодержащие органические соединения. Спирты
Кислородсодержащие органические соединения. Спирты Растворение как физико-химический процесс
Растворение как физико-химический процесс Химический анализ веществ
Химический анализ веществ Диагностические свойства минералов. Занятие 3-4
Диагностические свойства минералов. Занятие 3-4 Химия воды
Химия воды Химические свойства основных неорганических соединений в свете ЭД и ОВР
Химические свойства основных неорганических соединений в свете ЭД и ОВР Основные виды химических связей
Основные виды химических связей Занимательные опыты
Занимательные опыты Титриметрический метод анализа
Титриметрический метод анализа Введение в органическую химию
Введение в органическую химию Полиэтилен - термопластичный полимер этилена
Полиэтилен - термопластичный полимер этилена Native elements
Native elements Понятие о солях (8 класс)
Понятие о солях (8 класс) Скорость химической реакции
Скорость химической реакции Состояние радионуклидов в различных фазах и методы его изучения
Состояние радионуклидов в различных фазах и методы его изучения Периодический закон и периодический закон Д.И. Менделеева
Периодический закон и периодический закон Д.И. Менделеева