Содержание
- 2. план урока
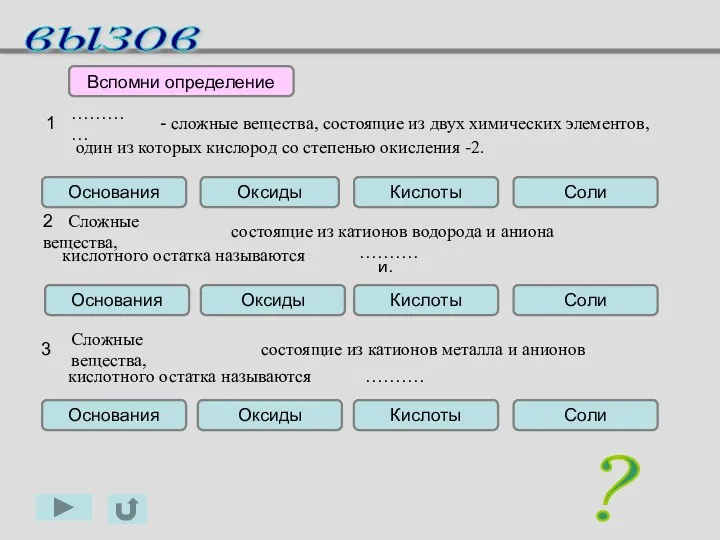
- 3. солями. 1 - сложные вещества, состоящие из двух химических элементов, один из которых кислород со степенью
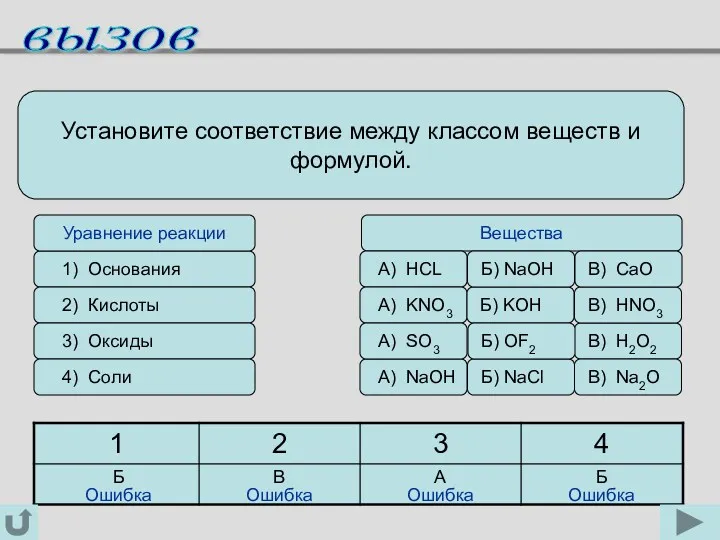
- 4. Установите соответствие между классом веществ и формулой. 1) Основания 2) Кислоты 3) Оксиды 4) Соли Уравнение
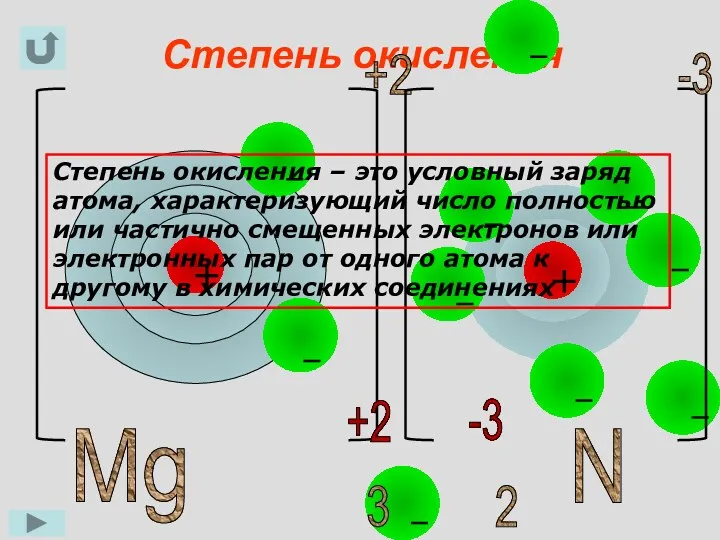
- 5. Степень окисления Mg +2 N 3 -3 2 +2 -3 Степень окисления – это условный заряд
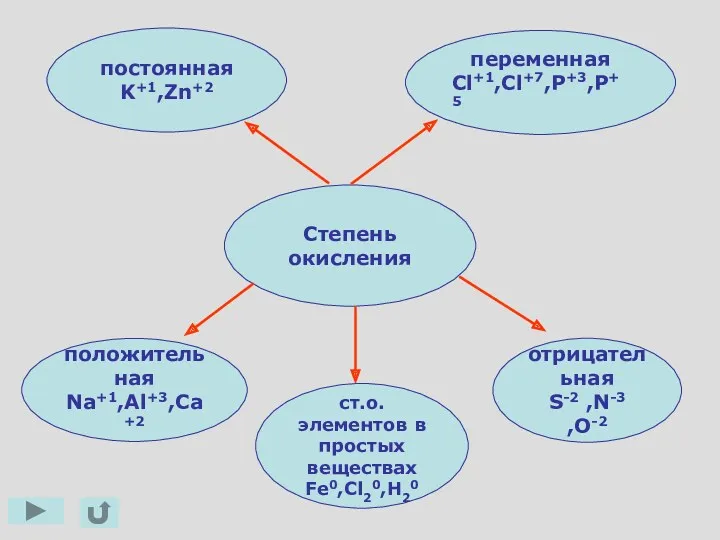
- 6. Степень окисления отрицательная S-2 ,N-3 ,O-2 ст.о. элементов в простых веществах Fe0,Cl20,H20 положительная Na+1,Al+3,Ca+2 переменная Cl+1,Cl+7,P+3,P+5
- 7. Какие степени окисления у серы? S+16 ))) 1s22s22p63s23p43d0 2 8 6 S* S** 3p4
- 8. Определите степени окисления элементов Al2O3 Ca3N2 K2Se P2O5 Cl2O7 As2O3 Al2+3O3-2 Ca3+2N2-3 K2+1Se-2 P2+5O5-2 Cl2+7O7-2 As2+3O3-2
- 9. Шаг 1 Шаг 2 Шаг 3 Шаг 4 Шаг 5 Записать рядом знаки элементов Определите степени
- 10. Наименьшим общим кратным натуральных чисел а и в называется наименьшее натуральное число, которое кратно и а,
- 11. 5 4 3 1 2 8 10 6 7 9 Na+ и I- Ca2+ и Cl-
- 12. Номенклатура химических соединений Как строятся названия бинарных соединений? CO2 – диоксид углерода или оксид C(IV) FeCl3
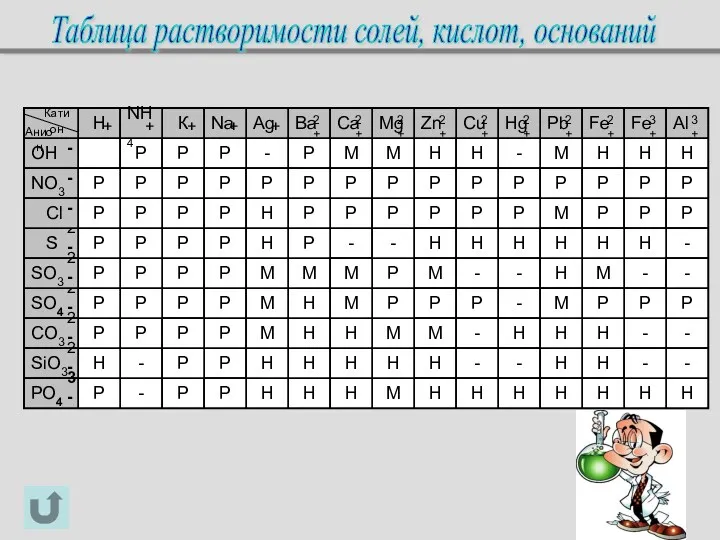
- 13. Таблица растворимости солей, кислот, оснований
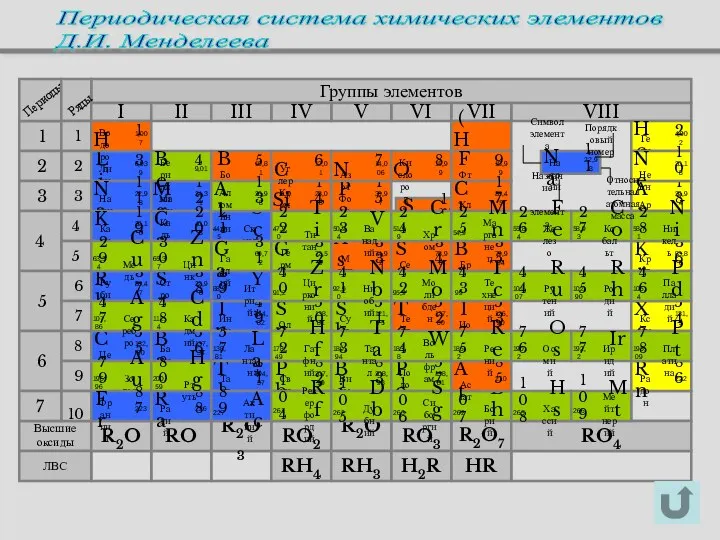
- 14. Периодическая система химических элементов Д.И. Менделеева
- 15. Степень окисления – это величина: а) переменная, б) постоянная, в) постоянная и переменная.
- 16. 2. Высшая степень окисления фосфора равна: а) номеру группы, т.е. 5, б) нулю, в) трем.
- 17. 3. Вещество, формула которого Р2О5, называется а) оксид фосфора, б) пентаоксид фосфора (V), в) оксид фосфора
- 18. 4. Степень окисления хлора равна -1 в: а) Cl2O3, б) PCl5, в) Cl2.
- 19. 5. Состав диоксида серы выражается формулой а) SO2, б) SO, в) SO3.
- 20. Рефлексия сегодня я узнал… было интересно… было трудно… я выполнял задания… я понял, что… теперь я
- 21. Отметьте свое состояние и настроение после урока на «дереве состояния».
- 22. Работаем в Интернете http://files.school-collection.edu.ru/dlrstore/c3cf20ae-3d55-babf-b8cb4f41b66a35ef/00120068356132562.htm
- 23. Работаем в Интернете http://files.school-collection.edu.ru/dlrstore/6129acbf-f0d2-b9f5-0043-cecbe934e509/00120068413911834.htm http://files.school-collection.edu.ru/dlrstore/7649825b-15a5-8aca-4b7f-0268739dba6e/00120068411849824.htm http://files.school-collection.edu.ru/dlrstore/84174a2a-cdc2-2d0f-a79d-1590e71ca374/00120068409867814.htm http://files.school-collection.edu.ru/dlrstore/0ab6ce97-4185-11db-b0de-0800200c9a66/ch08_19_02.swf http://files.school-collection.edu.ru/dlrstore/0ab71cb6-4185-11db-b0de-0800200c9a66/ch08_21_01.swf
- 25. Скачать презентацию















 Карбоновые кислоты
Карбоновые кислоты Сульфиды. Занятие 7
Сульфиды. Занятие 7 Свойства смесей ПАВ
Свойства смесей ПАВ Кислотно-основні рівноваги в біосистемах. Колігативні властивості біологічних рідин
Кислотно-основні рівноваги в біосистемах. Колігативні властивості біологічних рідин Игра по химии В рамках периодической таблицы
Игра по химии В рамках периодической таблицы Классификация химических элементов. Составитель. 8 класс
Классификация химических элементов. Составитель. 8 класс Кислотно-основное титрование в неводных средах
Кислотно-основное титрование в неводных средах Химический состав нефтей. Ненасыщенные углеводороды. Алкены и алкадиены
Химический состав нефтей. Ненасыщенные углеводороды. Алкены и алкадиены Гальванический элемент Даниэля-Якоби. Потенцометрия. Стеклянный электрод
Гальванический элемент Даниэля-Якоби. Потенцометрия. Стеклянный электрод Типичные реакции органических соединений
Типичные реакции органических соединений Типы химических реакций
Типы химических реакций Лужні метали
Лужні метали Галогенопроизводные углеводородов
Галогенопроизводные углеводородов Методы исследования взаимодействий с участием белков (Co-IP, equilibrium microdialysis, ITC, MST, SPR, BLI, QСM)
Методы исследования взаимодействий с участием белков (Co-IP, equilibrium microdialysis, ITC, MST, SPR, BLI, QСM) Магматические формации
Магматические формации Сущность процесса электролитической диссоциации
Сущность процесса электролитической диссоциации Основные понятия химии. Законы стехиометрии
Основные понятия химии. Законы стехиометрии Азотистая кислота
Азотистая кислота Химические волокна
Химические волокна Важнейшие классы бинарных соединений – оксиды и летучие соединения
Важнейшие классы бинарных соединений – оксиды и летучие соединения Получение порошков автоклавным осаждением
Получение порошков автоклавным осаждением Углерод и его соединения
Углерод и его соединения Икаит Ca[CO3]·6 (H2O)
Икаит Ca[CO3]·6 (H2O) Чистые вещества и смеси. Растворы
Чистые вещества и смеси. Растворы Подземное хранение газа и жидкости
Подземное хранение газа и жидкости Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования
Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Геохимия
Геохимия