Содержание
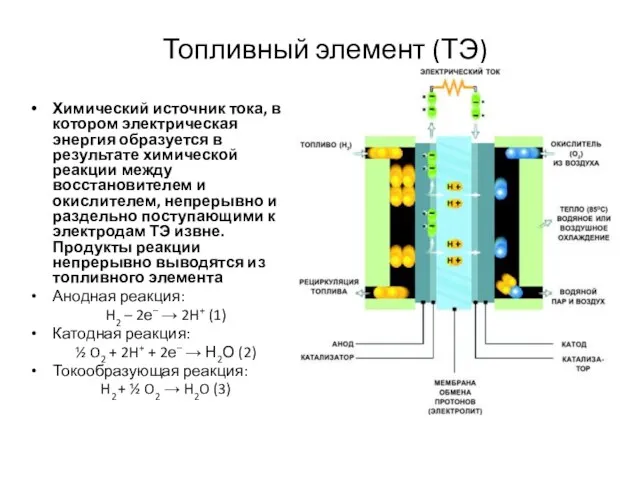
- 2. Топливный элемент (ТЭ) Химический источник тока, в котором электрическая энергия образуется в результате химической реакции между
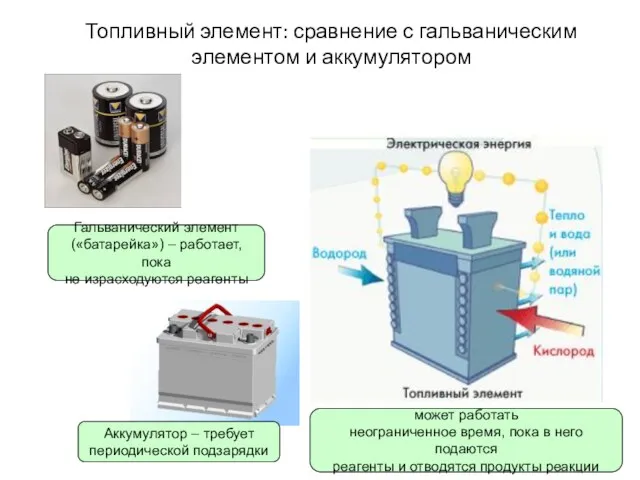
- 3. Топливный элемент: сравнение с гальваническим элементом и аккумулятором Гальванический элемент («батарейка») – работает, пока не израсходуются
- 4. Энергоэффективность топливного элемента Максимальный коэффициент полезного действия к.п.д. (макс.) = Wмакс / Q Электрическая работа топливного
- 5. Конструкция топливного элемента
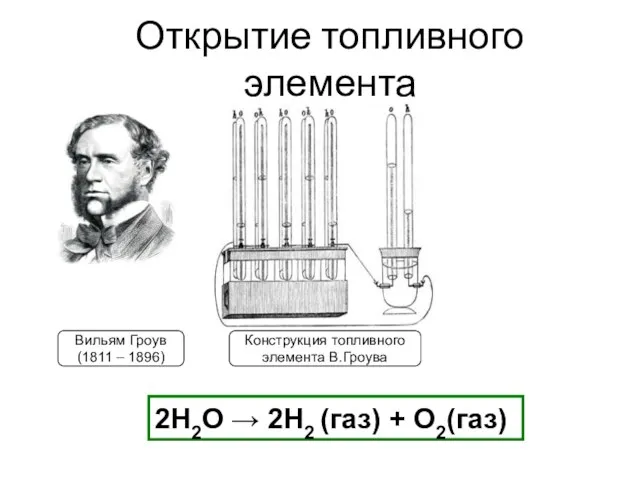
- 6. Открытие топливного элемента Вильям Гроув (1811 – 1896) Конструкция топливного элемента В.Гроува 2H2О → 2H2 (газ)
- 7. Предсказание фантаста (1874 год) «… воду когда-нибудь будут употреблять как топливо, … водород и кислород, которые
- 8. Fuel Cell (FC) – элемент будущего Людвиг Монд (1839 – 1909) Вильгельм Оствальд (1853-1932) «... Если
- 9. Сокрушительные удары для топливных элементов 1872 год – Ф. фон Хефнер-Альтенек сконструировал первый эффективно действующий генератор
- 10. Новая эра в развитии топливных элементов 1941 год - Государственная премия СССР «За выдающиеся изобретения» (инженер
- 11. Водород – идеальное топливо для топливного элемента химически активный легко подводится в топливный элемент продукт реакции
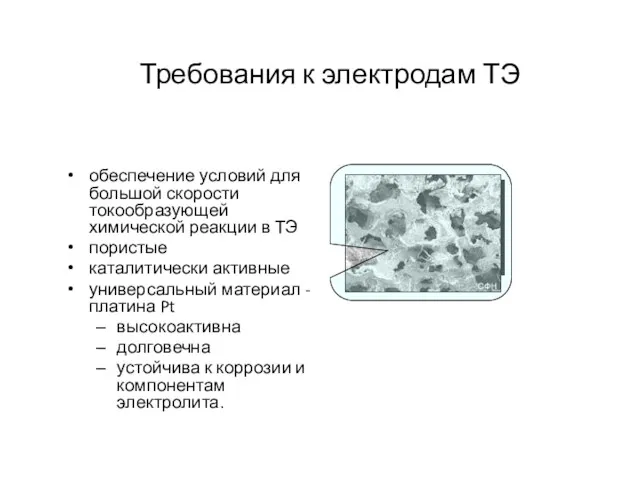
- 12. Требования к электродам ТЭ обеспечение условий для большой скорости токообразующей химической реакции в ТЭ пористые каталитически
- 13. Первый автомобиль на топливных элементах (1959 г.) Английский инженер Фрэнсис Томас Бэкон сконструировал и построил батарею
- 14. Минусы водородных автомобилей на топливных элементах соотношение массы автомобиля к его мощности слишком велико; топливная батарея
- 15. Низкотемпературные щелочные ТЭ Электролит - жидкий раствор щелочи Материал электродов – никель (устойчив в щелочных растворах)
- 16. Низкотемпературные кислотные ТЭ Электролит - жидкий раствор кислоты Окислителем может служить кислород воздуха, так как компоненты
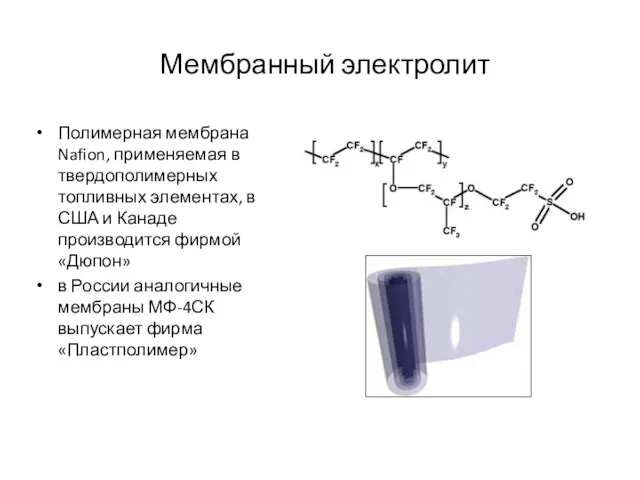
- 17. Мембранный электролит Полимерная мембрана Nafion, применяемая в твердополимерных топливных элементах, в США и Канаде производится фирмой
- 18. ТЭ с твердополимерным электролитом Электролит – твердая полимерная ионообменная мембрана упрощается герметизация элемента уменьшается коррозия возрастает
- 19. Недостатки платиновых катализаторов высокая стоимость дефицит природных запасов платины платиновые электроды резко снижают свою активность ("отравляются")
- 20. Биотопливный элемент Принцип – использование природных катализаторов Ферменты-гидрогеназы, ответственные за окисление и образование водорода, являются уникальными
- 21. Высокотемпературные ТЭ: ускорение реакций на электродах при значительном повышении температуры Тип 1 электролит - из расплава
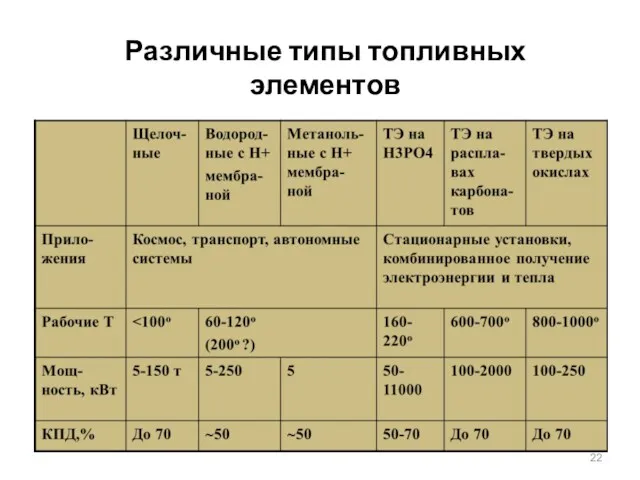
- 22. Различные типы топливных элементов
- 23. Щелочные топливные элементы
- 24. Водородные ТЭ с Н+ проводящей мембраной
- 25. Метанольные ТЭ с Н+ проводящей мембраной
- 26. ТЭ на фосфорной кислоте
- 27. ТЭ на расплавах карбонатов
- 28. ТЭ на твердых оксидах
- 29. Преимущества топливных элементов высокий коэффициент полезного действия экологическая чистота бесшумность широкий диапазон мощностей и применяемого топлива
- 31. Скачать презентацию






















 Химические аспекты метаболизма лекарственных препаратов
Химические аспекты метаболизма лекарственных препаратов Драгоценные камни
Драгоценные камни Щелочной металл натрий
Щелочной металл натрий Степень окисления – Условный заряд атомов химического элемента в соединении
Степень окисления – Условный заряд атомов химического элемента в соединении Методы осаждения. Аналитическая химия
Методы осаждения. Аналитическая химия Альдегіди. Номенклатура альдегідів
Альдегіди. Номенклатура альдегідів Припекание взаимно растворимых твердых тел
Припекание взаимно растворимых твердых тел БАЗ-ды алу. БАЗ өндірудегі шикізат базасы. 2 Лекция
БАЗ-ды алу. БАЗ өндірудегі шикізат базасы. 2 Лекция Общая геохимия. Атомная и молекулярная масса. Представление результатов аналитических исследований
Общая геохимия. Атомная и молекулярная масса. Представление результатов аналитических исследований Строение атома. 8 класс
Строение атома. 8 класс Автомобильные эксплуатационные материалы и экономия топливно-энергетических ресурсов. Автомобильные бензины
Автомобильные эксплуатационные материалы и экономия топливно-энергетических ресурсов. Автомобильные бензины Вуглеводи. Загальна характеристика вуглеводів, представники
Вуглеводи. Загальна характеристика вуглеводів, представники Азотная кислота и её соли
Азотная кислота и её соли Закон действующих масс и его применение в аналитической химии
Закон действующих масс и его применение в аналитической химии Валентність хімічних елементів
Валентність хімічних елементів Классы неорганических веществ
Классы неорганических веществ Изотопы, их свойства и применение
Изотопы, их свойства и применение Нуклеозиды. Нуклеиновые кислоты
Нуклеозиды. Нуклеиновые кислоты Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Липиды растений и их обмен
Липиды растений и их обмен Процессы и аппараты химических производств
Процессы и аппараты химических производств Полибутадиен
Полибутадиен Валентность химических элементов (8 класс)
Валентность химических элементов (8 класс) Геохимия литосферы
Геохимия литосферы Основания. Получение и химические свойства
Основания. Получение и химические свойства Базовое нефтехимическое сырье
Базовое нефтехимическое сырье Химическая связь
Химическая связь Природные источники углеводородов
Природные источники углеводородов