Слайд 2

Като Гульдберг Петер Вааге
Слайд 3

1867 г.
К.М. Гульдберг и П. Вааге
Скорость химической реакции прямо пропорциональна произведению
концентраций реагирующих веществ
Слайд 4
![Гомогенная реакция Vп = kп · [A]a · [B]b kп – константа скорости прямой реакции](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/169963/slide-3.jpg)
Гомогенная реакция
Vп = kп · [A]a · [B]b
kп – константа скорости
прямой реакции
Слайд 5
![Vо = kо · [C]c · [D]d kо – константа скорости обратной реакции](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/169963/slide-4.jpg)
Vо = kо · [C]c · [D]d
kо – константа скорости обратной
реакции
Слайд 6
![При установившемся химическом равновесии Vп = Vо kп · [A]a](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/169963/slide-5.jpg)
При установившемся химическом равновесии
Vп = Vо
kп · [A]a · [B]b =
kо · [C]c · [D]d
Слайд 7
![kо · [C]c · [D]d 1 = ——————— kп ·](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/169963/slide-6.jpg)
kо · [C]c · [D]d
1 = ———————
kп ·
[A]a · [B]b
kп [C]c · [D]d
Kр = —— = ——————
kо [A]a · [B]b
[C]c · [D]d
Kр = ——————
[A]a · [B]b
Слайд 8

При установившемся химическом равновесии произведение концентраций продуктов реакции, деленное на произведение
концентраций исходных веществ, есть величина постоянная (для данной реакции, при данной температуре), называемая константой химического равновесия
Слайд 9

Константа равновесия зависит от температуры и давления и не зависит от
концентрации реагирующих веществ
Kр > 1 – преобладает прямая реакция
Kр < 1 – преобладает обратная реакция
pK = - lg Kp
рKp < 0 – преобладает прямая реакция
рKp > 0 – преобладает обратная реакция
Слайд 10
![[C]c · [D]d KpP = ———— [A]a · [B]b [C]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/169963/slide-9.jpg)
[C]c · [D]d
KpP = ————
[A]a · [B]b
[C] > 99,99% [D] > 99,99%
[A] < 0,01% [B] < 0,01%
[C]c · [D]d 99,99 · 99,99
KpP = ———— = —————— = 108
[A]a · [B]b 0,01 · 0,01
Слайд 11

Равновесие в гомогенной системе. Термодинамическая и концентрационная (реальная) константы равновесия.
Связь
между ними.
Слайд 12

aCc · aDd
KpT = ————
aAa · aBb
KpT зависит от
температуры, давления и природы растворителя.
Слайд 13
![[C]c · [D]d KpP = ———— [A]a · [B]b KpP](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/169963/slide-12.jpg)
[C]c · [D]d
KpP = ————
[A]a · [B]b
KpP зависит от температуры,
давления, природы растворителя и ионной силы раствора (характеризует положение равновесия с учетом электростатических взаимодействий).
Слайд 14
![[C]c · [D]d KpP = ———— [A]a · [B]b aA](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/169963/slide-13.jpg)
[C]c · [D]d
KpP = ————
[A]a · [B]b
aA = fA ·
[A] ⇒ [A] = aA / fA
aB = fB · [B] ⇒ [B] = aB / fB
aC = fC · [C] ⇒ [C] = aC / fC
aD = fD · [D] ⇒ [D] = aD / fD
Слайд 15
![[C]c · [D]d aCc · aDd fAa · fBb KpP](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/169963/slide-14.jpg)
[C]c · [D]d aCc · aDd fAa · fBb
KpP = ————
= ———— · ————
[A]a · [B]b aAa · aBb fCc · fDd
[C]c · [D]d fAa · fBb
KpP = ———— = KpT · ————
[A]a · [B]b fCc · fDd
при I = 0 KpP = KpT
Слайд 16

α-коэффициент (молярная доля)
Слайд 17
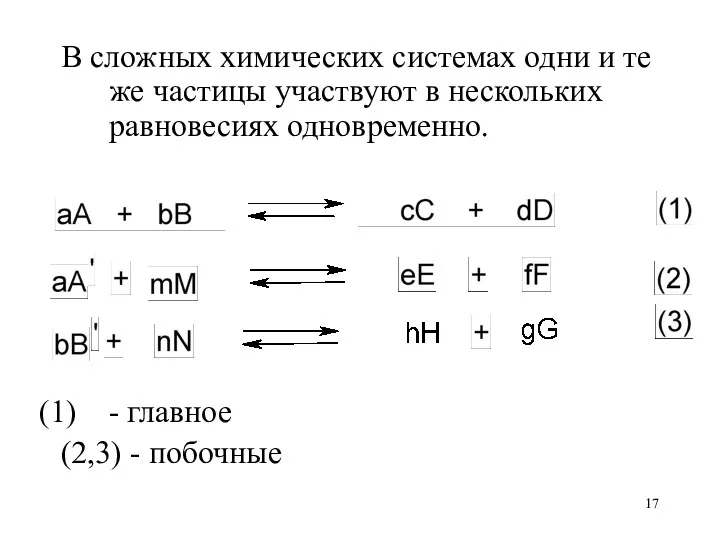
В сложных химических системах одни и те же частицы участвуют в
нескольких равновесиях одновременно.
- главное
(2,3) - побочные
Слайд 18

Характеристикой глубины протекания конкурирующих реакций служит
α-коэффициент или молярная доля –
отношение равновесной концентрации частиц, участвующих в основной реакции, к общей концентрации этих частиц.
Слайд 19
![CA = [A] + [A'] Аналогично: CB = [B] +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/169963/slide-18.jpg)
CA = [A] + [A']
Аналогично: CB = [B] +
[B']
CA – суммарная концентрация компонента А
[A] – кон-ция ч-цы А, участв. в главной реакции
[A'] – кон-ция ч-цы А, участв. в побоч. реакции
Слайд 20
![[A] [B] αA = —— ; αB = —— ;](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/169963/slide-19.jpg)
[A] [B]
αA = —— ; αB = —— ;
CA CB
[C] [D]
αC = —— ; αD = —— ;
CC CD
α = 0 — 1
При отсутствии конкурирующих реакций
CA = [A]; CB = [B];
Слайд 21

Например: Насыщенный водный раствор HgS в присутствии HCl
гетерогенное: HgS↓ =
Hg2+ + S2−
и гомогенные: Hg2+ + Cl− = HgCl+
Hg2+ + 2Cl− = HgCl2
Hg2+ + 3Cl− = HgCl3−
Hg2+ + 4Cl− = HgCl42−
S2− + H+ = HS−
S2− + 2H+ = H2S
Слайд 22
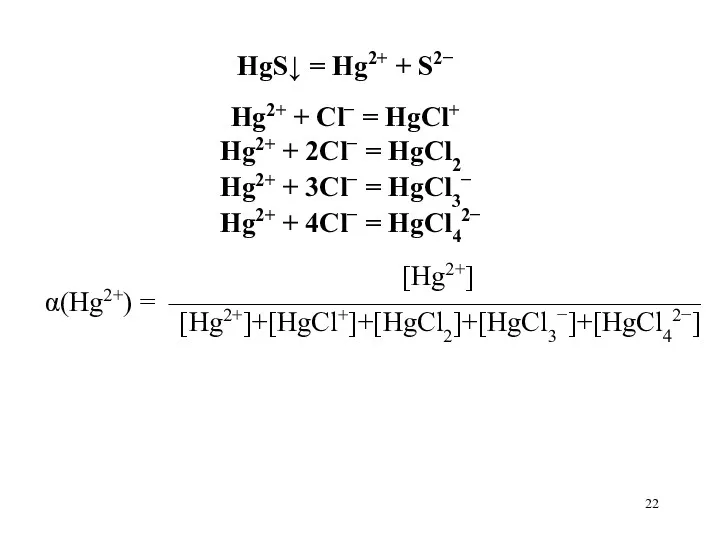
HgS↓ = Hg2+ + S2−
Hg2+ + Cl− = HgCl+
Hg2+
+ 2Cl− = HgCl2
Hg2+ + 3Cl− = HgCl3−
Hg2+ + 4Cl− = HgCl42−
[Hg2+]
α(Hg2+) = ——————————————————— [Hg2+]+[HgCl+]+[HgCl2]+[HgCl3−]+[HgCl42−]
Слайд 23
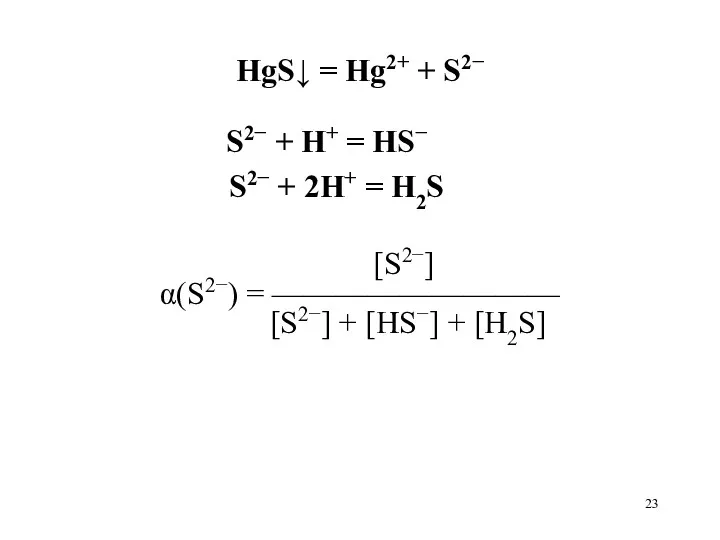
HgS↓ = Hg2+ + S2−
S2− + H+ = HS−
S2−
+ 2H+ = H2S
[S2−]
α(S2−) = —————————
[S2−] + [HS−] + [H2S]
Слайд 24

α-коэффициенты служат мерой степени химических взаимодействий в системе подобно тому, как
коэффициенты активности служат мерой степени электростатических взаимодействий.
Слайд 25

Условная константа равновесия гомогенной реакции.
Связь с термодинамической и концентрационной
константами
Слайд 26

CCc · CDd
KpY = —————
CAa · CBb
KpY зависит от
t, P, природы растворителя, ионной силы раствора и глубины протекания конкурирующих реакций
Слайд 27
![CCc · CDd αAa · αBb [C]c · [D]d KpY](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/169963/slide-26.jpg)
CCc · CDd αAa · αBb [C]c · [D]d
KpY
= ———— = ———— · ———— =
CAa · CBb αCc · αDd [A]a · [B]b
αAa · αBb · fAa · fBb aCc · aDd
= ——————— · ————
αCc · αDd · fCc · fDd aAa · aBb
αAa · αBb αAa · αBb · fAa · fBb
KpY = ———— · KpK = ——————— · KpT
αCc · αDd αCc · αDd · fCc · fDd
Слайд 28

1. В реальной системе при наличии химических и электростатических взаимодействий рассчитывается
условная KpY
2. Если влиянием конкурирующих реакций пренебречь, то все α=1, тогда KY = KP , т.е. необходим учет только электростатических взаимодействий
3. Если можно пренебречь электростатическими взаимодействиями (н-р, в очень разбавленных растворах), то все f=1 и KY = KP = KT
KK и KT отличаются на 1-2 порядка
KY и KK отличаются на 10 и более порядков
Слайд 29

Равновесие в гетерогенной системе
Слайд 30
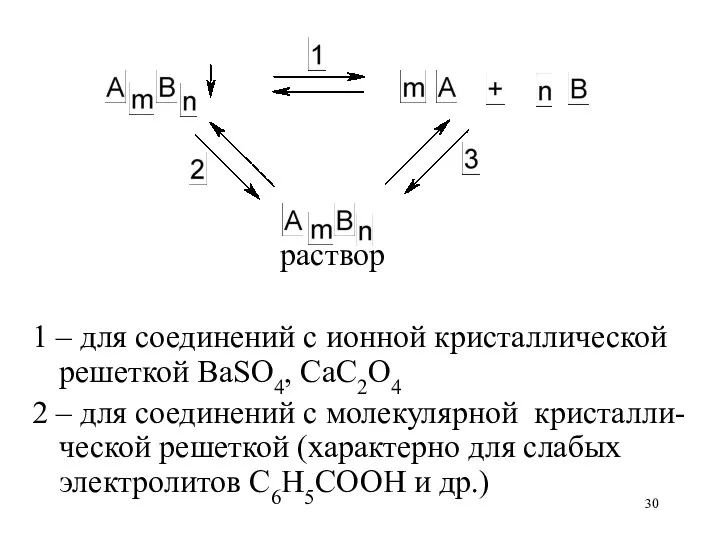
раствор
1 – для соединений с ионной кристаллической решеткой BaSO4, CaC2O4
2 –
для соединений с молекулярной кристалли-ческой решеткой (характерно для слабых электролитов C6H5COOH и др.)
Слайд 31
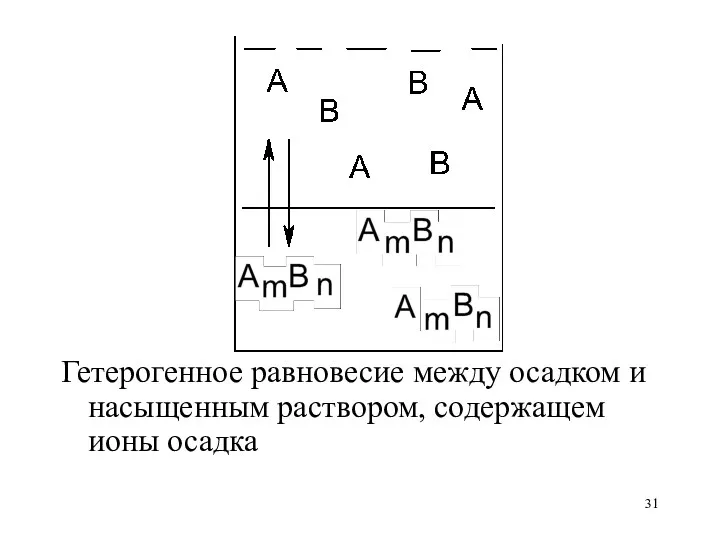
Гетерогенное равновесие между осадком и насыщенным раствором, содержащем ионы осадка
Слайд 32
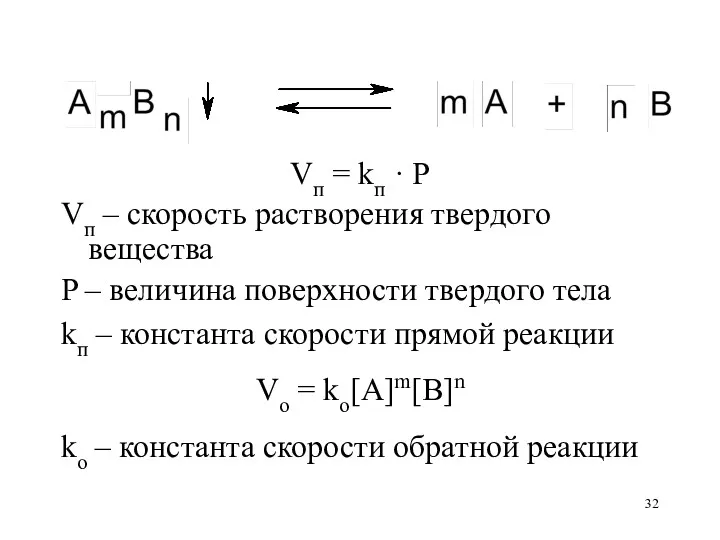
Vп = kп · P
Vп – скорость растворения твердого вещества
P –
величина поверхности твердого тела
kп – константа скорости прямой реакции
Vo = ko[A]m[B]n
ko – константа скорости обратной реакции
Слайд 33
![Vп = Vo P = 0 kп = ko[A]m[B]n kп](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/169963/slide-32.jpg)
Vп = Vo
P = 0
kп = ko[A]m[B]n
kп /ko = [A]m[B]n
kп /ko
= Kp = ПР
ПР – константа равновесия гетерогенной реакции
ПР = [A]m[B]n
Слайд 34

Термодинамическая, концентрационная и условная константы равновесия гетерогенной реакции
Слайд 35
![ПРT = aAm · aBn ПРK = [A]m · [B]n ПРY = CAm · CBn](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/169963/slide-34.jpg)
ПРT = aAm · aBn
ПРK = [A]m · [B]n
ПРY = CAm
· CBn


![Гомогенная реакция Vп = kп · [A]a · [B]b kп – константа скорости прямой реакции](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/169963/slide-3.jpg)
![Vо = kо · [C]c · [D]d kо – константа скорости обратной реакции](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/169963/slide-4.jpg)
![При установившемся химическом равновесии Vп = Vо kп · [A]a](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/169963/slide-5.jpg)
![kо · [C]c · [D]d 1 = ——————— kп ·](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/169963/slide-6.jpg)


![[C]c · [D]d KpP = ———— [A]a · [B]b [C]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/169963/slide-9.jpg)


![[C]c · [D]d KpP = ———— [A]a · [B]b KpP](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/169963/slide-12.jpg)
![[C]c · [D]d KpP = ———— [A]a · [B]b aA](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/169963/slide-13.jpg)
![[C]c · [D]d aCc · aDd fAa · fBb KpP](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/169963/slide-14.jpg)



![CA = [A] + [A'] Аналогично: CB = [B] +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/169963/slide-18.jpg)
![[A] [B] αA = —— ; αB = —— ;](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/169963/slide-19.jpg)

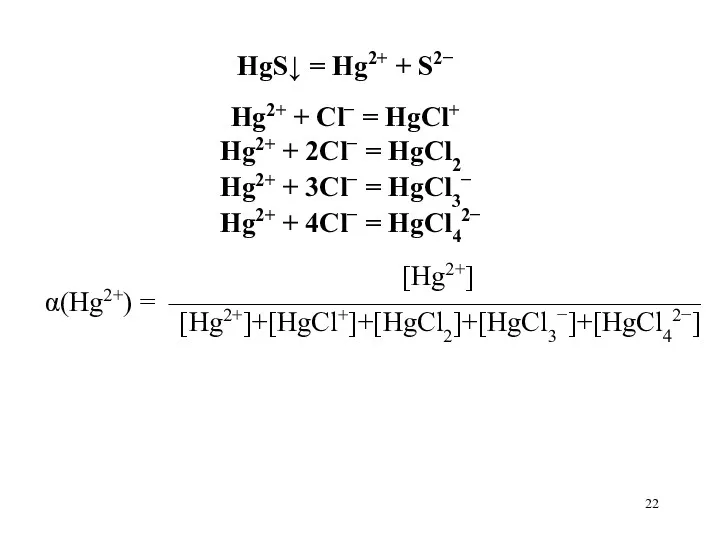
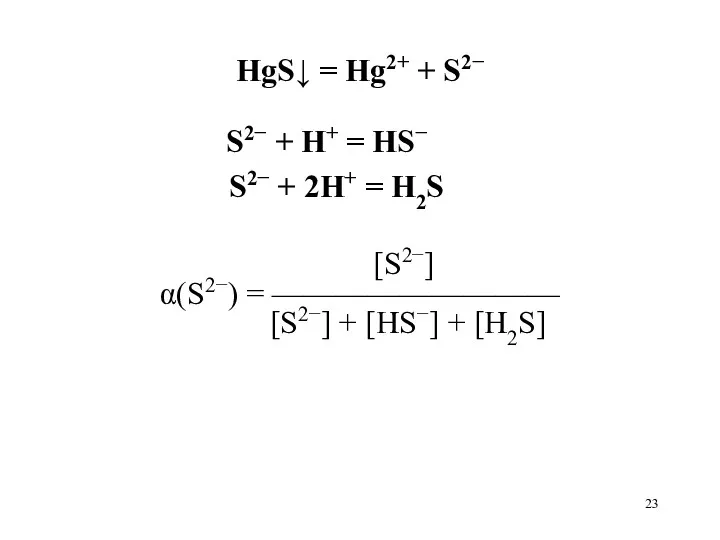



![CCc · CDd αAa · αBb [C]c · [D]d KpY](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/169963/slide-26.jpg)





![Vп = Vo P = 0 kп = ko[A]m[B]n kп](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/169963/slide-32.jpg)

![ПРT = aAm · aBn ПРK = [A]m · [B]n ПРY = CAm · CBn](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/169963/slide-34.jpg)
 Первичная структура белков и пептидов
Первичная структура белков и пептидов Основные классы неорганических соединений. Химические свойства неорганических веществ
Основные классы неорганических соединений. Химические свойства неорганических веществ Обзор уникальных свойств и областей применения магнитных жидкостей. Получение ферромагнитной жидкости
Обзор уникальных свойств и областей применения магнитных жидкостей. Получение ферромагнитной жидкости Алкалоїди. Поняття алкалоїди і їх функції
Алкалоїди. Поняття алкалоїди і їх функції Особая роль углерода в наномире
Особая роль углерода в наномире Полимеры
Полимеры Point defects. Line defects. Surface Imperfections
Point defects. Line defects. Surface Imperfections Каменный уголь. Переработка и применение угля
Каменный уголь. Переработка и применение угля Органикалық қосылыстардың химиялық құрылыс теориясы, органикалық қосылыстардың структурасы және қосылыстары
Органикалық қосылыстардың химиялық құрылыс теориясы, органикалық қосылыстардың структурасы және қосылыстары Жорсткість води і методи її усунення. 11 клас
Жорсткість води і методи її усунення. 11 клас Валентность и степень окисления. Химическая связь
Валентность и степень окисления. Химическая связь Алмазы. Бриллианты
Алмазы. Бриллианты Масова частка розчиненої речовини
Масова частка розчиненої речовини Основные и опасные свойства природного газа
Основные и опасные свойства природного газа Алены. Строение, изомерия, номенклатура
Алены. Строение, изомерия, номенклатура Теория электролитической диссоциации
Теория электролитической диссоциации Кремний и его соединения. Аллотропные модификации
Кремний и его соединения. Аллотропные модификации Фосфор
Фосфор Экспериментальные методы измерения изотерм адсорбции. Лекция 4
Экспериментальные методы измерения изотерм адсорбции. Лекция 4 Вода
Вода Магматические горные породы
Магматические горные породы Степень окисления в органической химии
Степень окисления в органической химии Металлы, их свойства и область применения
Металлы, их свойства и область применения Тема 11 -Дисперсные системы
Тема 11 -Дисперсные системы Установка пиролиза широкой фракции, легких углеводородов
Установка пиролиза широкой фракции, легких углеводородов Щелочные металлы
Щелочные металлы Получение хлортетрациклина
Получение хлортетрациклина Отримання нанопорошків. Класифікація. Фізичні методи отримання нанопорошків. . Хімічні методи отримання наноматеріалів
Отримання нанопорошків. Класифікація. Фізичні методи отримання нанопорошків. . Хімічні методи отримання наноматеріалів