Содержание
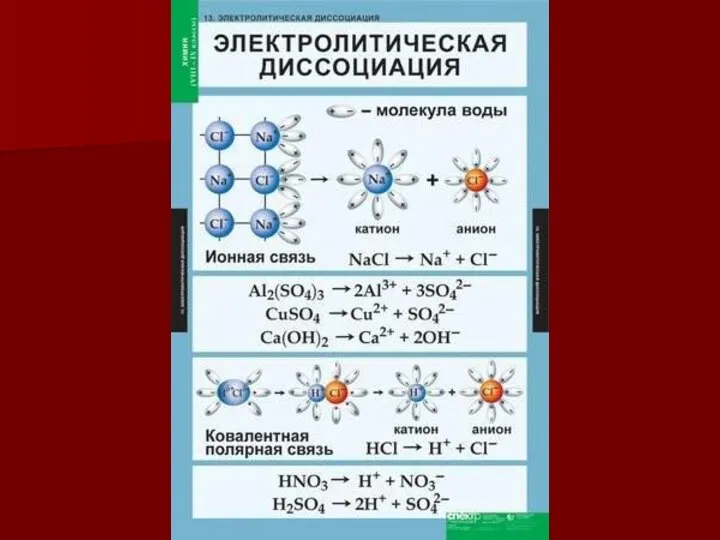
- 2. Терминология Фарадея Майкл Фарадей (1791 -1867) Ион Катион Анион Электролит Катод Анод Электролиз Диэлектрическая проницаемость 1833-1834
- 3. Предыстория открытия ТЭД Рудольф Клаузиус 1857 г. Р. Клаузиус создал теорию электропроводности. Ионы образуются в растворе
- 4. Теория растворов Менделеева Д.И. Менделеев (1834-1907) 1865-1887 г. цикл работ по изучению растворов Гидратная теория растворов
- 5. Теория электролитической диссоциации Сванте Аррениус (1859-1927) 1883 г. – защита диссертации «Химическая теория электролитов» Электролиты в
- 6. Сильные и слабые электролиты Зависит: от природы электролита от t ° от с Соли Щелочи HCl,
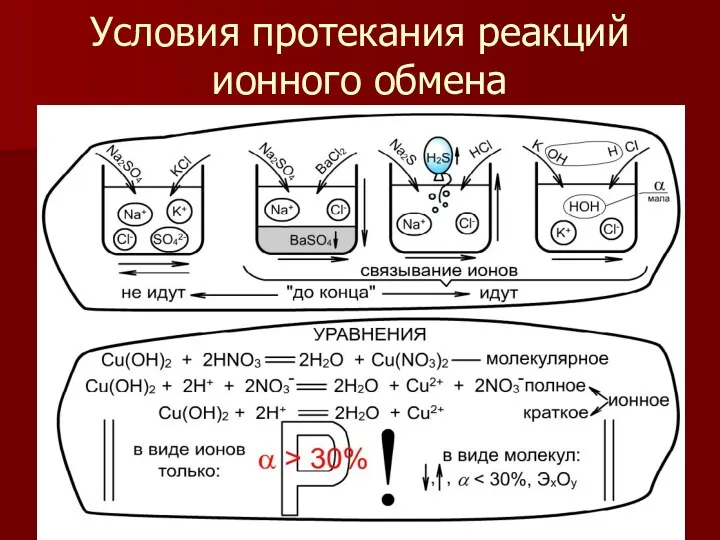
- 8. Условия протекания реакций ионного обмена
- 9. Проверь свои знания Заряженные частицы Ионы 2. Положительно заряженные ионы 2. Катионы 3. Отрицательно заряженные ионы
- 10. Генетическая связь между классами неорганических соединений с точки зрения ТЭД
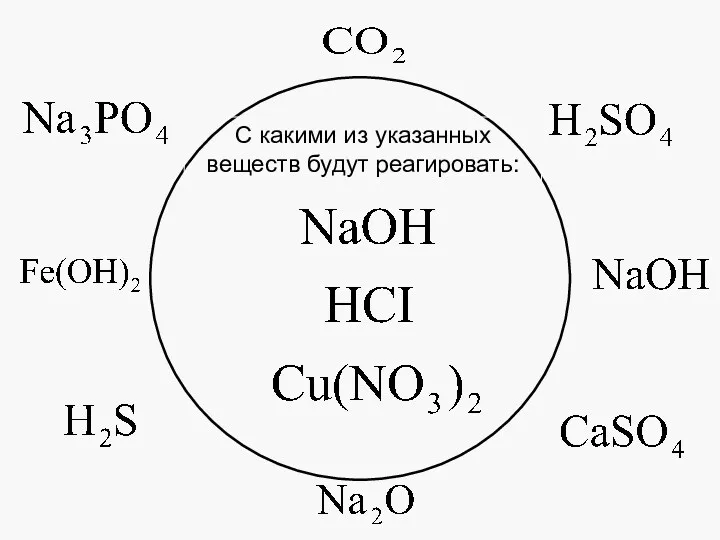
- 11. С какими из указанных веществ будут реагировать:
- 12. Практическое задание: условия протекания реакций ионного обмена
- 13. Правила техники безопасности (а) тушить спиртовку только колпачком; (б) запрещается зажигать одну спиртовку от другой, передавать
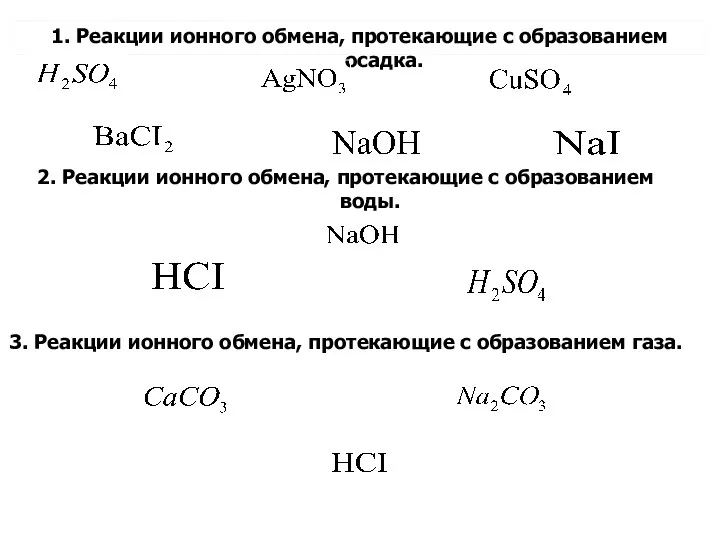
- 14. 1. Реакции ионного обмена, протекающие с образованием осадка. 2. Реакции ионного обмена, протекающие с образованием воды.
- 15. Реакции ионного обмена, протекающие c образованием малорастворимого вещества (выпадение осадка)
- 16. ДО ПОСЛЕ
- 17. Реакции ионного обмена протекающие, с образованием малодиссоциированного вещества (воды)
- 18. ДО ПОСЛЕ
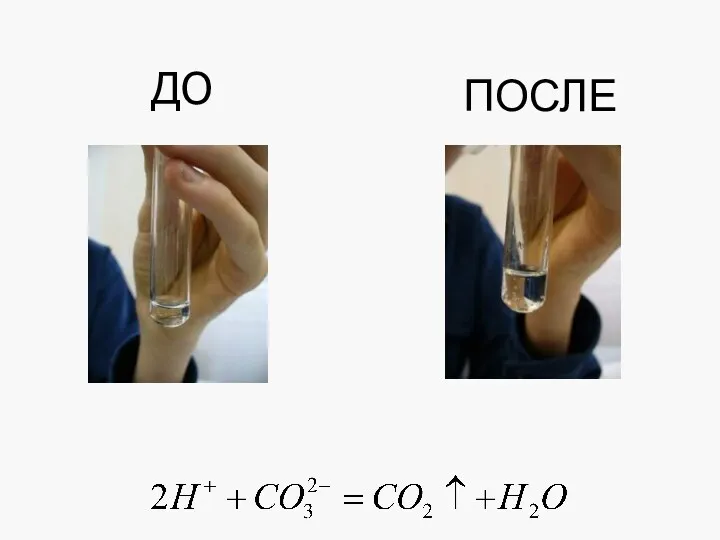
- 19. Реакции ионного обмена, протекающие с образованием газообразного вещества
- 20. ДО ПОСЛЕ
- 22. Скачать презентацию











 Кремний и его соединения для 11 класса
Кремний и его соединения для 11 класса Волокнистое сырьё. Технологические и эксплуатационные свойства
Волокнистое сырьё. Технологические и эксплуатационные свойства Поляризация электродов
Поляризация электродов Этилен. Углеводороды ряда этилена
Этилен. Углеводороды ряда этилена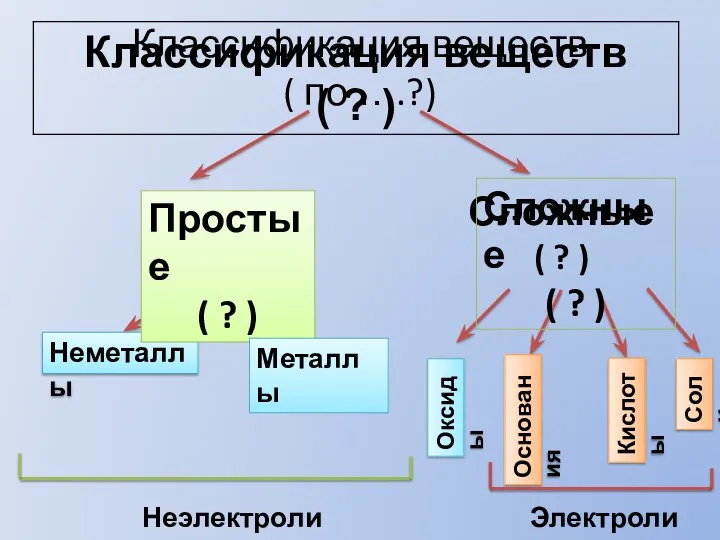 Классификация веществ
Классификация веществ Введение в коллоидную химию. Основные понятия и закономерности
Введение в коллоидную химию. Основные понятия и закономерности Щавелевая кислота
Щавелевая кислота Електронні і графічні електронні формули атомів s-, р-, d- елементів. Принцип мінімальної енергії
Електронні і графічні електронні формули атомів s-, р-, d- елементів. Принцип мінімальної енергії Щелочные металлы. (9 класс)
Щелочные металлы. (9 класс) Титан және оның қорытпалары. Титаннан жасалған құралдар
Титан және оның қорытпалары. Титаннан жасалған құралдар Хозяйственный механизм НГХК
Хозяйственный механизм НГХК Химия элементов VIIA группы
Химия элементов VIIA группы Типы химических реакций. Реакции обмена
Типы химических реакций. Реакции обмена Правила роботи на уроці
Правила роботи на уроці Аммиак (9 класс)
Аммиак (9 класс) Енергетичний баланс процесу горіння
Енергетичний баланс процесу горіння Аминокислоты
Аминокислоты Chemical reactions and heat. (Chapter 1)
Chemical reactions and heat. (Chapter 1) Биологически важные гетероциклы
Биологически важные гетероциклы Электрофизические свойства GaAs, зонная структура, полупроводящий и полуизолирующий GaAs, способы создания p-n перехода
Электрофизические свойства GaAs, зонная структура, полупроводящий и полуизолирующий GaAs, способы создания p-n перехода Тепловой эффект химических реакций
Тепловой эффект химических реакций Совйства спиртов. 10 класс
Совйства спиртов. 10 класс Модифицированные природные полимеры. Их свойства
Модифицированные природные полимеры. Их свойства Кондуктометрия и кондуктометрическое титрование
Кондуктометрия и кондуктометрическое титрование Физические свойства минералов
Физические свойства минералов Концентраційні межі поширення полум'я
Концентраційні межі поширення полум'я Матеріали на основі аерогелів: класифікація, підходи до синтезу та сфери застосування
Матеріали на основі аерогелів: класифікація, підходи до синтезу та сфери застосування Щелочноземельные металлы. Металлы II А подгруппы
Щелочноземельные металлы. Металлы II А подгруппы