Содержание
- 2. Мы – умные, мы – дружные, Мы – внимательные, мы – старательные, Мы отлично учимся, всё
- 3. 1.Вставьте пропущенное слово: Реакции, в результате которых сложное вещество разлагается на несколько других, более простых веществ
- 4. 2.Соотнесите типы химических реакций и схемы реакций: Напишите уравнения реакций и расставьте коэффициенты.
- 5. 3.Запишите уравнения следующих реакций Хлорид меди(II) +алюминий→хлорид алюминия +медь Кальций + кислород→ оксид кальция Гидроксид алюминия
- 6. 1) 2HgO = 2Hg + O2 2) CaCO3 = CaO + CO2 3) CuSO4 + Fe
- 7. Не спеши хватать пробирку, А инструкцию читай. Убедись, что ты все понял, Вот тогда и начинай.
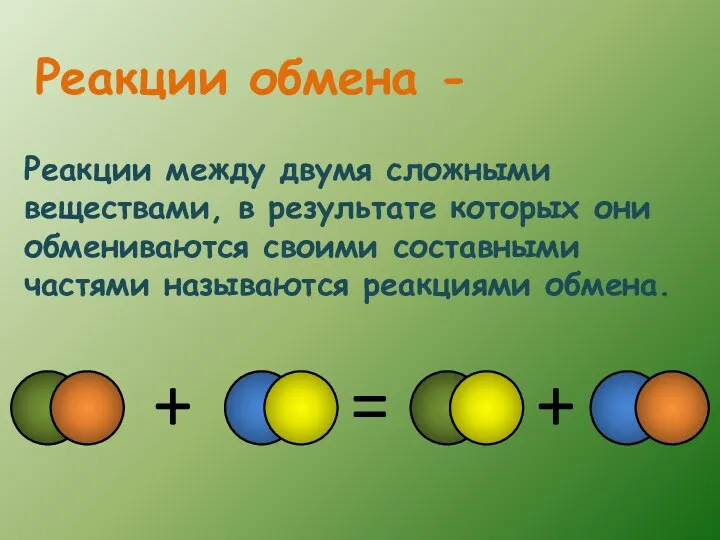
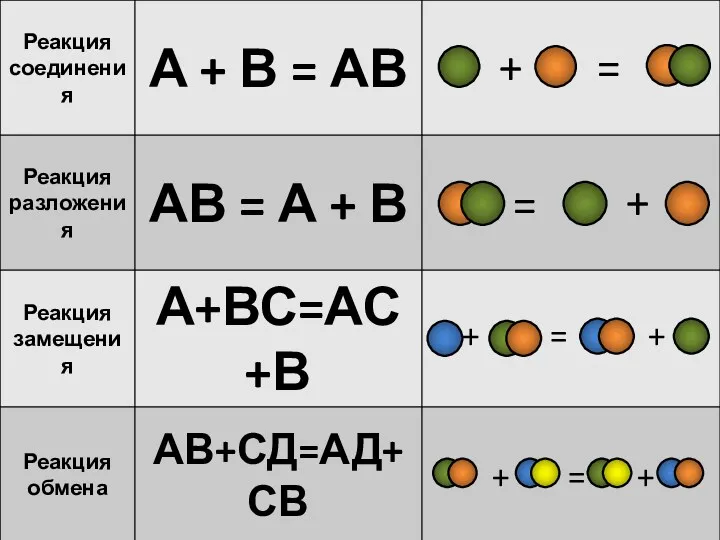
- 8. Реакции между двумя сложными веществами, в результате которых они обмениваются своими составными частями называются реакциями обмена.
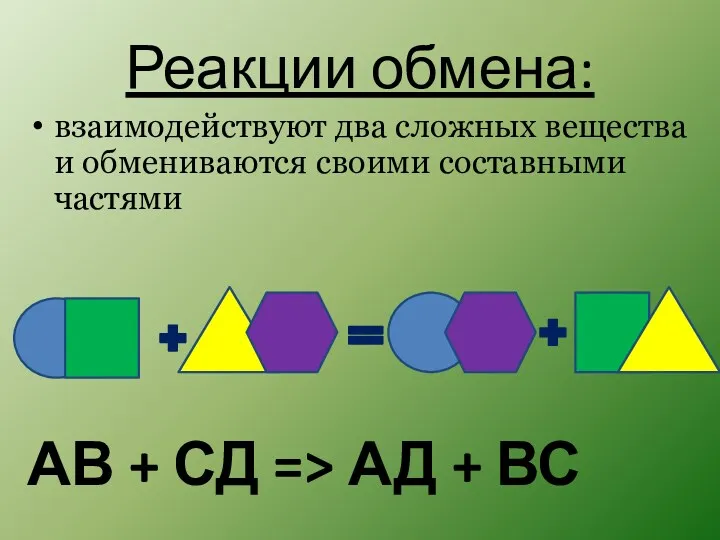
- 9. Реакции обмена: АВ + СД => АД + ВС взаимодействуют два сложных вещества и обмениваются своими
- 10. CuO + HCl – CuCl2 + H2O MgO + H2SO4 – MgSO4 + H2O AgNO3 +
- 11. Реакции обмена в быту Разрыхлители теста. Определение качества воды. Устранение жесткости воды. Определение качества продуктов питания.
- 12. Физкультминутка Если выделится газ- Это раз; И получится вода - Это два; А еще - нерастворимый
- 13. По числу вступивших в реакцию веществ
- 15. Игра «Что лишнее?» 1. 2Н2 + О2 = 2Н2О 3. NaOH + HCl = NaCl +
- 16. Задание «Крестики-нолики». Кто быстрее найдёт выигрышный путь, состоящий из уравнений реакций замещения
- 18. Скачать презентацию




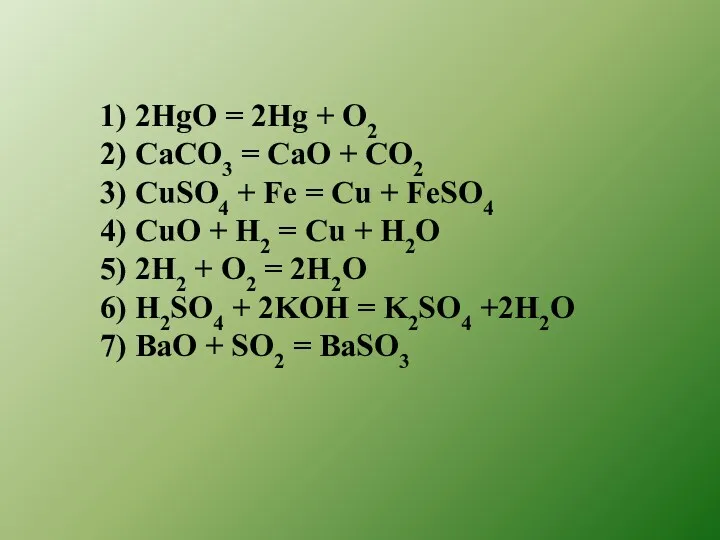

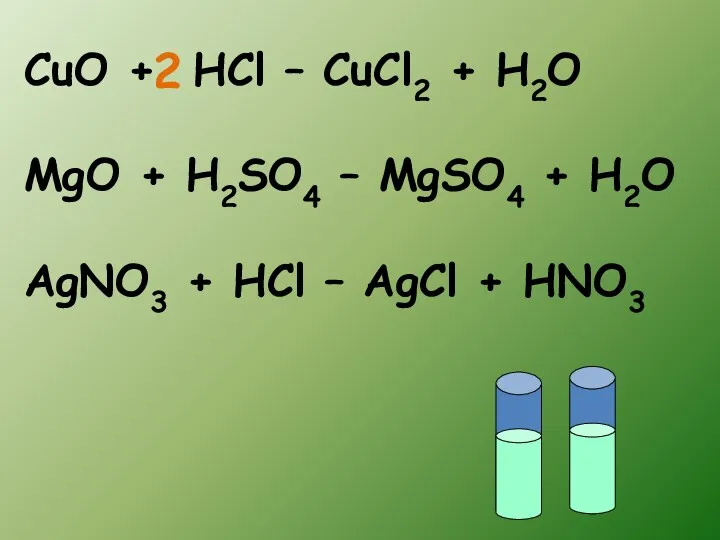





 Спирты. Классификация спиртов
Спирты. Классификация спиртов Серная кислота. 9 класс
Серная кислота. 9 класс Электролитическая диссоциация химических элементов
Электролитическая диссоциация химических элементов Воздух и его состав. Урок химии. 8 класс
Воздух и его состав. Урок химии. 8 класс Распространенные названия некоторых неорганических веществ
Распространенные названия некоторых неорганических веществ Химические реакторы
Химические реакторы Жидкие кристаллы
Жидкие кристаллы Электролиты и неэлектролиты. Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей
Электролиты и неэлектролиты. Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей Формы минералов и их агрегатов
Формы минералов и их агрегатов Сурьма. Положение в периодической системе химических элементов Менделеева
Сурьма. Положение в периодической системе химических элементов Менделеева Валентные возможности атомов химических элементов
Валентные возможности атомов химических элементов Хімічні сполуки у побуті
Хімічні сполуки у побуті Synthesis of Paclitaxel
Synthesis of Paclitaxel Дизельное топливо. Требования, предъявляемые к дизельным топливам
Дизельное топливо. Требования, предъявляемые к дизельным топливам Кислоты, их классификация и свойства в свете ТЭД
Кислоты, их классификация и свойства в свете ТЭД Растворение как физико-химический процесс
Растворение как физико-химический процесс Типы химических реакций
Типы химических реакций Алкадиены (диены, диеновые углеводороды)
Алкадиены (диены, диеновые углеводороды) Строение и свойства металлов. Физические и механические свойства металлов
Строение и свойства металлов. Физические и механические свойства металлов Эластомеры (резины)
Эластомеры (резины) Theories of acids and bases. Ionic equilibria in electrolyte solutions. Buffer solutions (topic 3.4)
Theories of acids and bases. Ionic equilibria in electrolyte solutions. Buffer solutions (topic 3.4) Буферные растворы. Граф структуры. Теория электрической диссоциации. Химическое равновесие
Буферные растворы. Граф структуры. Теория электрической диссоциации. Химическое равновесие ХИМИЯ В СЕЛЬСКОМ ХОЗЯЙСТВЕ
ХИМИЯ В СЕЛЬСКОМ ХОЗЯЙСТВЕ Хімічні явища в побуті. 7 клас
Хімічні явища в побуті. 7 клас Сера и её соединения
Сера и её соединения Массовая доля вещества в растворе. Урок химии. 8 класс
Массовая доля вещества в растворе. Урок химии. 8 класс Водород
Водород