Слайд 2

Химический символ – H
Относительная атомная масса Ar (H) = 1, 008
Химическая
формула простого вещества – H2
Относительная молекулярная масса
Mr (H2) = 2, 016
В соединениях водород одновалентен
Слайд 3

История открытия
Водород
(Hudrogenium)
был открыт в первой половине XVI века немецким
врачом и естествоиспытателем Парацельсом.
Слайд 4

В 1766 г.
Генри Кавендиш (Англия)
установил свойства водорода
и указал
его отличия от других газов
Слайд 5

Французский химик Антуан Лавуазье
доказал и обратное: получил «горючий газ» из
воды. Он дал новому газу и другое имя – водород (рождающий воду)
Слайд 6

Водород
является самым распространенным химическим элементом во Вселенной, он является главной
составной частью Солнца, а также многих звезд.
Слайд 7

Распространенность в природе
Слайд 8

Водород
занимает первое место в периодической системе химических элементов
Д.И. Менделеева,
имеет простейшее строение атома: ядро атома окружено электронным облаком
Слайд 9

Получение водорода в промышленности
Нагревание:
CH4 2H2 + C
2. Разложение
воды под действием электрического тока:
2H2O 2H2 + O2
3. Пропускают водяные пары над раскаленным углем:
C + H2O CO + H2
Слайд 10

Получение водорода в лаборатории
1.Взаимодействие металлов с кислотами:
Zn +2HCl → ZnCl2 +H2↑
2.Взаимодействие активных
металлов с водой:
2Na + 2HOH 2NaOH + H2
3.Разложение воды под действием постоянного электрического тока:
2H2O 2H2 + O2
Слайд 11
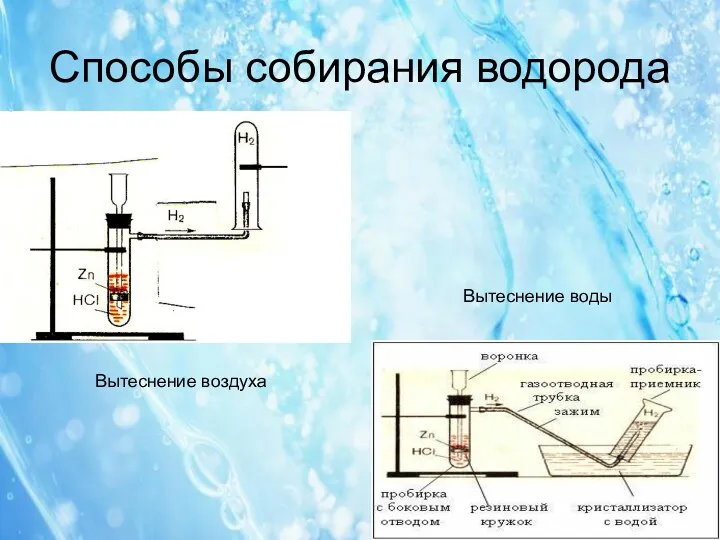
Способы собирания водорода
Вытеснение воды
Вытеснение воздуха
Слайд 12

Физические свойства
1.Бесцветный газ
2.Без запаха
3.Без вкуса
4.Легче воздуха в 14,5 раза
5.Плохо растворим
в воде











 Газы, применяемые при сварке
Газы, применяемые при сварке Циклоалканы
Циклоалканы Химические реакции
Химические реакции Роль химии в жизни человека
Роль химии в жизни человека Исследование снежного покрова
Исследование снежного покрова Фазовые равновесия в растворах
Фазовые равновесия в растворах Благородные газы
Благородные газы Получение порошков автоклавным осаждением
Получение порошков автоклавным осаждением Электрохимические процессы
Электрохимические процессы Монокристалл. Резка монокристаллического слитка на полупроводниковые пластины
Монокристалл. Резка монокристаллического слитка на полупроводниковые пластины Драгоценные камни
Драгоценные камни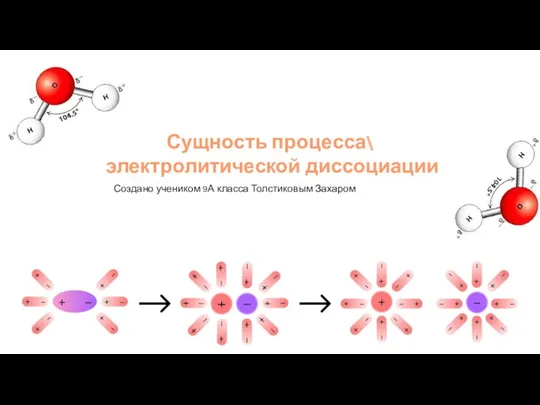 Сущность процесса электролитической диссоциации
Сущность процесса электролитической диссоциации Виды коррозии
Виды коррозии Оксиды. Формулы оксидов ( 8 класс)
Оксиды. Формулы оксидов ( 8 класс) Полусинтетическое масло
Полусинтетическое масло Реконструкция установки получения элементарной серы
Реконструкция установки получения элементарной серы Медь и её сплавы
Медь и её сплавы Механика полимеров
Механика полимеров Влияние фтора на организм человека
Влияние фтора на организм человека Пластмассы в автомобилестроении
Пластмассы в автомобилестроении Серная кислота и её свойства
Серная кислота и её свойства Массообменные процессы
Массообменные процессы Объёмная доля компонента смеси
Объёмная доля компонента смеси Марганец и хром
Марганец и хром Физико-химические процессы переработки нефти. Термические процессы
Физико-химические процессы переработки нефти. Термические процессы Виды присадок к моторным топливам
Виды присадок к моторным топливам Классификация и номенклатура неорганических веществ
Классификация и номенклатура неорганических веществ Галогены. Нахождение в природе
Галогены. Нахождение в природе