Содержание
- 2. Фтор F Хлор Cl Бром Br Иод I Астат At ( от греч. «halos (соль) и
- 3. Фтор был открыт в 1866г.французским химиком Анри Муассаном (Нобелевская премия) фторос- разрушающий (греч.) Бром был открыт
- 4. Нахождение в природе Фтор. содержание фтора в земной коре довольно велико и составляет 0,095% по массе
- 5. Нахождение в природе. Хлор-Cl2 каменная соль- NaCl
- 6. Нахождение в природе Бром-Br2 в аналогичных соединениях, вместе с хлором
- 7. Нахождение в природе Иод-J2 морская вода , водоросли, буровые воды
- 8. элементы главной подгруппы 7 группы ПСХЭ Название Схема атома r атома ЭО Фтор-F… +9 )2 )7
- 9. Схема строения атома фтора 9F 1s²2s²2p5 2s 1s 2p
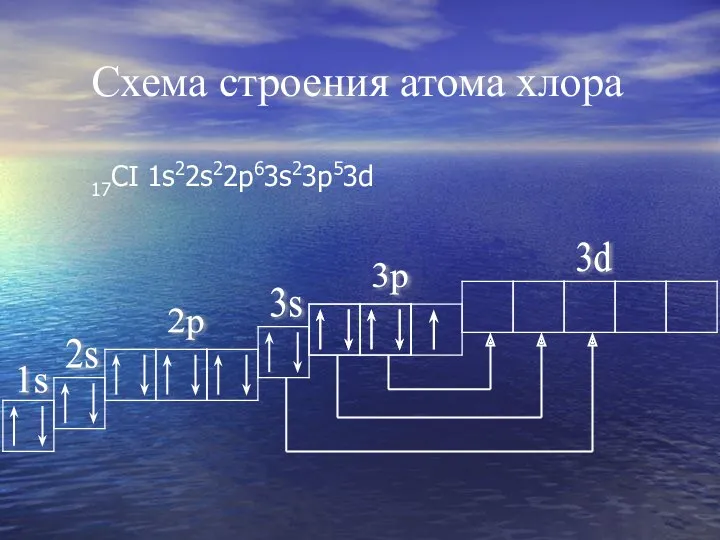
- 10. Схема строения атома хлора 17CI 1s22s22p63s23p53d 1s 2s 2p 3p 3s 3d
- 11. Фтор-F -1 Хлор-Cl -1, +1,+3,+5,+7 Бром-Br -1,+1,+3,+5,+7 Иод-J -1,+1,+3,+5,+7 Возможные степени окисления
- 12. Молекулы всех галогенов состоят из двух атомов F2 Cl2 Br2 J2. Связь в молекулах ковалентная неполярная
- 13. Физические свойства галогенов а) C увеличением атомной массы уменьшается неметаллический характер элементов. б) С увеличением атомной
- 14. Ядовиты ! ФТОР – ГАЗ(Н.У.) СВЕТЛО-ЖЁЛТЫЙ Резкий раздражающий запах Бром- Жидкость(н.у) Тёмно-бурый Запах резкий зловонный Хлор-
- 15. Cl2 Br2 J2 - хорошо растворяются в воде, кроме F2, который разлагает воду F2+H2O = HF
- 16. Галогены сильнейшие окислители!!! Окислительные способности усиливаются в ряду: J Br Cl F Фтор самый сильный окислитель
- 17. Химические свойства мы будем рассматривать на примере хлора. Хлор-Cl2 I.Окислительные свойства: 1.взаимодействие с металлами 2Fe +3Cl2=2FeCl3
- 18. Галогены, стоящие в подгруппе выше, вытесняют нижестоящие из галогенопроизводных кислот и их солей ! Из кислот:
- 19. Химические свойства галогенов Бром- Горение алюминия в броме.
- 20. Химические свойства галогенов Йод: сублимация йода. Реакция магния с йодом.
- 21. 2.Хлор восстановительные свойства проявляет только в реакциях с участием веществ, содержащих кислород 4HCl+O2=2H2O+2Cl2 Вывод: Окислительные свойства
- 22. Получение: Промышленный способ: все галогены можно получить электролизом расплавов или растворов их солей. элетро .ток 2NaCl
- 23. Лабораторный способ получения существуют различные способы получения галогенов в лаборатории MnO2+4HCl = MnCl2+Cl2+2H2O или 2KMnO4+16HCl=2MnCl2+5Cl2+2KCl+8H2O
- 25. Скачать презентацию





















 Металлы, их свойства и область применения
Металлы, их свойства и область применения Галогены - химические элементы 17-й группы периодической таблицы химических элементов Д.И. Менделеева
Галогены - химические элементы 17-й группы периодической таблицы химических элементов Д.И. Менделеева Тяжелые металлы
Тяжелые металлы Гидрокси(окси) кислоты
Гидрокси(окси) кислоты Значение пищи и ее состав
Значение пищи и ее состав Коррозия металлов
Коррозия металлов Изучение процесса коррозии железа (домашний эксперимент)
Изучение процесса коррозии железа (домашний эксперимент) Борьба с биологической коррозией
Борьба с биологической коррозией Реакции ионного обмена
Реакции ионного обмена Спирты
Спирты Газовые смеси
Газовые смеси Химический элемент, минерал, горная порода. (Лекция 6)
Химический элемент, минерал, горная порода. (Лекция 6) Титриметрический анализ. Кривые титрования
Титриметрический анализ. Кривые титрования Адсорбция
Адсорбция Ендотермічні реакції на службі людини
Ендотермічні реакції на службі людини Поверхностные явления. Адсорбция
Поверхностные явления. Адсорбция Химические реакции или химические явления
Химические реакции или химические явления Спирты. Понятия о предельных одноатомных спиртах. Химические свойства этанола и его применение
Спирты. Понятия о предельных одноатомных спиртах. Химические свойства этанола и его применение Хром, марганец
Хром, марганец Химическая кинетика и катализ
Химическая кинетика и катализ Свойства фосфора
Свойства фосфора Общие сведения о полезных ископаемых. (Лекция 2)
Общие сведения о полезных ископаемых. (Лекция 2) Тұндыру әдістері
Тұндыру әдістері Термодинамика химических процессов
Термодинамика химических процессов Чистые вещества и смеси. Химия. 8 кл
Чистые вещества и смеси. Химия. 8 кл Обед под микроскопом. Минеральные вещества
Обед под микроскопом. Минеральные вещества Типы химических реакций на примере свойств воды
Типы химических реакций на примере свойств воды Реакции солей в растворе. Гидролиз солей. Водородный показатель рН
Реакции солей в растворе. Гидролиз солей. Водородный показатель рН