Содержание
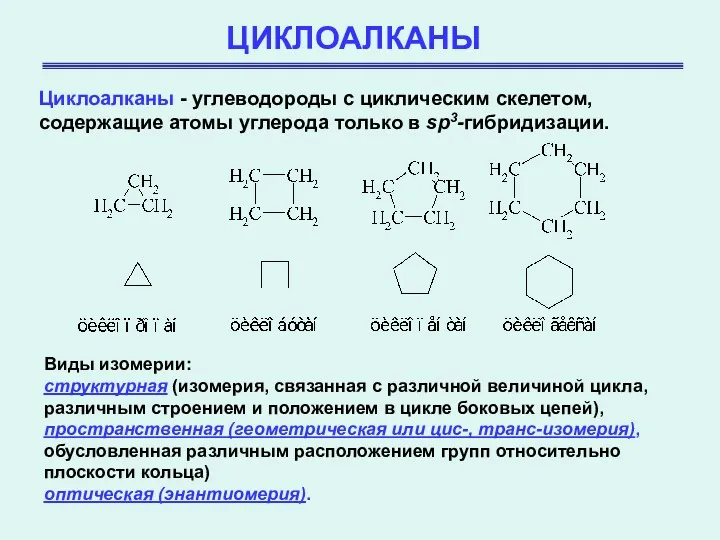
- 2. ЦИКЛОАЛКАНЫ Циклоалканы - углеводороды с циклическим скелетом, содержащие атомы углерода только в sp3-гибридизации. Виды изомерии: структурная
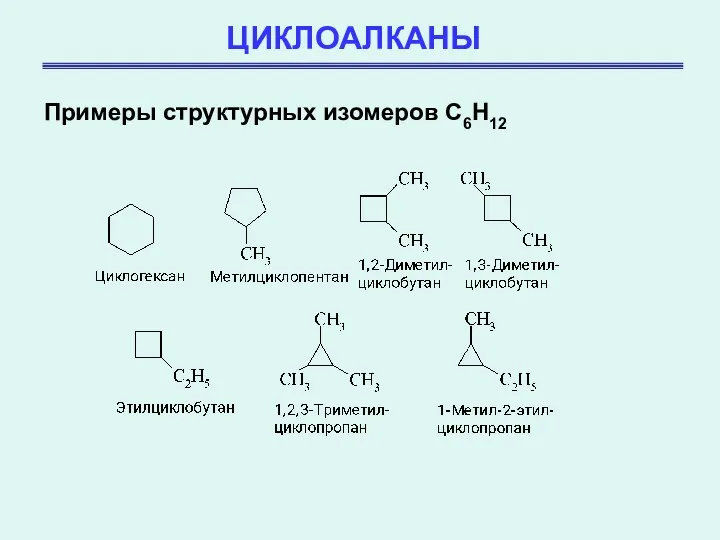
- 3. ЦИКЛОАЛКАНЫ Примеры структурных изомеров C6H12
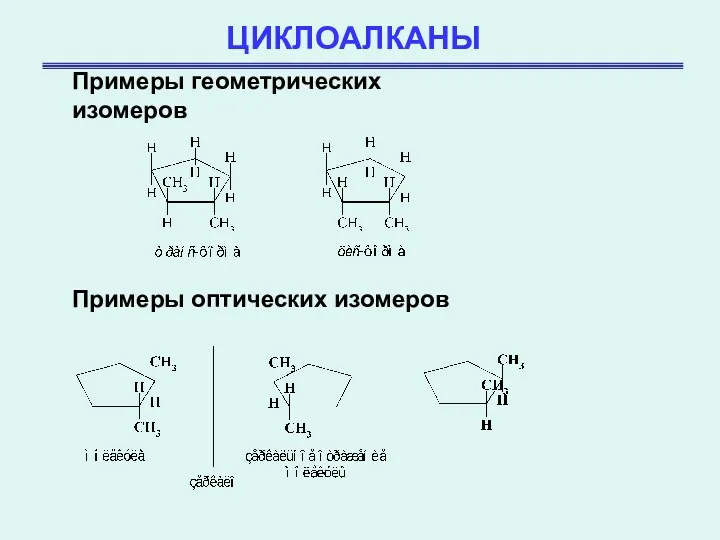
- 4. ЦИКЛОАЛКАНЫ Примеры геометрических изомеров Примеры оптических изомеров
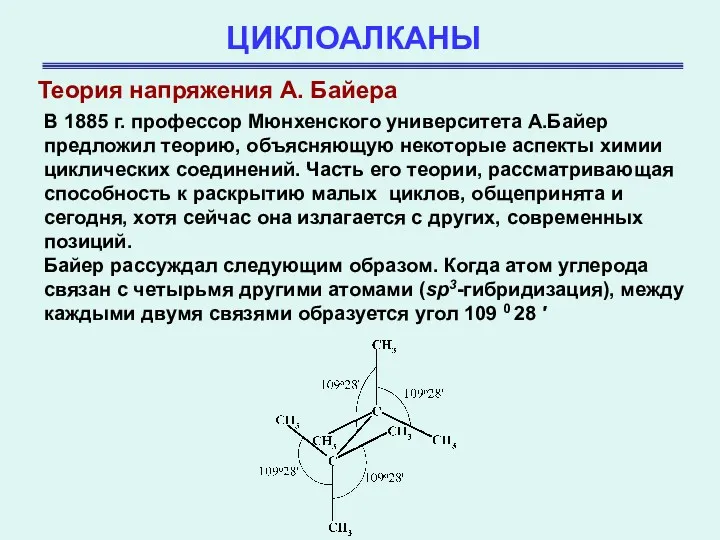
- 5. ЦИКЛОАЛКАНЫ Теория напряжения А. Байера В 1885 г. профессор Мюнхенского университета А.Байер предложил теорию, объясняющую некоторые
- 6. ЦИКЛОАЛКАНЫ Иоганн Фридрих Вильгельм Адольф фон Байер 1835 — 1917 немецкий химик-органик, лауреат Нобелевской премии по
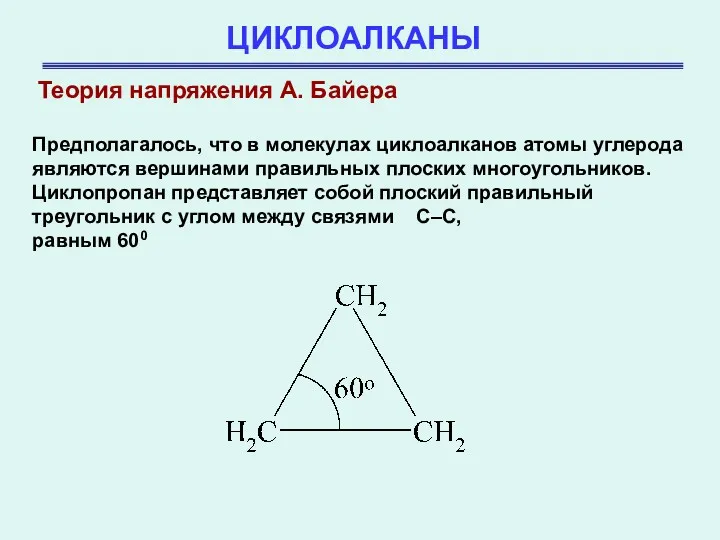
- 7. ЦИКЛОАЛКАНЫ Теория напряжения А. Байера Предполагалось, что в молекулах циклоалканов атомы углерода являются вершинами правильных плоских
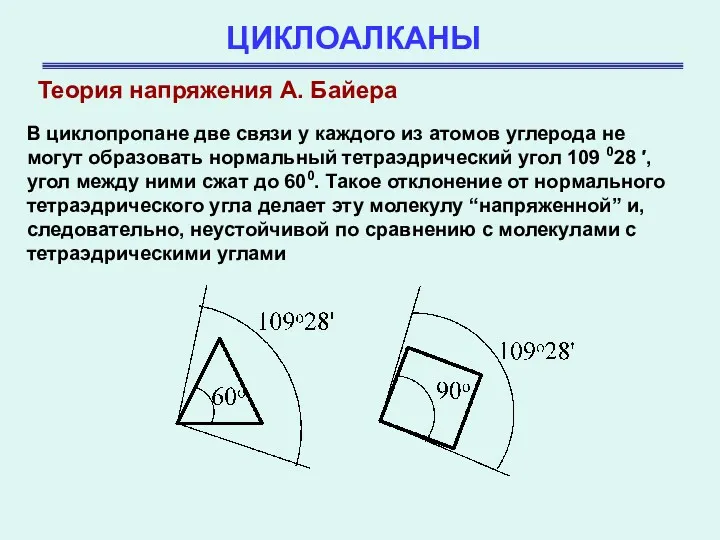
- 8. ЦИКЛОАЛКАНЫ Теория напряжения А. Байера В циклопропане две связи у каждого из атомов углерода не могут
- 9. ЦИКЛОАЛКАНЫ Теория напряжения А. Байера Циклоропан вступает в реакции с раскрытием кольца, поскольку при этом снимается
- 10. ЦИКЛОАЛКАНЫ Теория напряжения А. Байера Поскольку искажение углов наиболее значительно в циклопропане, то он является более
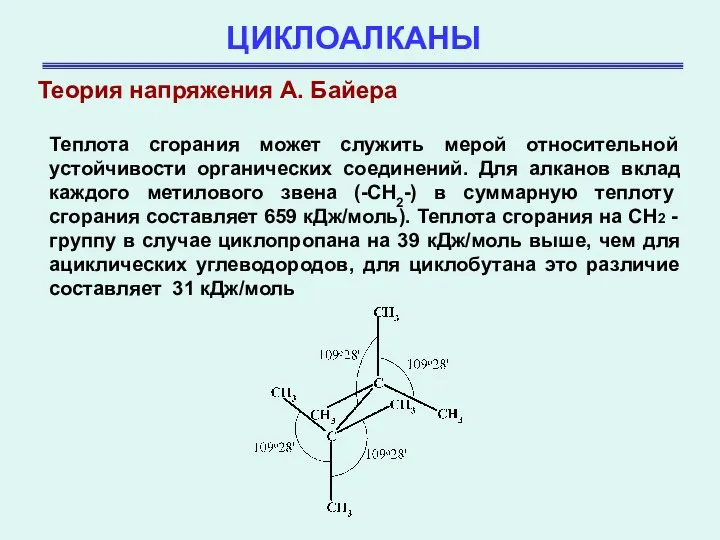
- 11. ЦИКЛОАЛКАНЫ Теплота сгорания может служить мерой относительной устойчивости органических соединений. Для алканов вклад каждого метилового звена
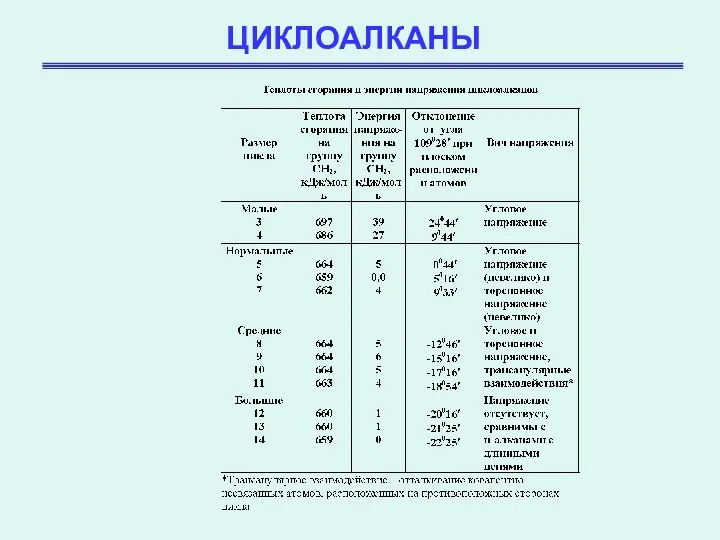
- 12. ЦИКЛОАЛКАНЫ
- 13. ЦИКЛОАЛКАНЫ Что же неверно в теории Байера? Только одно: Байер считал, что кольцо является плоским, но
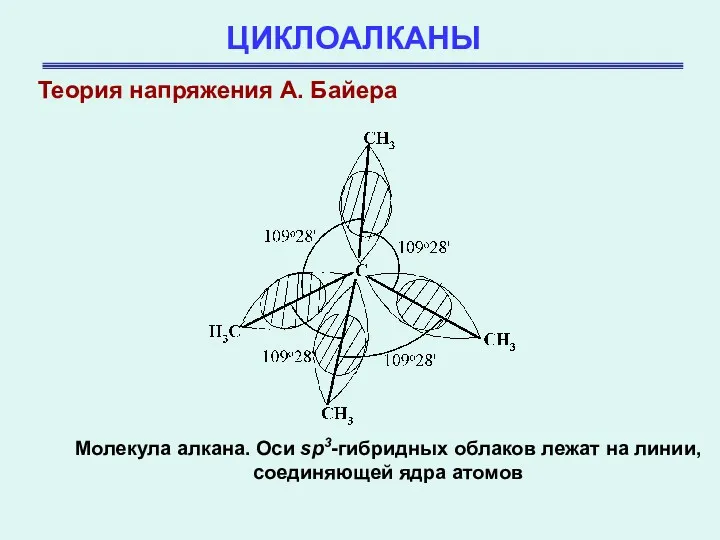
- 14. ЦИКЛОАЛКАНЫ Молекула алкана. Оси sp3-гибридных облаков лежат на линии, соединяющей ядра атомов Теория напряжения А. Байера
- 15. ЦИКЛОАЛКАНЫ С позиций современной теории следует, что на устойчивость конформации влияют следующие факторы: Отклонение от нормального
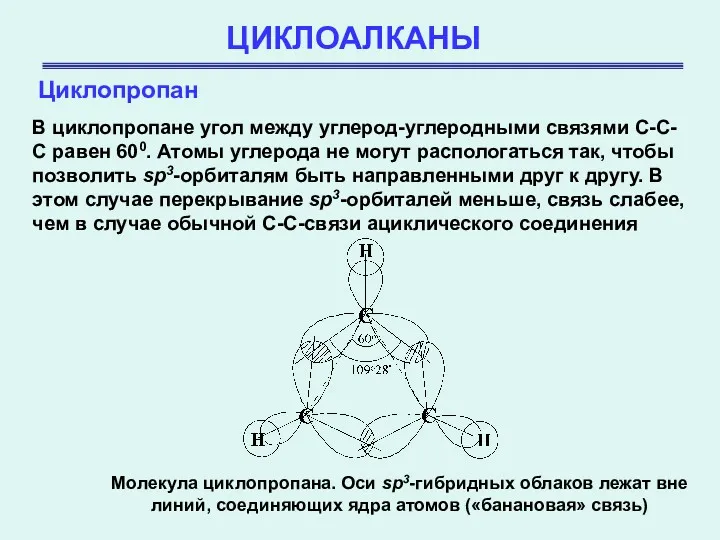
- 16. ЦИКЛОАЛКАНЫ Циклопропан В циклопропане угол между углерод-углеродными связями С-С-С равен 600. Атомы углерода не могут распологаться
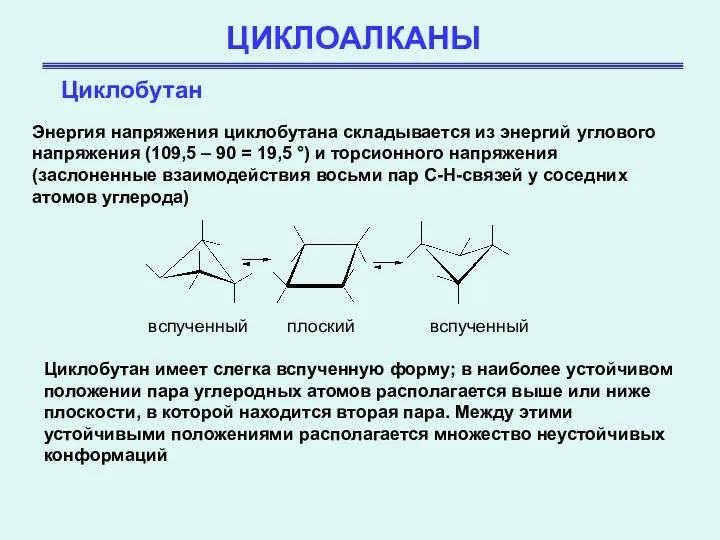
- 17. ЦИКЛОАЛКАНЫ Циклобутан Энергия напряжения циклобутана складывается из энергий углового напряжения (109,5 – 90 = 19,5 °)
- 18. ЦИКЛОАЛКАНЫ Циклопентан В отличие от циклопропана и циклобутана в циклопентане почти нет угловых искажений. В плоском
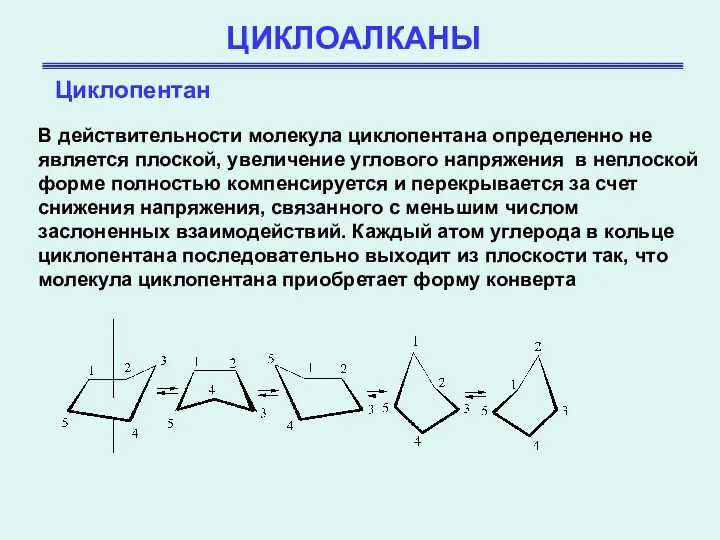
- 19. ЦИКЛОАЛКАНЫ Циклопентан В действительности молекула циклопентана определенно не является плоской, увеличение углового напряжения в неплоской форме
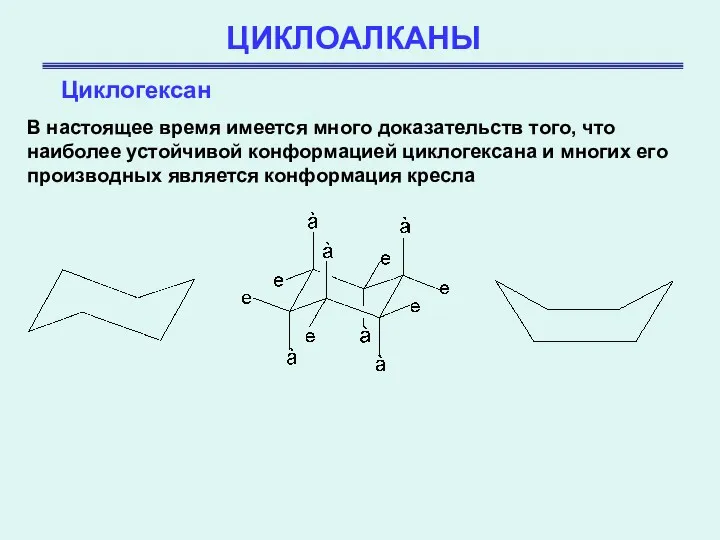
- 20. ЦИКЛОАЛКАНЫ Циклогексан В настоящее время имеется много доказательств того, что наиболее устойчивой конформацией циклогексана и многих
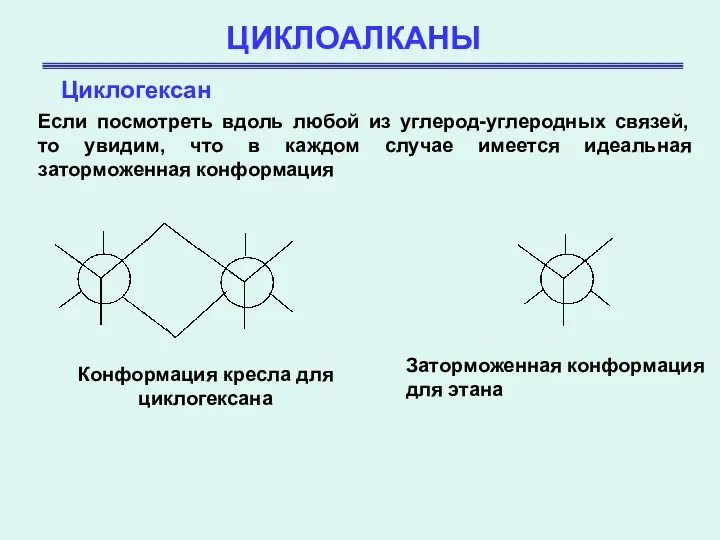
- 21. ЦИКЛОАЛКАНЫ Циклогексан Если посмотреть вдоль любой из углерод-углеродных связей, то увидим, что в каждом случае имеется
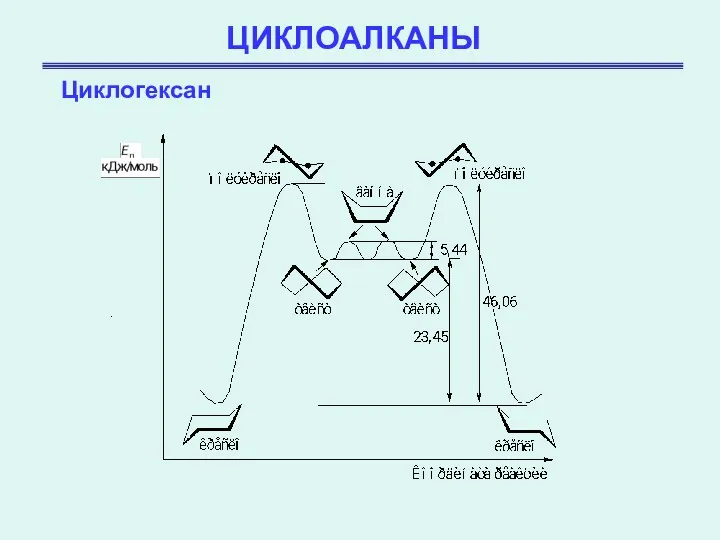
- 22. ЦИКЛОАЛКАНЫ Циклогексан Таким образом, эта конформация свободна не только от углового, но также и от торсионного
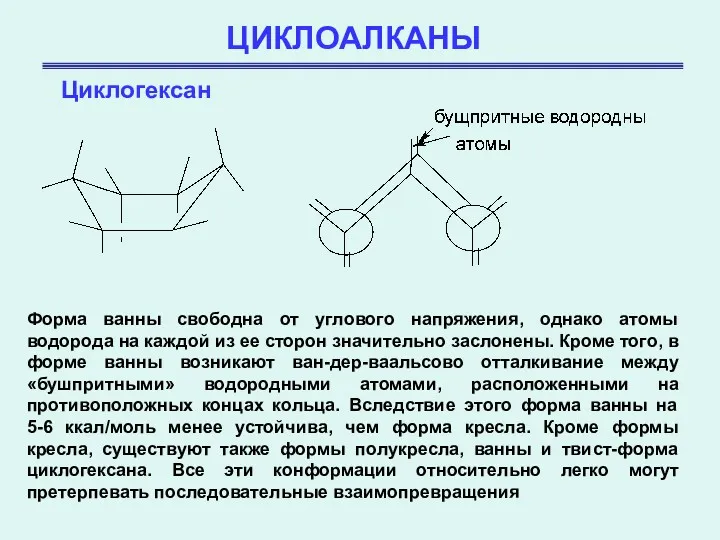
- 23. ЦИКЛОАЛКАНЫ Циклогексан Форма ванны свободна от углового напряжения, однако атомы водорода на каждой из ее сторон
- 24. ЦИКЛОАЛКАНЫ Циклогексан
- 25. ЦИКЛОАЛКАНЫ Химические свойства Химические свойства циклоалканов во многом совпадают со свойствами алканов. Для них характерны, прежде
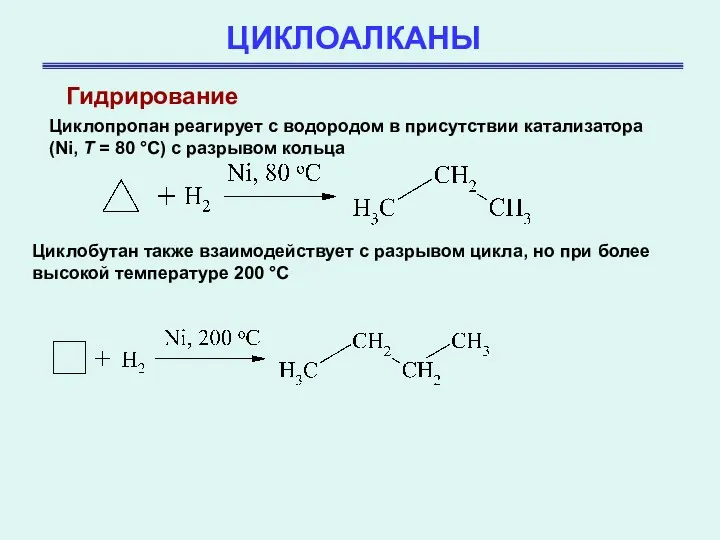
- 26. ЦИКЛОАЛКАНЫ Гидрирование Циклопропан реагирует с водородом в присутствии катализатора (Ni, T = 80 °С) с разрывом
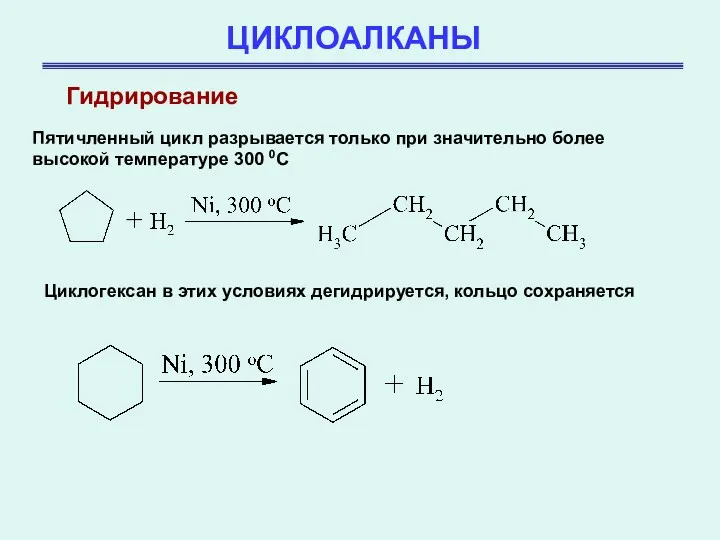
- 27. ЦИКЛОАЛКАНЫ Гидрирование Пятичленный цикл разрывается только при значительно более высокой температуре 300 0С Циклогексан в этих
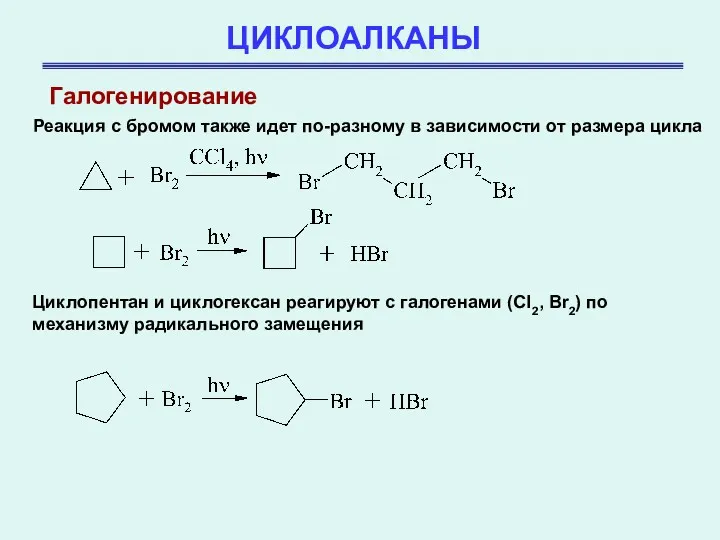
- 28. ЦИКЛОАЛКАНЫ Галогенирование Реакция с бромом также идет по-разному в зависимости от размера цикла Циклопентан и циклогексан
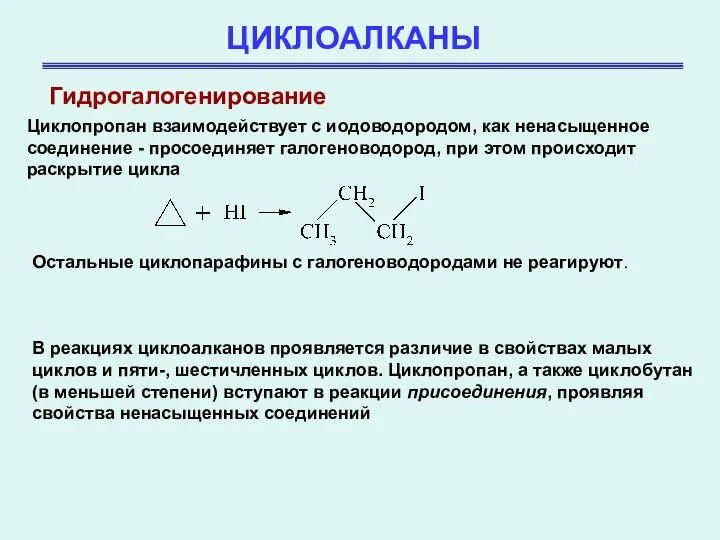
- 29. ЦИКЛОАЛКАНЫ Циклопропан взаимодействует с иодоводородом, как ненасыщенное соединение - просоединяет галогеноводород, при этом происходит раскрытие цикла
- 30. ЦИКЛОАЛКАНЫ Методы синтеза Процесс получения циклических алифатических углеводородов из других алифатических соединений в общем виде состоит
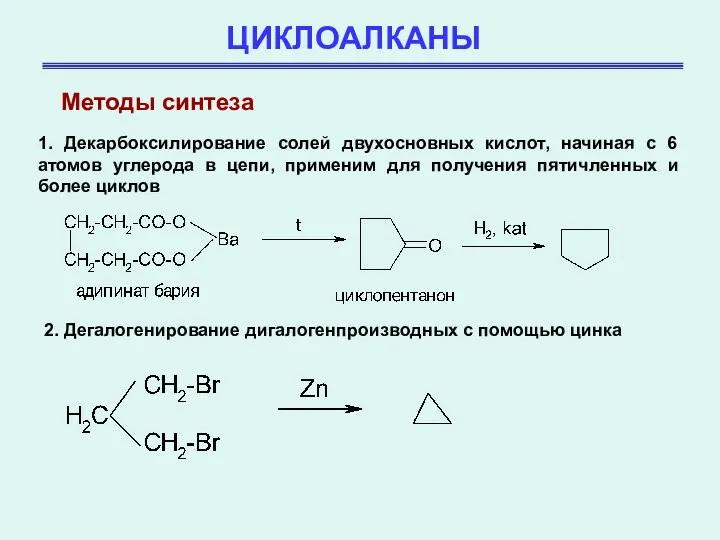
- 31. ЦИКЛОАЛКАНЫ Методы синтеза 1. Декарбоксилирование солей двухосновных кислот, начиная с 6 атомов углерода в цепи, применим
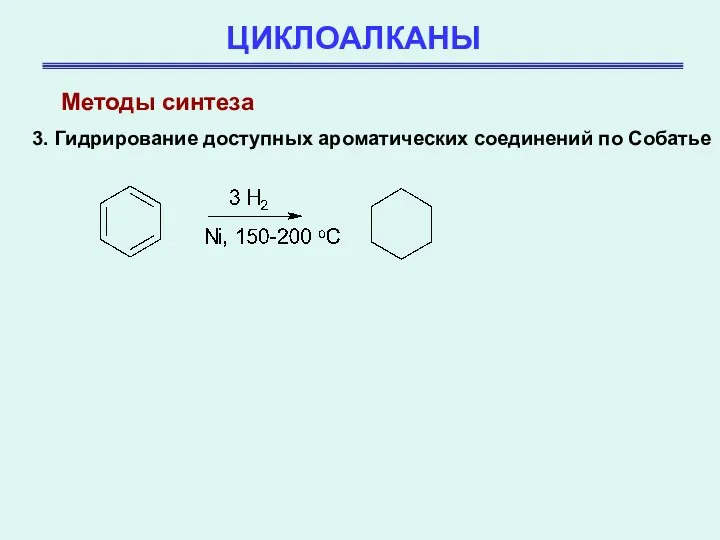
- 32. ЦИКЛОАЛКАНЫ 3. Гидрирование доступных ароматических соединений по Собатье Методы синтеза
- 34. Скачать презентацию









 Подгруппа серы и ее соединения
Подгруппа серы и ее соединения Поверхностные явления. Типы поверхностных явлений
Поверхностные явления. Типы поверхностных явлений Химия: основные понятия. Периодическая система химических элементов Д. И. Менделеева
Химия: основные понятия. Периодическая система химических элементов Д. И. Менделеева Общая характеристика неметаллов
Общая характеристика неметаллов Устранение жёсткости воды на промышленных предприятиях
Устранение жёсткости воды на промышленных предприятиях Общие сведения об электрорадиоматериалах
Общие сведения об электрорадиоматериалах Вода – основа жизни на Земле
Вода – основа жизни на Земле Формування поняття про окисно-відновні реакції в процес і вивчення шкільного курсу хімії
Формування поняття про окисно-відновні реакції в процес і вивчення шкільного курсу хімії Азот
Азот Анри Ле Шателье. 1850-1963. Принцип Ле Шателье в химии
Анри Ле Шателье. 1850-1963. Принцип Ле Шателье в химии Соли. Названия солей
Соли. Названия солей Пиролиз углеводородов
Пиролиз углеводородов Минерал чароит. Месторождения
Минерал чароит. Месторождения Магний (Mg)
Магний (Mg) Жоғары молекулалық қосылыстар химиясы
Жоғары молекулалық қосылыстар химиясы Углеводы (сахариды)
Углеводы (сахариды) α-Аминокислоты. Белки
α-Аминокислоты. Белки Окислительно-восстановительные реакции. Подготовка к К/Р. 9 класс
Окислительно-восстановительные реакции. Подготовка к К/Р. 9 класс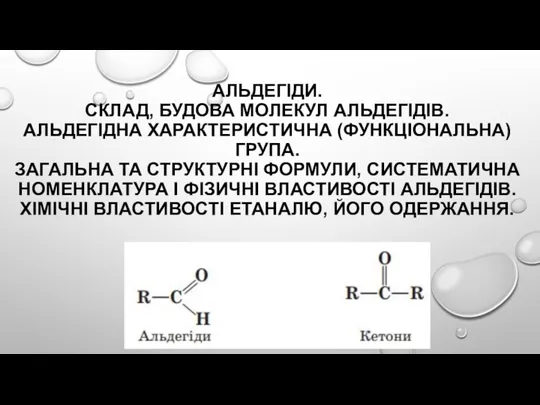 Альдегіди. Склад, будова молекул альдегідів. Альдегідна характеристична (функціональна) група
Альдегіди. Склад, будова молекул альдегідів. Альдегідна характеристична (функціональна) група Le trasformazioni fisiche della materia. Tema 3
Le trasformazioni fisiche della materia. Tema 3 Углеводороды. Применение природных источников углеводородов и продуктов их переработки
Углеводороды. Применение природных источников углеводородов и продуктов их переработки Химическая кинетика. Раздел 2
Химическая кинетика. Раздел 2 Химические свойства солей
Химические свойства солей Органикалық заттардың ерекшелігі
Органикалық заттардың ерекшелігі Характеристика элементов VIIA-группы (галогены)
Характеристика элементов VIIA-группы (галогены) Соединения водорода
Соединения водорода Кристаллохимия негіздері
Кристаллохимия негіздері Кинетика химических реакций. Химическое равновесие. (Лекция 5)
Кинетика химических реакций. Химическое равновесие. (Лекция 5)