Содержание
- 2. «Хлеб да соль» «Чтобы узнать человека, надо с ним пуд соли съесть» 2 года = пуд
- 3. Соликамск Соль-Илецк Усолье Солт-Лейк-Сити Солтвиль Зальцбург Города и поселки
- 7. Окрашенные озера
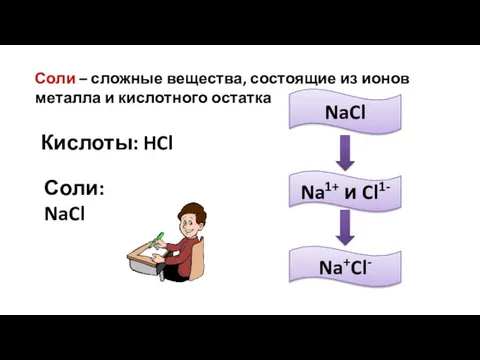
- 8. Соли – сложные вещества, состоящие из ионов металла и кислотного остатка Кислоты: HCl Соли: NaCl NaCl
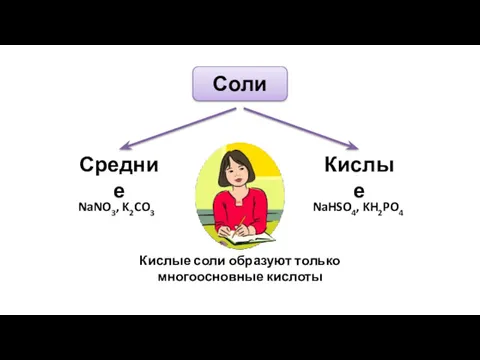
- 9. Соли Средние Кислые NaNO3, K2CO3 NaHSO4, KH2PO4 Кислые соли образуют только многоосновные кислоты
- 10. Хлорид кальция Ca2+ Cl1- Заряды ионов НОК = 2 CaCl2 Фосфат бария Заряды ионов Вa2+ РО43-
- 11. ион кислотного остатка (и. п.) + ион металла (р. п) Al2(SO4)3 Fe(NO3)3 — нитрат железа (III)
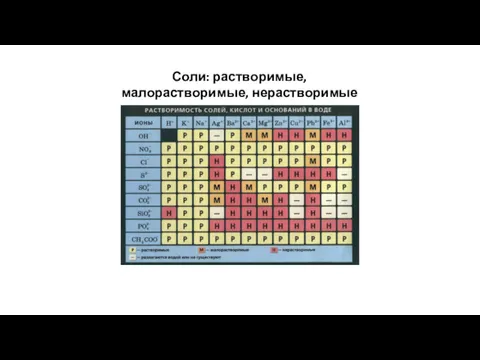
- 12. Соли: растворимые, малорастворимые, нерастворимые в воде
- 13. соли азотной кислоты – нитраты, все растворимы почти все соли соляной кислоты – хлориды тоже растворимы,
- 14. NaCl хорошо растворяется в воде в крови создает условия для жизни красных кровяных телец в мышцах
- 15. СаСО3 Карбонат кальция нерастворимая в воде соль из ее построены раковины моллюсков, покровы раков, кораллы остатки
- 17. Скачать презентацию











 Строение атома. Химическая связь
Строение атома. Химическая связь Азотные удобрения
Азотные удобрения 5.Алкины
5.Алкины Открытие Периодического закона
Открытие Периодического закона Витамины. Ашылу тарихы
Витамины. Ашылу тарихы Теория электролитической диссоциации
Теория электролитической диссоциации Изделия из металлов
Изделия из металлов Вывод формул веществ по массовым долям элементов. 10 класс
Вывод формул веществ по массовым долям элементов. 10 класс Аммиак. Строение молекулы аммиака, его физические и химические свойства
Аммиак. Строение молекулы аммиака, его физические и химические свойства Аналитическая химия и химический анализ. (Лекция 1)
Аналитическая химия и химический анализ. (Лекция 1) Строение вещества. Химическая связь
Строение вещества. Химическая связь Применение водорода. Будущие водородные технологии. Урок химии в 8 классе
Применение водорода. Будущие водородные технологии. Урок химии в 8 классе Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Тяжёлая вода
Тяжёлая вода Алюминий
Алюминий Магнезит
Магнезит Естери. Класифікація та номенклатура естерів
Естери. Класифікація та номенклатура естерів ГИА-9 Химия. А4
ГИА-9 Химия. А4 Химические свойства алкенов
Химические свойства алкенов Химическая кинетика
Химическая кинетика Сополимеры в стоматологии
Сополимеры в стоматологии Химическая промышленность России входит в авангардную тройку
Химическая промышленность России входит в авангардную тройку Процессы природного минералообразования. Формы природных выделений минералов
Процессы природного минералообразования. Формы природных выделений минералов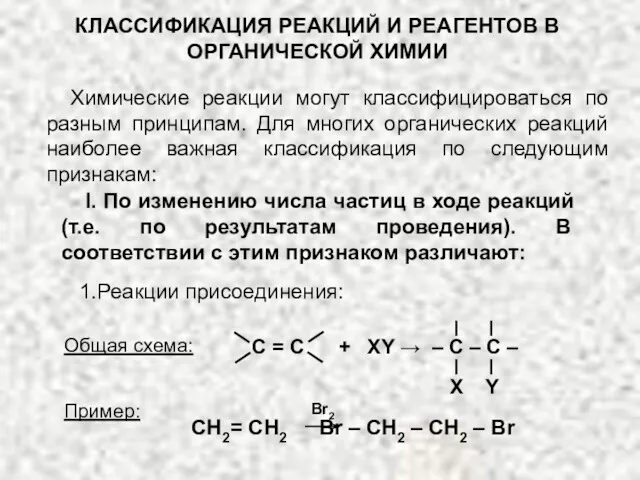 Классификация реакций и реагентов органической химии
Классификация реакций и реагентов органической химии Алкадиены
Алкадиены Титриметрический метод анализа
Титриметрический метод анализа Водород и щелочные металлы
Водород и щелочные металлы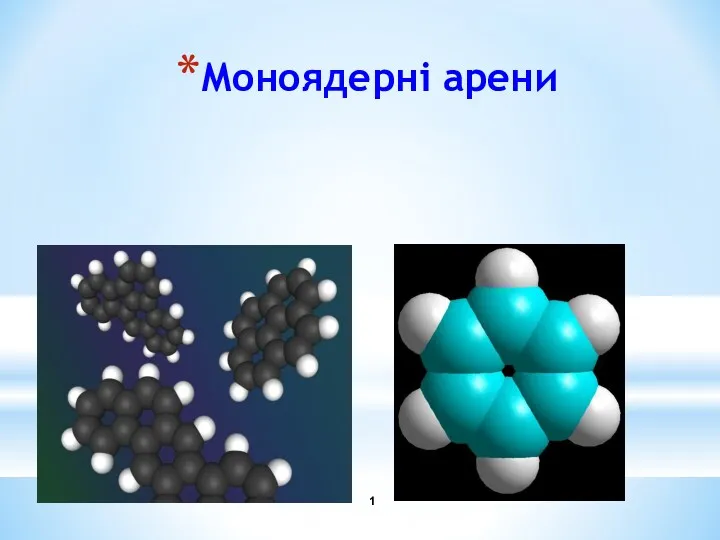 Моноядерні арени
Моноядерні арени