Содержание
- 2. Химическая кинетика Кинетика – раздел физической химии, в котором рассматриваются закономерности, описывающие скорости химических процессов и
- 3. Химическая кинетика Величина скорости процесса и ее зависимость от времени существенно определяется отклонением системы от равновесия.
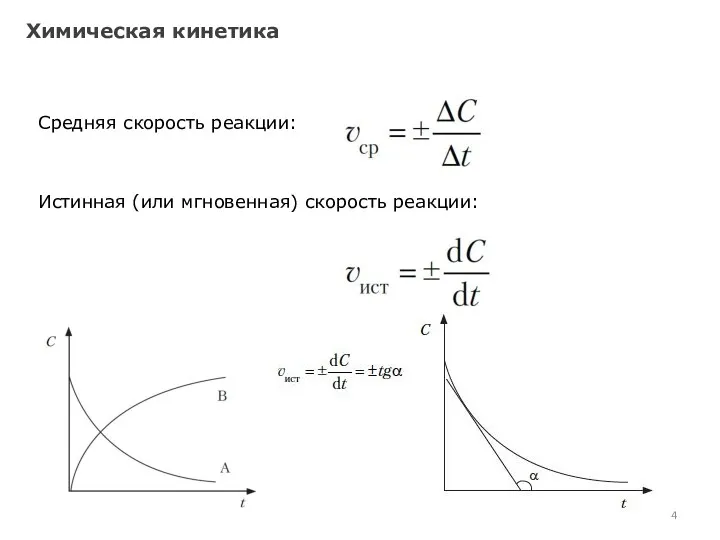
- 4. Химическая кинетика Средняя скорость реакции: Истинная (или мгновенная) скорость реакции:
- 5. Химическая кинетика Основной постулат химической кинетики Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых
- 6. Химическая кинетика Реакции нулевого порядка Реакции первого порядка
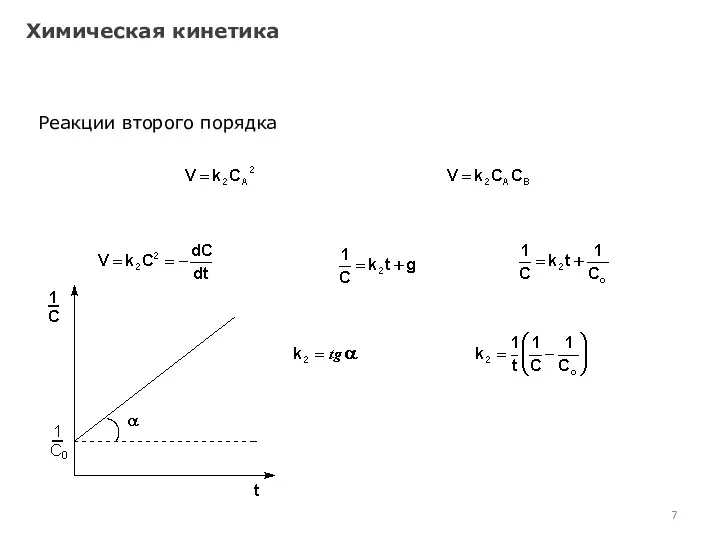
- 7. Химическая кинетика Реакции второго порядка
- 8. Химическая кинетика Реакции второго порядка
- 9. аА + bВ + dD + ... ––> еЕ + … Порядок химической реакции есть формально-кинетическое
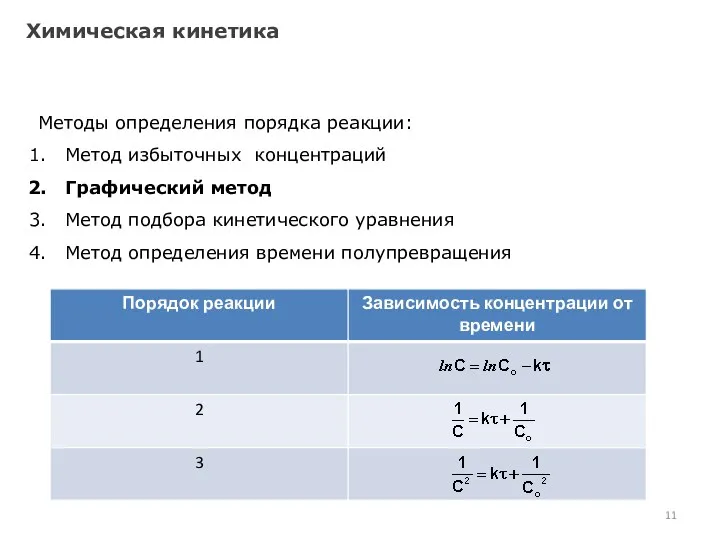
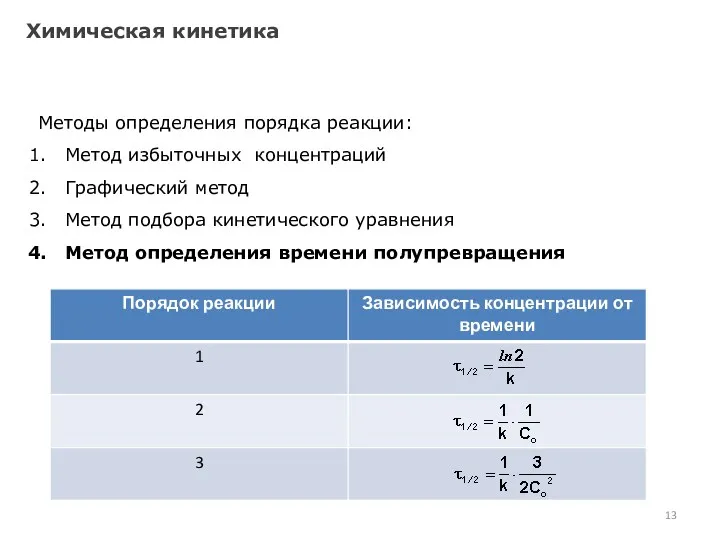
- 10. Химическая кинетика Методы определения порядка реакции: Метод избыточных концентраций Графический метод Метод подбора кинетического уравнения Метод
- 11. Химическая кинетика Методы определения порядка реакции: Метод избыточных концентраций Графический метод Метод подбора кинетического уравнения Метод
- 12. Химическая кинетика Методы определения порядка реакции: Метод избыточных концентраций Графический метод Метод подбора кинетического уравнения Метод
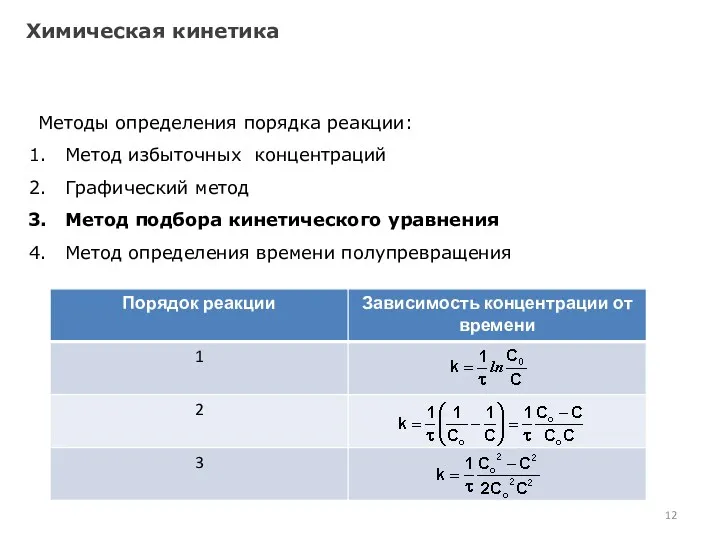
- 13. Химическая кинетика Методы определения порядка реакции: Метод избыточных концентраций Графический метод Метод подбора кинетического уравнения Метод
- 14. Химическая кинетика Сложные реакции химические реакции, протекающие более чем в одну стадию. Последовательные реакции А ––>
- 15. Химическая кинетика Цепные реакции: Основа теории цепных реакций –исходные вещества превращаются в конечный продукт не сразу,
- 16. Химическая кинетика Цепные реакции: Активными центрами - химически активные молекулы, атомы, радикалы, образующиеся на элементарных стадиях
- 17. Химическая кинетика Цепные реакции:
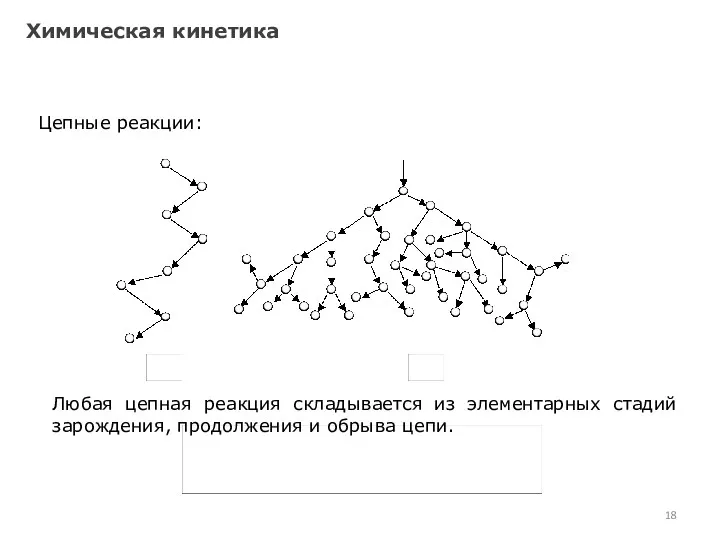
- 18. Химическая кинетика Цепные реакции: Любая цепная реакция складывается из элементарных стадий зарождения, продолжения и обрыва цепи.
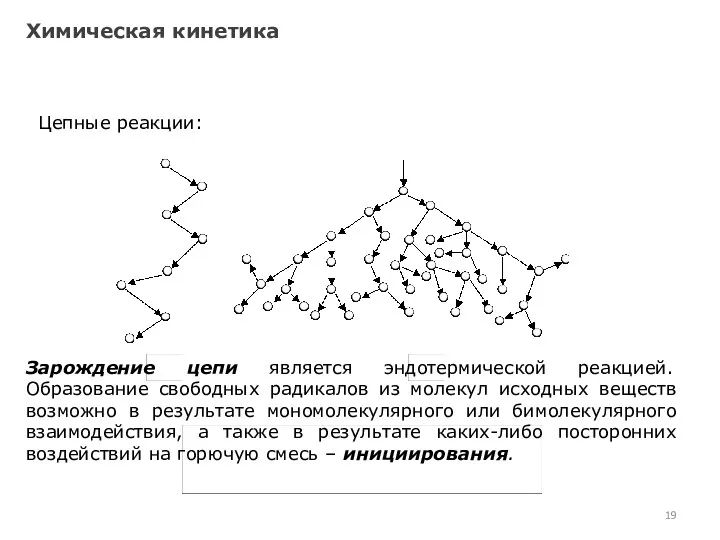
- 19. Химическая кинетика Цепные реакции: Зарождение цепи является эндотермической реакцией. Образование свободных радикалов из молекул исходных веществ
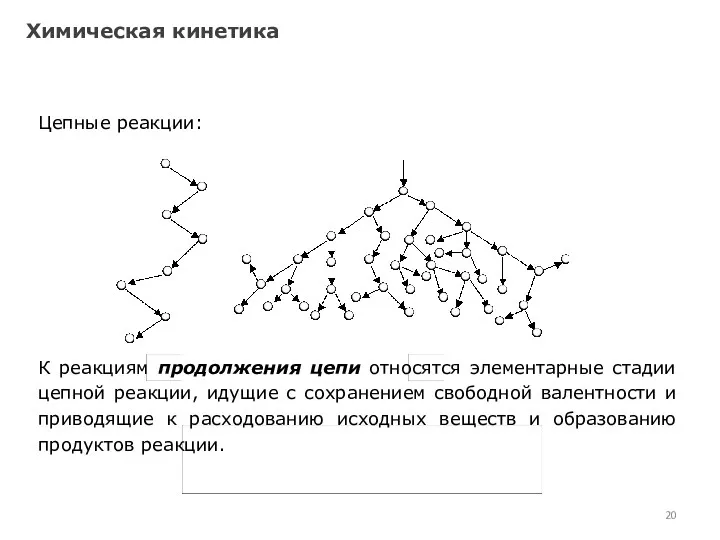
- 20. Химическая кинетика Цепные реакции: К реакциям продолжения цепи относятся элементарные стадии цепной реакции, идущие с сохранением
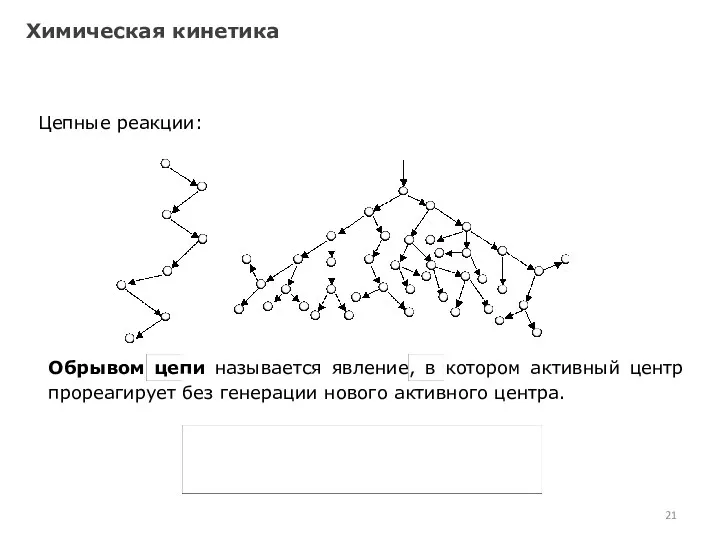
- 21. Химическая кинетика Цепные реакции: Обрывом цепи называется явление, в котором активный центр прореагирует без генерации нового
- 22. Химическая кинетика Цепные реакции: Обрыв цепи может быть гомогенным и гетерогенным. Гомогенный обрыв цепей возможен либо
- 23. Химическая кинетика Цепные реакции: Пример разветвленной цепной реакции - реакция горения водорода в кислороде. Взаимодействие водорода
- 24. Химическая кинетика Цепные реакции: реакции обрыва цепи: Н + ОН → Н2О, ОН + Н →
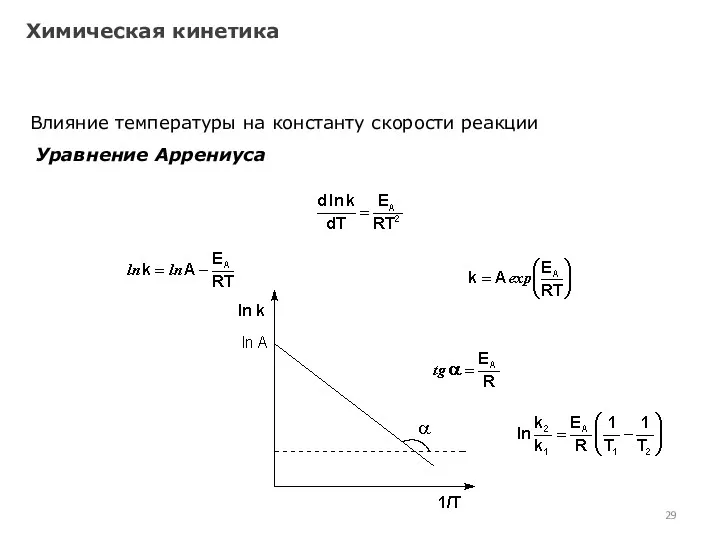
- 25. Химическая кинетика Влияние температуры на константу скорости реакции Я. Г. Вант-Гофф: При повышении температуры на каждые
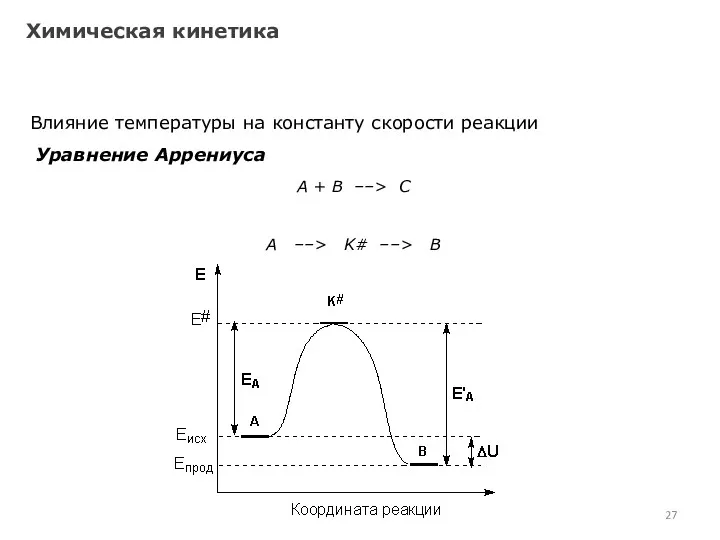
- 26. Химическая кинетика Влияние температуры на константу скорости реакции Уравнение Аррениуса С. Аррениус постулировал, что столкновения молекул
- 27. Химическая кинетика Влияние температуры на константу скорости реакции Уравнение Аррениуса А + В ––> С А
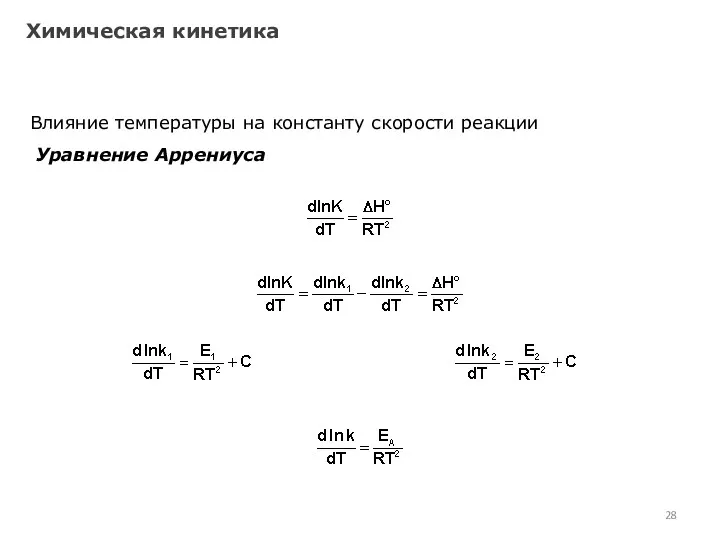
- 28. Химическая кинетика Влияние температуры на константу скорости реакции Уравнение Аррениуса
- 29. Химическая кинетика Влияние температуры на константу скорости реакции Уравнение Аррениуса
- 30. Химическая кинетика Кинетика гетерогенных химических реакций В гетерогенном химическом процессе можно выделить следующие стадии: 1. Диффузия
- 31. Химическая кинетика ФОТОХИМИЧЕСКИЕ РЕАКЦИИ Реакции, в которых активация частиц является результатом их взаимодействия с квантами электромагнитного
- 32. Химическая кинетика ФОТОХИМИЧЕСКИЕ РЕАКЦИИ Иногда фотохимические процессы происходят под действием излучения, которое не поглощается реагирующими веществами;
- 33. Химическая кинетика ФОТОХИМИЧЕСКИЕ РЕАКЦИИ Взаимодействие света с веществом может идти по трём возможным направлениям: 1. Возбуждение
- 34. Химическая кинетика ФОТОХИМИЧЕСКИЕ РЕАКЦИИ Между количеством лучистой энергии, поглощенной молекулами вещества, и количеством фотохимически прореагировавших молекул
- 35. Химическая кинетика ФОТОХИМИЧЕСКИЕ РЕАКЦИИ Поскольку фотохимическая реакция, как правило, включает в себя и т.н. вторичные процессы
- 37. Скачать презентацию





















 Темір және оның қосылыстары
Темір және оның қосылыстары Химическая кинетика. Катализ. Химическое равновесие
Химическая кинетика. Катализ. Химическое равновесие Атомно-кристаллическое строение материалов
Атомно-кристаллическое строение материалов Почему мыло пенится
Почему мыло пенится Пробоотбор других ООС. Лекция 3
Пробоотбор других ООС. Лекция 3 Спектроскопія ямр на ядрах 13с
Спектроскопія ямр на ядрах 13с Коррозия и защита полимерных строительных материалов
Коррозия и защита полимерных строительных материалов Обчислення за хімічними рівняннями відносного виходу продукту реакції. Урок №19. 11 клас
Обчислення за хімічними рівняннями відносного виходу продукту реакції. Урок №19. 11 клас Жиры
Жиры Воздух, которым мы дышим
Воздух, которым мы дышим Специфическое поведение гетерофункциональных соединений как результат взаимного влияния атомов
Специфическое поведение гетерофункциональных соединений как результат взаимного влияния атомов Методика проверки и оценивания заданий с развернутым ответом линии 30 и 31
Методика проверки и оценивания заданий с развернутым ответом линии 30 и 31 АЛЮМИНИЙ
АЛЮМИНИЙ Белки – высокомолекулярные природные соединения (биополимеры)
Белки – высокомолекулярные природные соединения (биополимеры) Растворы электролитов
Растворы электролитов Общая характеристика неметаллов
Общая характеристика неметаллов Три кити нанохімії
Три кити нанохімії Сандық есептер (металдар мен оның қосылыстарындағы генетикалық байланысты көрсететін)
Сандық есептер (металдар мен оның қосылыстарындағы генетикалық байланысты көрсететін) Вуглеводи прості і складні
Вуглеводи прості і складні Алкалоиды, производные тропана
Алкалоиды, производные тропана Положение в ПСХЭ водорода, лантаноидов, актиноидов и искусственно полученных элементов
Положение в ПСХЭ водорода, лантаноидов, актиноидов и искусственно полученных элементов Алкины. Химические и физические свойства алкинов. Строение алкинов
Алкины. Химические и физические свойства алкинов. Строение алкинов В мире кристаллов
В мире кристаллов Неорганические строительные материалы. Стекло
Неорганические строительные материалы. Стекло Угольная и кремниевая кислоты и их соли
Угольная и кремниевая кислоты и их соли Металлы
Металлы Строение атома. Периодический закон
Строение атома. Периодический закон Облучение. Радиационная окраска
Облучение. Радиационная окраска