Содержание
- 2. ЗАДАНИЕ 30
- 4. ЗАДАНИЕ 30
- 5. Рекомендации по оцениванию отдельных элементов ответа и решению возможных проблем при оценивании («памятка эксперта»): в качестве
- 6. ЗАДАНИЕ 30
- 7. КРИТЕРИИ ОЦЕНИВАНИЯ
- 8. ЗАДАНИЕ 30 Ставится 1 балл за элемент 2 ответа при условии, если: правильно указаны степени окисления
- 9. : KMnO4 + Na2SO3 + KOH → K2MnO4 + Na2SO4 + H2O KMnO4 + Na2SO3 +
- 10. Запись электронного баланса K2Cr2O7 + KBr + H2SO4 → Cr2(SO4)3 + Br2 + … 2Cr+6 +
- 11. Такие обозначения степеней окисления как N5+ и N4+ (сначала цифра, затем знак) считаются неверными. Исключение: у
- 12. Дополнительные рекомендации, которые необходимо учитывать в случае проблемных ситуаций степень окисления 0 может не указываться экзаменуемым;
- 13. Примечание 1: Если допущены грубые ошибки в составлении уравнения реакции: использованы вещества не из предложенного перечня,
- 14. Важнейшие окислители: O2, Cl2, Br2, HNO3, H2SO4(конц.), KMnO4, MnO2, K2Cr2O7, K2CrO4, KClO, KClO3, H2O2, (SO2, соединения
- 15. Примеры реакций с участием HNO3: Допускается запись NO в качестве продукта восстановления HNO3, при окислении сульфидов
- 16. Примеры реакций с участием H2SO4 (конц.): При использовании сильных восстановителей (активных металлов, иодидов) возможна запись S
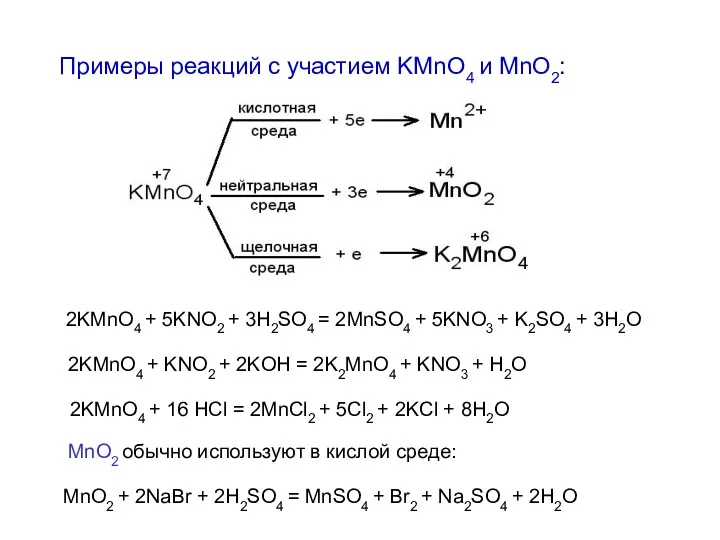
- 17. Примеры реакций с участием KMnO4 и MnO2: 2KMnO4 + 16 HCl = 2MnCl2 + 5Cl2 +
- 18. Хроматы и дихроматы чаще используют в кислой среде, восстановление протекает до соединений Cr(III): При использовании кислородсодержащих
- 19. О важнейших восстановителях и продуктах их окисления: Cложные вещества, содержащие атом в низшей степени окисления: HI,
- 20. Сложные вещества, содержащие катионы металлов, заряд которых может возрасти, например, Fe2+, соединения меди(I), соединения хрома(III): 2Cr(OH)3
- 21. Пример 1 ЗАДАНИЕ 30 Для выполнения заданий 30, 31 используйте следующий перечень веществ: сульфид серебра(I), азотная
- 22. Пример 1а 2
- 23. Пример 1б 0
- 24. Пример 1в 0
- 25. Пример 1г 2
- 26. 1 Пример 2
- 27. Пример 3 Задание 30 1
- 28. Пример 4 1
- 29. Пример 5 0
- 30. Пример 6 Перечень веществ: иодид калия, серная кислота, гидроксид алюминия, оксид марганца(IV), нитрат магния, гидроксид калия.
- 31. Пример 7 Перечень веществ: иодид калия, серная кислота, дихромат калия, гидроксид алюминия, оксид марганца(IV), нитрат магния.
- 32. Пример 8 Задание 30 2
- 33. ЗАДАНИЕ 31
- 34. ЗАДАНИЕ 31
- 35. ЗАДАНИЕ 31 Ионные уравнения реакций отражают суть тех изменений, которые происходят при взаимодействии веществ − электролитов
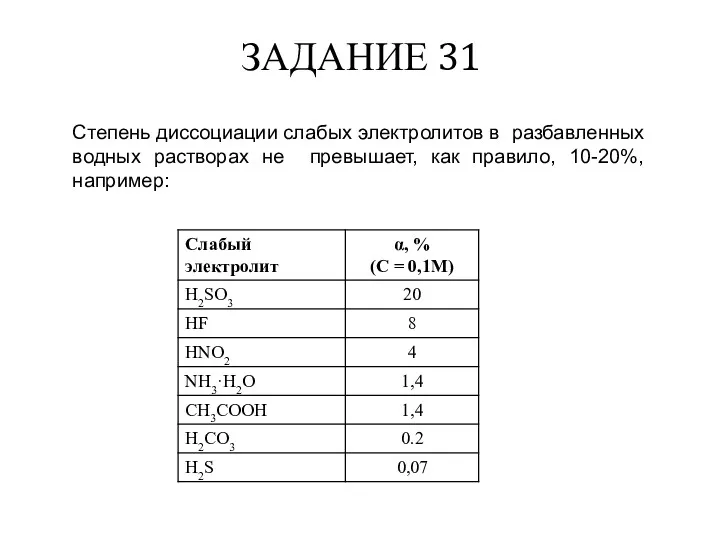
- 36. ЗАДАНИЕ 31 Степень диссоциации слабых электролитов в разбавленных водных растворах не превышает, как правило, 10-20%, например:
- 37. ЗАДАНИЕ 31 Оценка: 0 баллов В качестве исходных веществ должны быть выбраны растворимые в воде соли
- 38. Задание 31 Реакции образования гидроксокомплексов при взаимодействии растворов щелочей и растворимых солей цинка и алюминия также
- 39. Некоторые особые случаи Кислые соли диссоциируют ступенчато, например: 3 NaHSO3 → Na+ + HSO − (первая
- 40. ЗАДАНИЕ 31 Для выполнения заданий 30, 31 используйте следующий перечень веществ: сульфид серебра(I), азотная кислота, перманганат
- 41. Пример 11 2 0
- 42. Пример 13 1
- 43. Пример 14 1
- 44. Пример 15 1
- 46. Скачать презентацию






















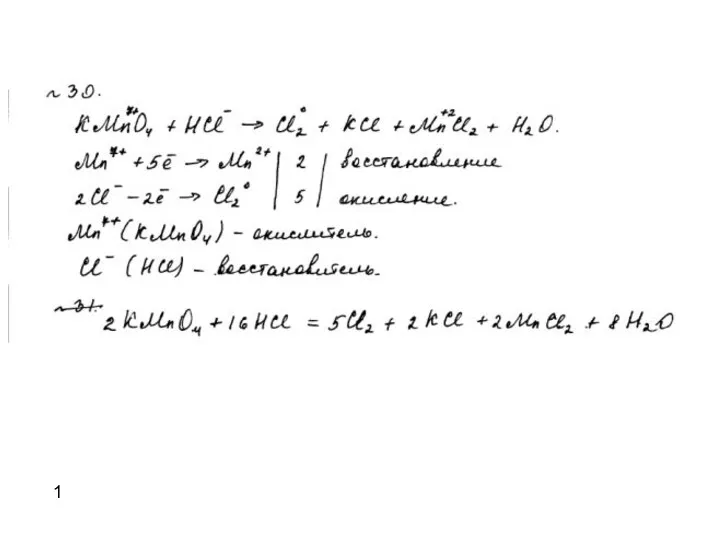












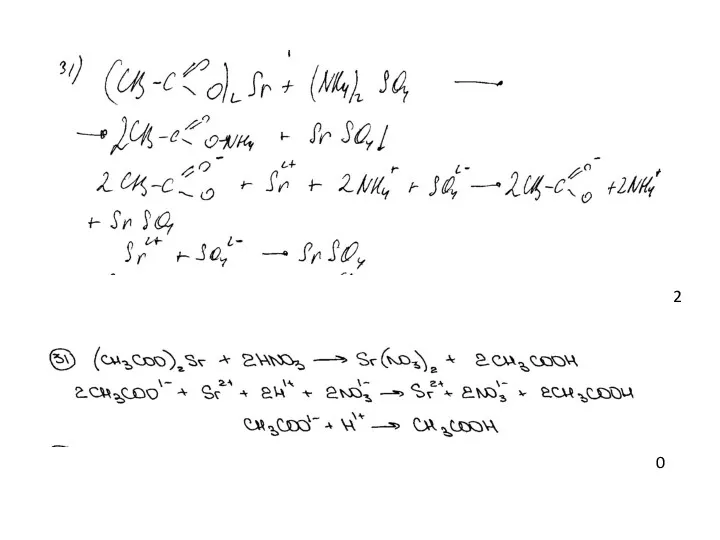
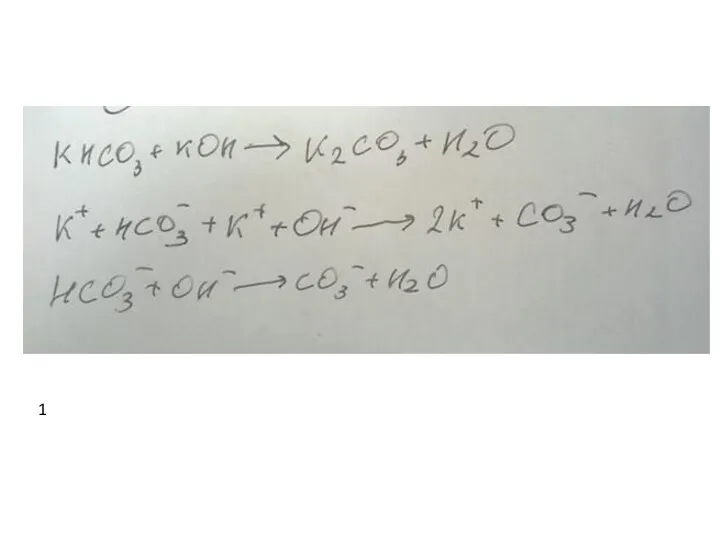

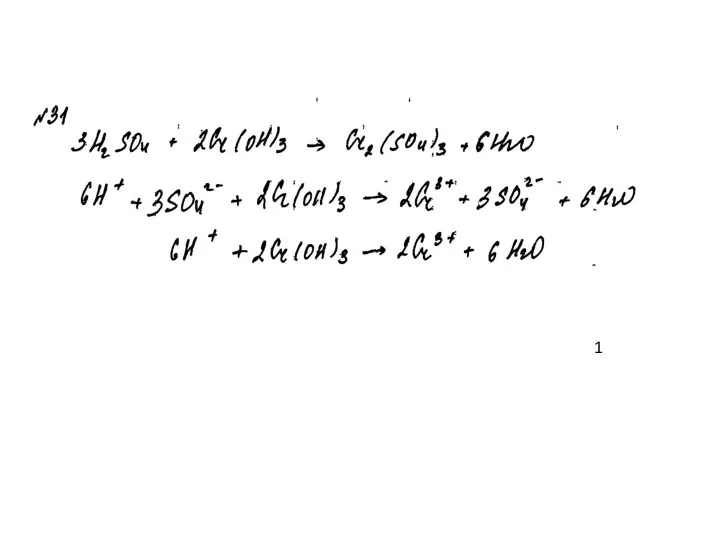
 Неметаллические материалы
Неметаллические материалы Электролитическая диссоциация
Электролитическая диссоциация Основные характеристики клеев
Основные характеристики клеев Взаємодія кисню із складними речовинами
Взаємодія кисню із складними речовинами Полимеры. Мономер
Полимеры. Мономер Растворы электролитов и неэлектролитов. Ионное произведение воды
Растворы электролитов и неэлектролитов. Ионное произведение воды Инструменты и приспособления для химической завивки волос
Инструменты и приспособления для химической завивки волос Хлорид натрия
Хлорид натрия Органическая химия. Жиры
Органическая химия. Жиры Пластмассы, синтетические каучуки
Пластмассы, синтетические каучуки Продукция UNIL
Продукция UNIL Глины каолиновые и каолино-гидрослюдистые
Глины каолиновые и каолино-гидрослюдистые Химический элемент кремний
Химический элемент кремний Магматические горные породы
Магматические горные породы Супрамолекулярная химия - молекулярная социология
Супрамолекулярная химия - молекулярная социология Углеводы. Сn(H2O)m – общая формула углеводов
Углеводы. Сn(H2O)m – общая формула углеводов Общая электронная формула внешнего слоя
Общая электронная формула внешнего слоя Простые вещества
Простые вещества Синтетические моющие средства, порошки, омыление, выпадение в осадок мыла, жиров
Синтетические моющие средства, порошки, омыление, выпадение в осадок мыла, жиров Классификация химических реакций в органической и неорганической химии
Классификация химических реакций в органической и неорганической химии Незвичайна вода
Незвичайна вода Фунгициды. Достоинства и недостати
Фунгициды. Достоинства и недостати Общая характеристика отравляющих и высокотоксичных веществ. (Тема 8)
Общая характеристика отравляющих и высокотоксичных веществ. (Тема 8) Алкадиены
Алкадиены Производство цемента. Сухой цемент
Производство цемента. Сухой цемент Коррозия металлов
Коррозия металлов ГИА. Вопрос А9. Химические свойства простых веществ: металлов и неметаллов
ГИА. Вопрос А9. Химические свойства простых веществ: металлов и неметаллов Коррозия металлов и способы защиты от неё. (11 класс)
Коррозия металлов и способы защиты от неё. (11 класс)