Содержание
- 3. Все вещества по отношению к элект- рическому току можно разделить на : их растворы или расплавы
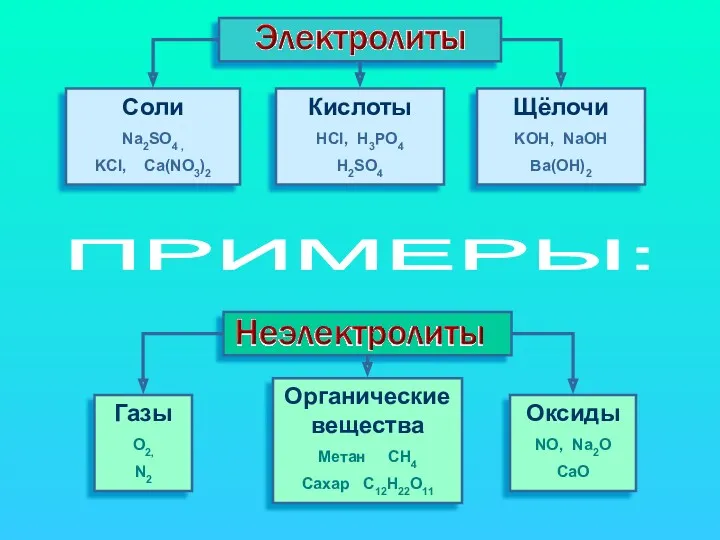
- 4. Cоли Na2SO4 , KCl, Ca(NO3)2 Кислоты HCl, H3PO4 H2SO4 Щёлочи KOH, NaOH Ba(OH)2 Газы O2, N2
- 5. Процесс появления гидратированных ионов в водном растворе называется электролитической диссоциацией (С. Аррениус, 1887 г.) .
- 7. Все вещества по их способности проводить электрический ток в растворах или расплавах делятся на электролиты и
- 8. В растворах электролиты диссоциируют ( распадаются) на положительные и отрицательные ионы. Процесс распада электролита на ионы
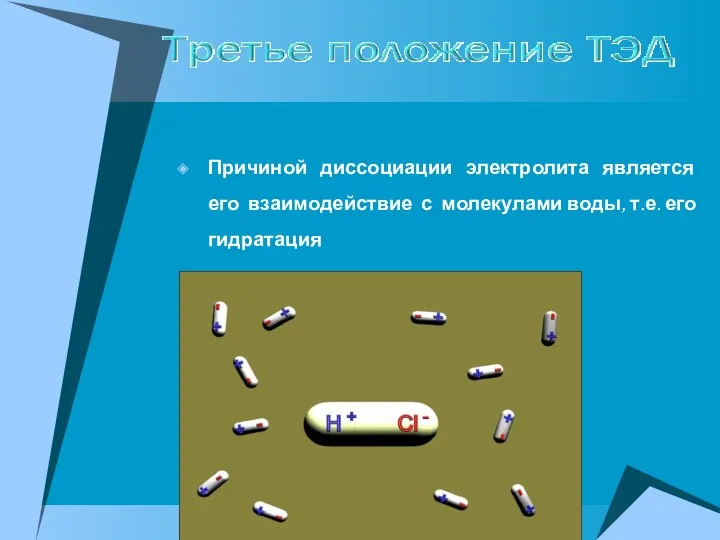
- 9. Причиной диссоциации электролита является его взаимодействие с молекулами воды, т.е. его гидратация
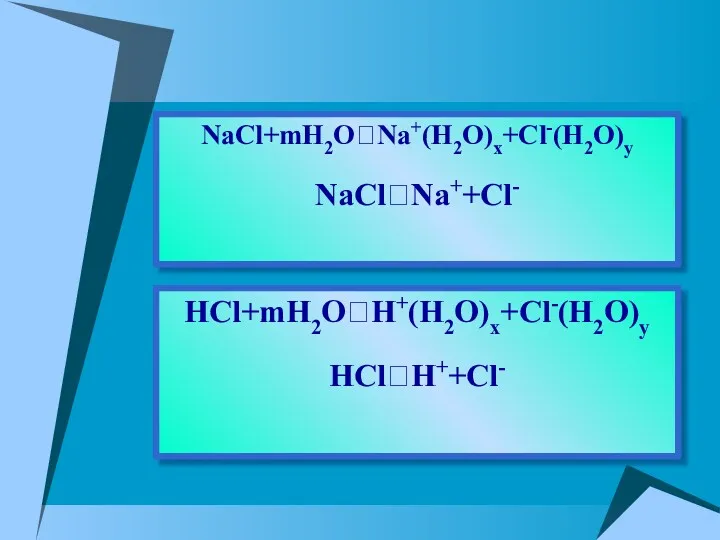
- 10. HCl+mH2O⮀H+(H2O)x+Cl-(H2O)y HCl⮀H++Cl- NaCl+mH2O⮀Na+(H2O)x+Cl-(H2O)y NaCl⮀Na++Cl-
- 11. Под действием тока положительные ионы движутся к катоду и называются катионы, а отрицательные – к аноду
- 12. Не все электролиты в одинаковой мере диссоциируют на ионы КЛАССИФИКАЦИЯ ЭЛЕКТРОЛИТОВ
- 13. - степень электролитической диссоциации n – число молекул, которые распались на ионы в растворе N –
- 14. Сильные электролиты α > 30% Средние водорастворимые соли NaCl, K2SO4, Ba(NO3)2 и т д; Гидроксиды щелочных
- 15. Электролиты средней силы 3% ≤ α ≤ 30% H3PO3, H3PO4, H4P2O7, H2SO3, HF, HClO2, Fe(OH)2,
- 16. Слабые электролиты α Органические кислоты: HCOOH, CH3COOH, C2H5COOH Минеральные кислоты: HNO2, HClO, H2CO3, H2SiO3, H3BO3, H3PO3,
- 17. Свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при диссоциации.
- 18. Классы неоргани-ческих веществ с точки зрения ТЭД
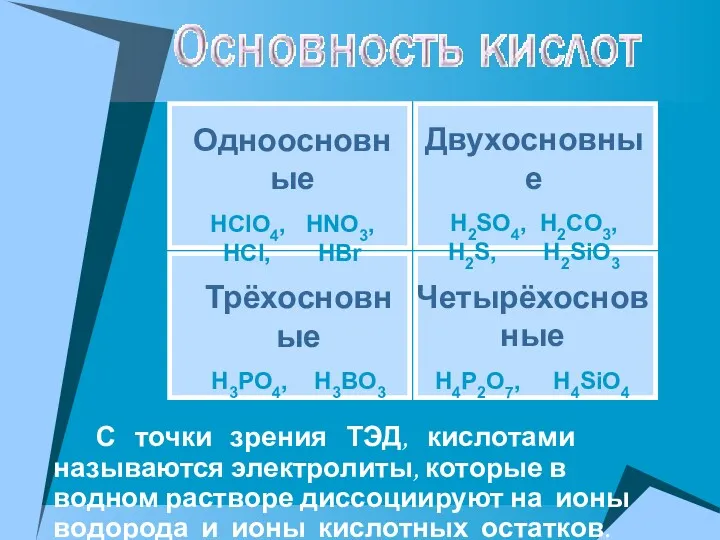
- 19. С точки зрения ТЭД, кислотами называются электролиты, которые в водном растворе диссоциируют на ионы водорода и
- 20. HCl = H+ + Cl- HNO3 = H+ + NO3- HClO4 = H+ + ClO4- Кислоты
- 21. Многоосновные кислоты диссоциируют ступенчато. Каждая последующая степень протекает хуже предыдущей. Сильный электролит H2SO4⮀H++ HSO4-α1 HSO4 -
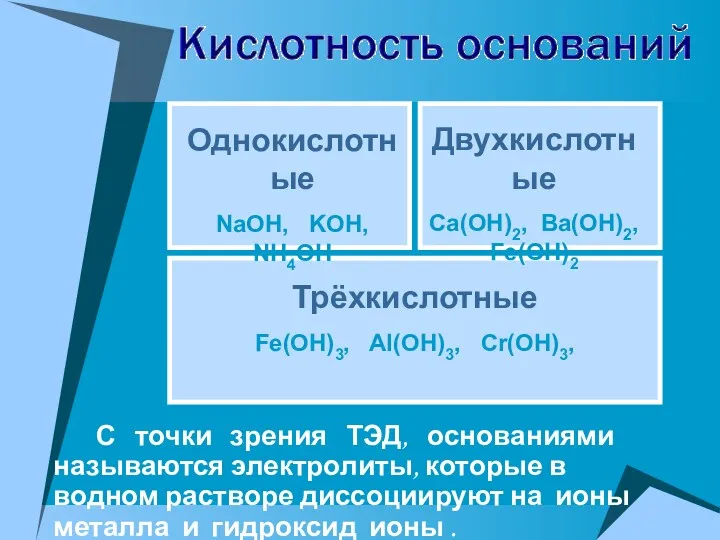
- 22. С точки зрения ТЭД, основаниями называются электролиты, которые в водном растворе диссоциируют на ионы металла и
- 23. NaOH = Na+ + OH- Ba(OH)2 = BaOH+ + OH- → Ba2+ + 2OH- KOH =
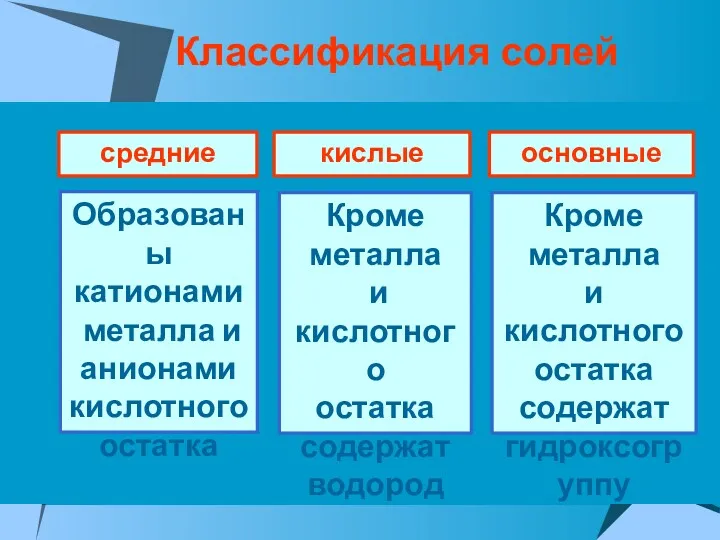
- 24. Соли – это электролиты, которые диссоциируют на катионы металла или аммония NH4+ и анионы кислотных остатков.
- 25. Классификация солей средние кислые основные Образованы катионами металла и анионами кислотного остатка Кроме металла и кислотного
- 26. Na2SO4 = 2Na+ + SO42- AlCl3 = Al3+ + 3Cl- Fe2(SO4)3 = 2Fe3+ + 3SO42- С
- 27. С точки зрения ТЭД, кислыми солями называются электролиты, которые в водном растворе диссоциируют на ионы металла
- 28. С точки зрения ТЭД, основными солями называются электролиты, которые в водном растворе диссоциируют на ионы металла
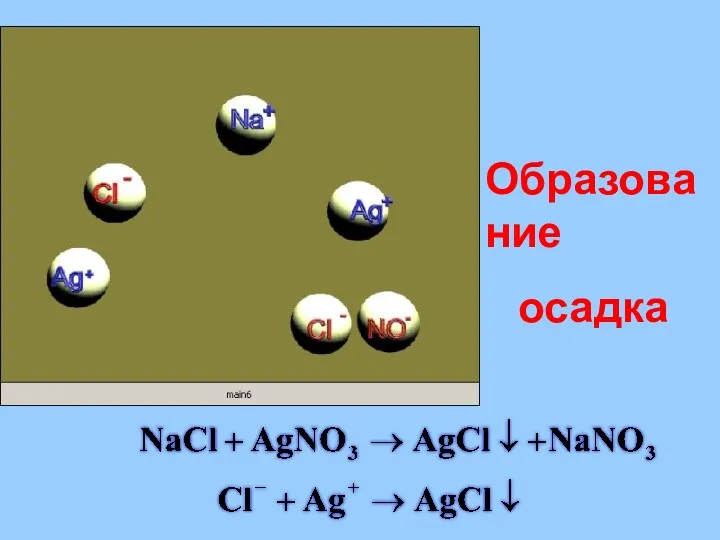
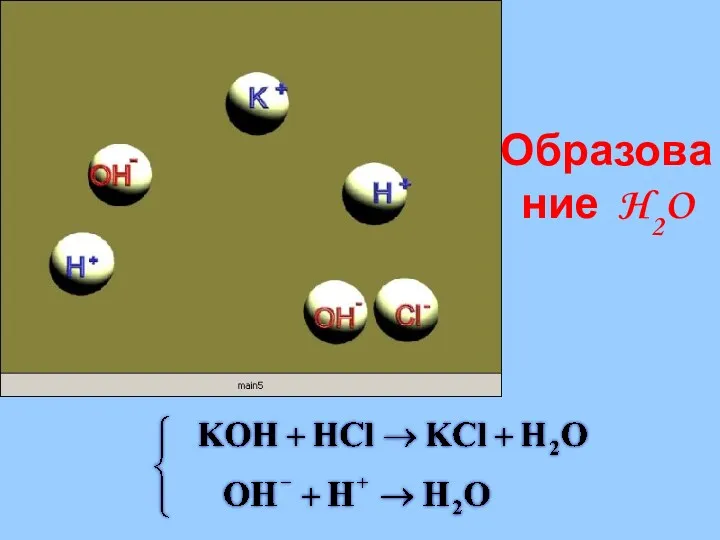
- 29. Реакции в растворах электролитов протекают до конца если: Образуется или растворяется осадок; Выделяется газ; Образуется малодиссоциирующее
- 30. Образование осадка
- 31. Образование H2O
- 33. Скачать презентацию






















 Альдегіди. Будова молекул
Альдегіди. Будова молекул Техника безопасности в кабинете химии
Техника безопасности в кабинете химии Химические свойства основных неорганических соединений в свете ЭД и ОВР
Химические свойства основных неорганических соединений в свете ЭД и ОВР Азотсодержащие гетероциклические соединения
Азотсодержащие гетероциклические соединения Алюминий и его соединения
Алюминий и его соединения Решение заданий по теме Химические свойства основных классов неорганических веществ
Решение заданий по теме Химические свойства основных классов неорганических веществ Смеси, растворы. Тест
Смеси, растворы. Тест Энтальпия. Тепловой эффект химической реакции. 11 класс
Энтальпия. Тепловой эффект химической реакции. 11 класс Неорганические строительные материалы. Стекло
Неорганические строительные материалы. Стекло Кислородсодержащие органические вещества. Фенолы
Кислородсодержащие органические вещества. Фенолы Азотная кислота и ее соли
Азотная кислота и ее соли Коррозия металлов
Коррозия металлов Периодический закон и периодическая система Д.И. Менделеева. Вторичная периодичность. Тема №1
Периодический закон и периодическая система Д.И. Менделеева. Вторичная периодичность. Тема №1 Органічні розчинники
Органічні розчинники Смолы и бальзамы. Воски и структурообразующие вещества в косметическом производстве
Смолы и бальзамы. Воски и структурообразующие вещества в косметическом производстве Окислительно-восстановительные реакции. Урок в 11 классе
Окислительно-восстановительные реакции. Урок в 11 классе Алкины (ацетиленовые углеводороды)
Алкины (ацетиленовые углеводороды) Антибиотики пенициллинового ряда
Антибиотики пенициллинового ряда Жидкокристаллические композиты ЖКК. Керамические композиционные материалы (ККМ). Углерод-углеродные композиционные (УУКМ)
Жидкокристаллические композиты ЖКК. Керамические композиционные материалы (ККМ). Углерод-углеродные композиционные (УУКМ) История открытия химических веществ
История открытия химических веществ Защитно-декоративные покрытия
Защитно-декоративные покрытия Титриметрический метод анализа
Титриметрический метод анализа Основные классы неорганических соединений
Основные классы неорганических соединений Спроби класифікації хімічних елементів
Спроби класифікації хімічних елементів Целевой и содержательный компоненты процесса обучения химии
Целевой и содержательный компоненты процесса обучения химии Понятие биогенности химических элементов
Понятие биогенности химических элементов Биохимическая трансформация веществ (2)
Биохимическая трансформация веществ (2) Происхождение названий минералов
Происхождение названий минералов