Периодический закон и периодическая система Д.И. Менделеева. Вторичная периодичность. Тема №1 презентация
Содержание
- 3. Создание и эволюция Периодической системы 8 элементов известны с древности – Fe, Ag, Au, Hg, Pb,
- 4. Попытки классификации химических элементов до Д.И. Менделеева …По мере возрастания числа открытых химических элементов возникала естественная
- 5. Первая попытка – А. Лавуазье в конце XVIII века А.Лавуазье, выделил 4 класса: газы и флюиды
- 6. Таблица простых тел Лавуазье
- 7. ТРИАДЫ И. Деберейнера В 1817 году немецкий ученый И. Доберейнер располагает все известные элементы отдельными триадами
- 8. Александр Эмиль Бегуйе Де Шанкуртуа 20 января 1820 г. – 14 ноября 1886 г. Французский геолог
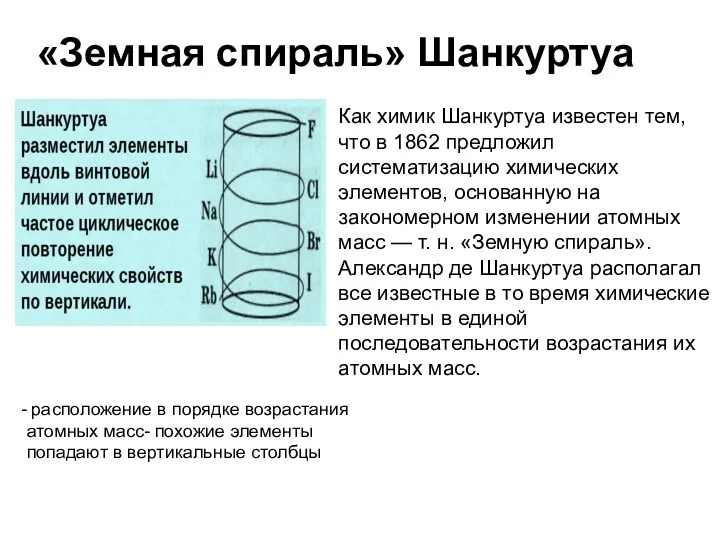
- 9. «Земная спираль» Шанкуртуа Как химик Шанкуртуа известен тем, что в 1862 предложил систематизацию химических элементов, основанную
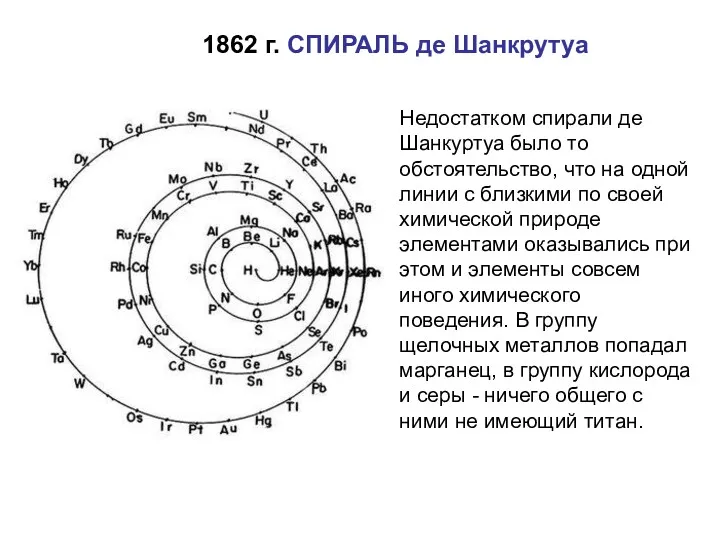
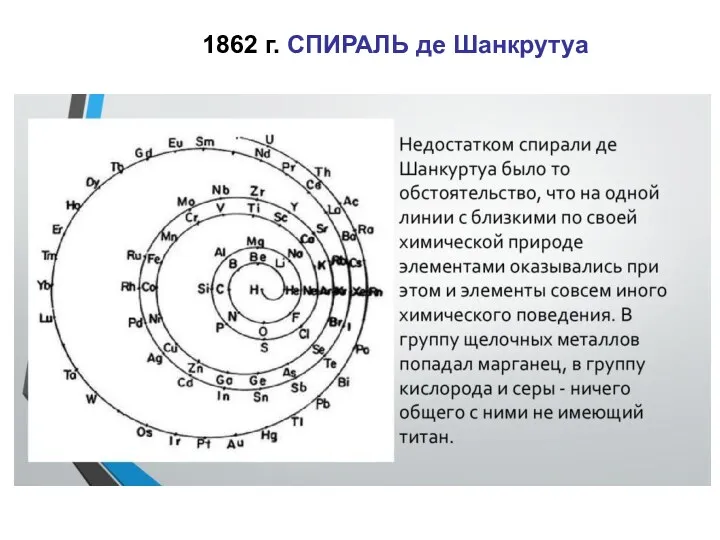
- 10. Недостатком спирали де Шанкуртуа было то обстоятельство, что на одной линии с близкими по своей химической
- 11. 1862 г. СПИРАЛЬ де Шанкрутуа
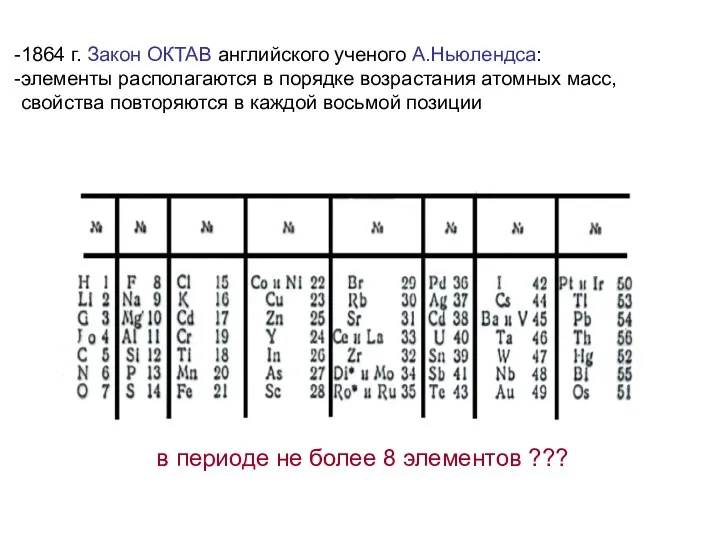
- 12. в периоде не более 8 элементов ??? 1864 г. Закон ОКТАВ английского ученого A.Ньюлендса: элементы располагаются
- 13. - 1864 г. классификация Олдинга : элементы располагаются в порядке возрастания их атомных масс и валентности
- 14. Недостатки таблицы Л. Мейера: некоторые элементы расположены неверно, цель работы – формальная классификация известных к тому
- 16. (экабор(Sc), экасилициум (Ge), экааллюминий(Ga), В 1875 г. французский химик Лекок де Буабодран открыл новый элемент, и
- 18. 1894-1900 гг. открытие благородных газов (Д.Рэлей, У. Рамзай, В. Дорн) привело к появлению новой VIII группы
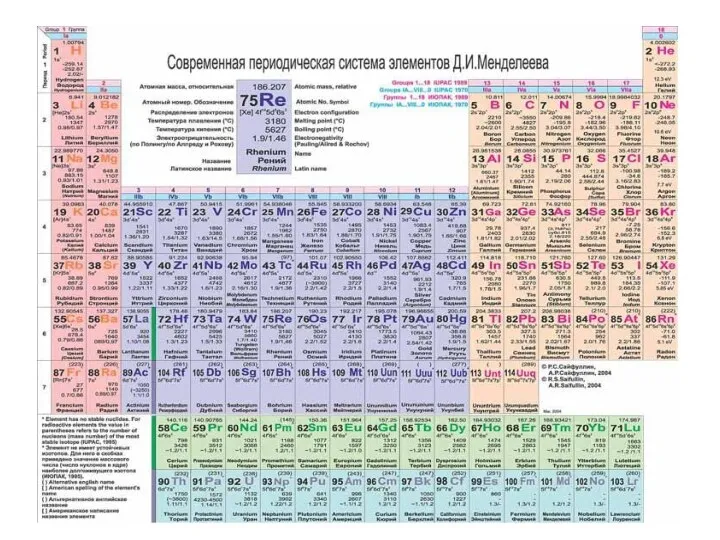
- 20. СТРУКТУРА ПЕРИОДИЧЕСКОЙ ТАБЛИЦЫ (короткая форма) Горизонтальные ряды – ПЕРИОДЫ (1-7) Малые (короткие) периоды (1,3) – 8
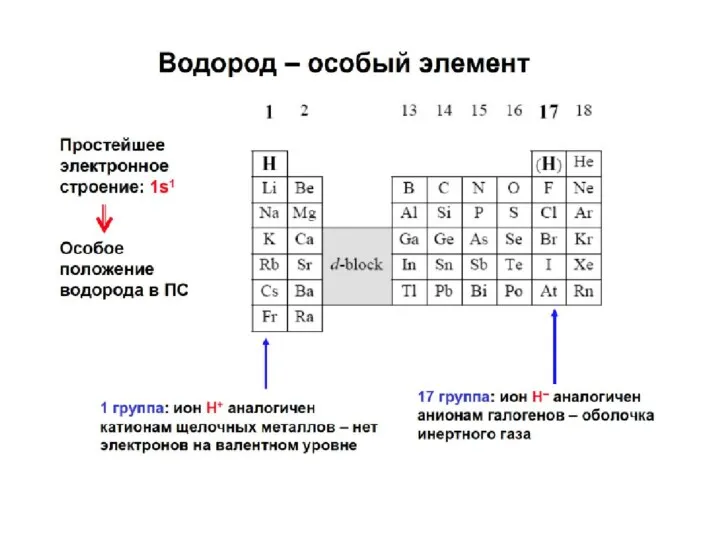
- 22. Электронное строение атома и периодичность свойств химических элементов Номер периода = числу энергетических уровней в атоме
- 25. Электронные аналоги – атомы и ионы с однотипным распределением внешних электронов Li 1s22s1 и Na 1s22s22p63s1
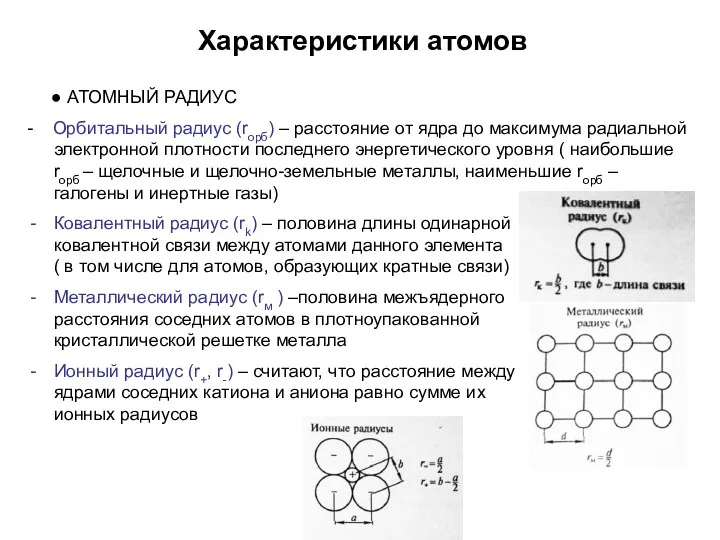
- 26. Характеристики атомов ● АТОМНЫЙ РАДИУС - Орбитальный радиус (rорб) – расстояние от ядра до максимума радиальной
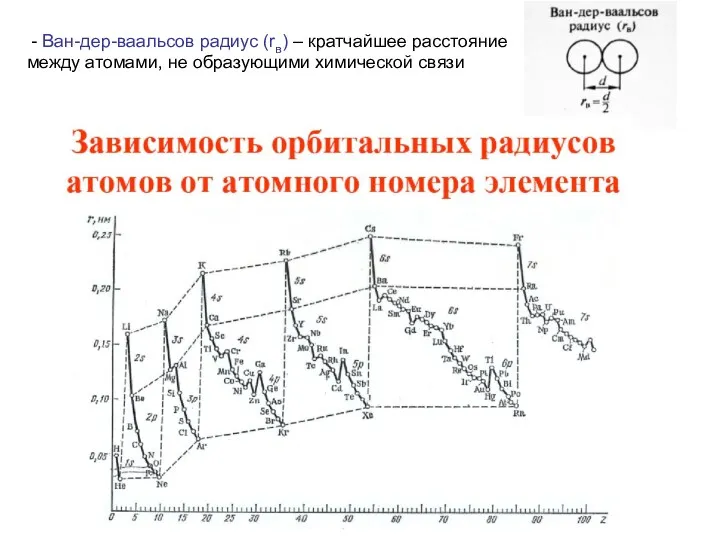
- 27. - Ван-дер-ваальсов радиус (rв) – кратчайшее расстояние между атомами, не образующими химической связи
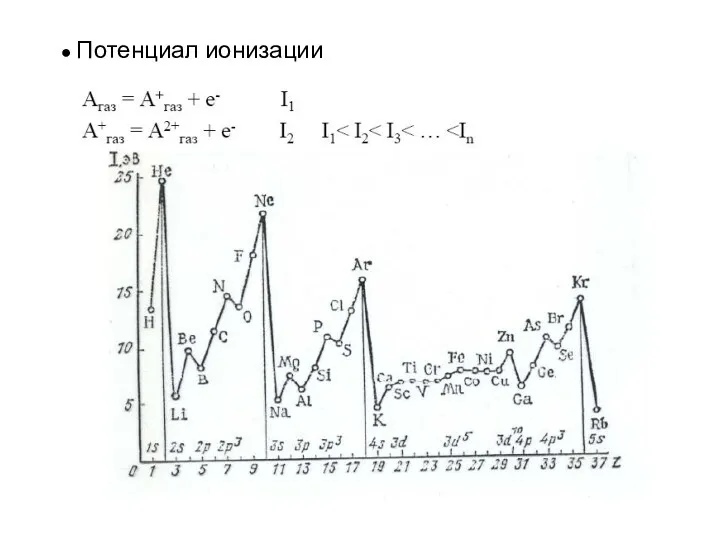
- 28. ● Потенциал ионизации
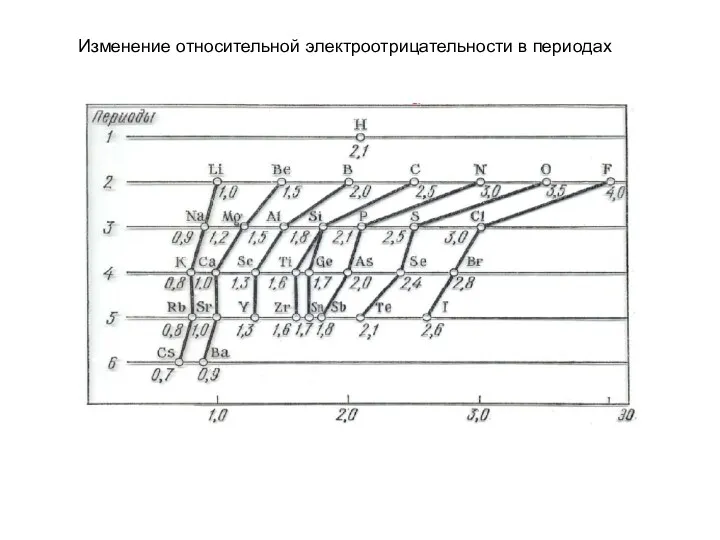
- 32. Изменение относительной электроотрицательности в периодах
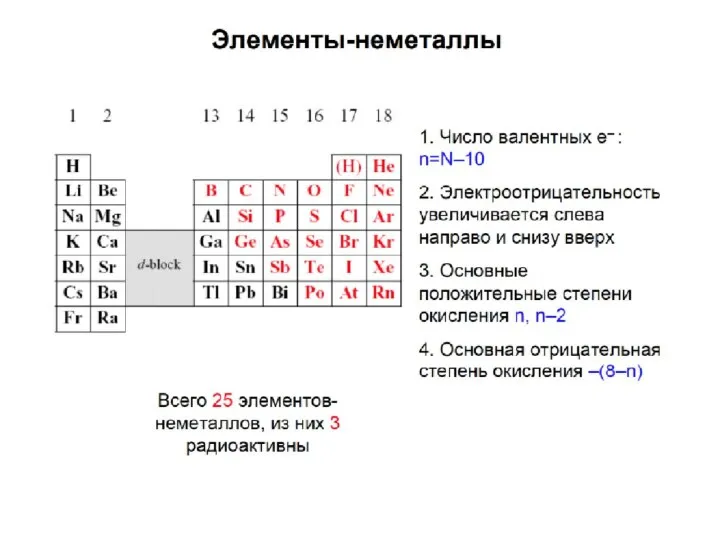
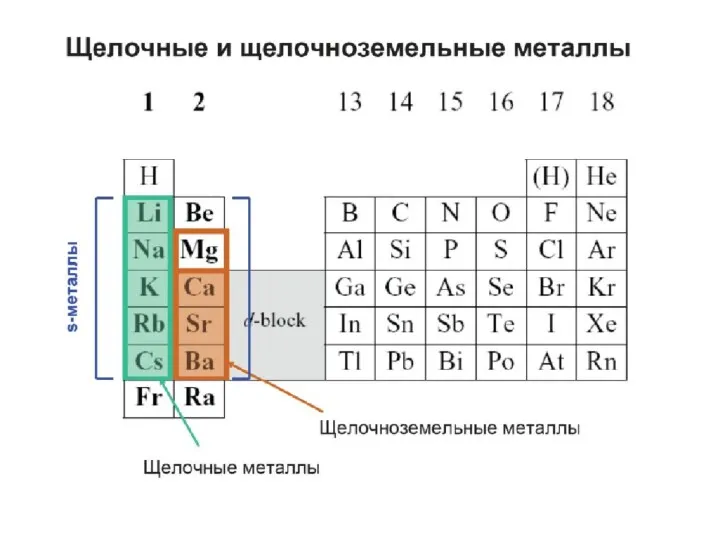
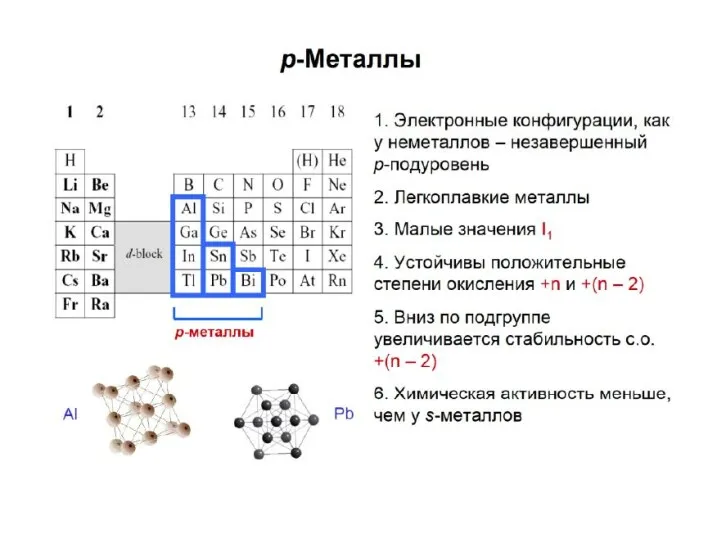
- 42. ЭЛЕМЕНТЫ ГЛАВНЫХ ПОДГРУПП IA – VIIA (общая характеристика)
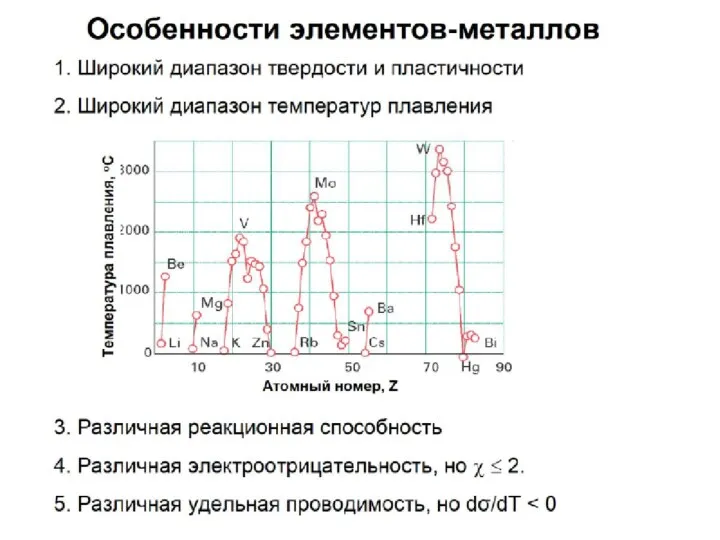
- 43. Радиус атома уменьшается с увеличением зарядов ядер атомов в периоде. Изменение радиуса атома в периоде
- 44. В одной группе с увеличением номера периода атомные радиусы возрастают. Изменение радиуса атома в периоде
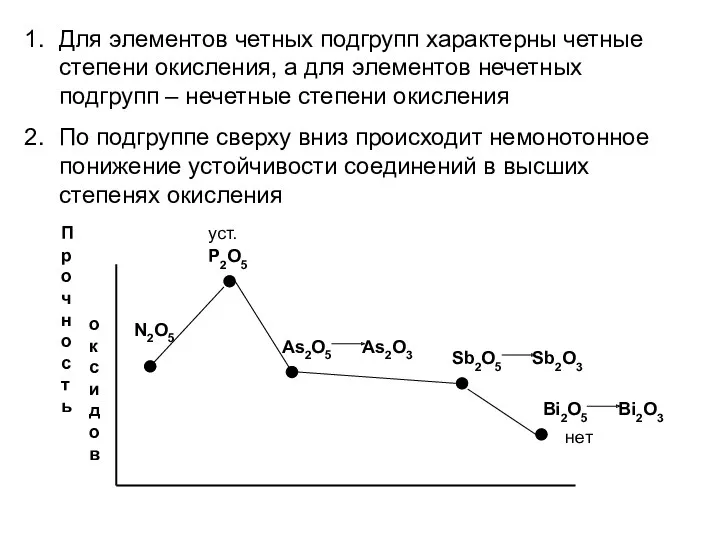
- 45. Для элементов четных подгрупп характерны четные степени окисления, а для элементов нечетных подгрупп – нечетные степени
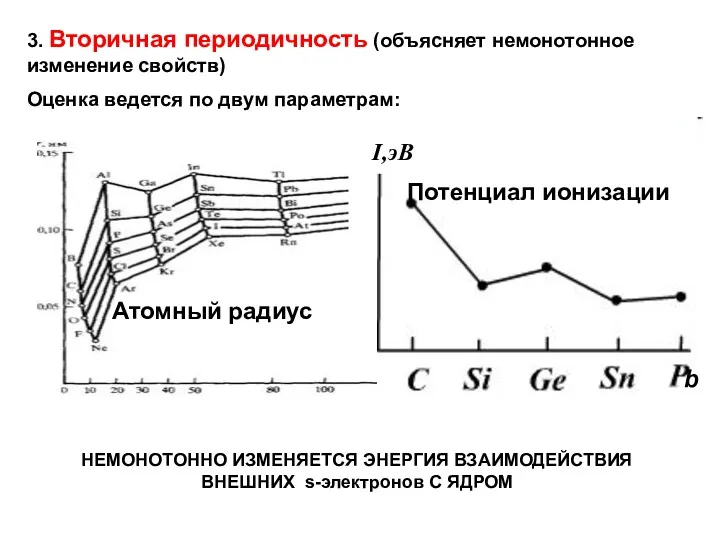
- 46. ВТОРИЧНАЯ ПЕРИОДИЧНОСТЬ (общая характеристика)
- 47. 3. Вторичная периодичность (объясняет немонотонное изменение свойств) Оценка ведется по двум параметрам: b Атомный радиус Потенциал
- 48. В группе IVА: С Si Ge Sn Pb C 1s22s22p2 (внешние 2s22p2-ē находятся близко к ядру,
- 50. ВТОРИЧНАЯ ПЕРИОДИЧНОСТЬ характерна ТОЛЬКО для элементов IIIA-VIIA групп В элементах IA-IIA групп s-электроны не подвержены влиянию
- 52. Скачать презентацию

































 Химия в быту
Химия в быту Теория кристаллического поля
Теория кристаллического поля Основні класи неорганічних сполук
Основні класи неорганічних сполук Искусственная радиоактивность. Ядерное оружие и его поражающие факторы
Искусственная радиоактивность. Ядерное оружие и его поражающие факторы Проведение лабораторных анализов образцов почвы
Проведение лабораторных анализов образцов почвы Основания. Получение и химические свойства
Основания. Получение и химические свойства Неоднородные системы, их классификация, методы разделения. Лекция 4
Неоднородные системы, их классификация, методы разделения. Лекция 4 Introduction to Periodic Table
Introduction to Periodic Table Предельные углеводороды. Алканы
Предельные углеводороды. Алканы Лекция как один из методов обучения химии на старшей ступени общего образования. Методика ее подготовки и чтения
Лекция как один из методов обучения химии на старшей ступени общего образования. Методика ее подготовки и чтения Номенклатура алканов
Номенклатура алканов Химия: основные понятия. Периодическая система химических элементов Д. И. Менделеева
Химия: основные понятия. Периодическая система химических элементов Д. И. Менделеева Кристаллическое строение и свойства металлов
Кристаллическое строение и свойства металлов Алюминий и его соединения
Алюминий и его соединения Интегрированный урок по химии и немецкому языку “Anwendung Hydrolyse von Wasser”
Интегрированный урок по химии и немецкому языку “Anwendung Hydrolyse von Wasser” Тканые армирующие материалы
Тканые армирующие материалы Щелочноземельные металлы Положение в периодической таблице
Щелочноземельные металлы Положение в периодической таблице Химические волокна (7 класс)
Химические волокна (7 класс) Многоатомные спирты
Многоатомные спирты Спирты
Спирты Типы химических реакций
Типы химических реакций Алены. Строение, изомерия, номенклатура
Алены. Строение, изомерия, номенклатура Игра по химии по теме Атомы химических элементов. Простые вещества
Игра по химии по теме Атомы химических элементов. Простые вещества Моторные масла
Моторные масла Периодическая система элементов Д. И. Менделеева. IA группа
Периодическая система элементов Д. И. Менделеева. IA группа Запобігання виникнення горіння засобами, що розбавлюють та інгібують
Запобігання виникнення горіння засобами, що розбавлюють та інгібують NaCl или поваренная соль (плюсы и минусы)
NaCl или поваренная соль (плюсы и минусы) Щелочи
Щелочи