Содержание
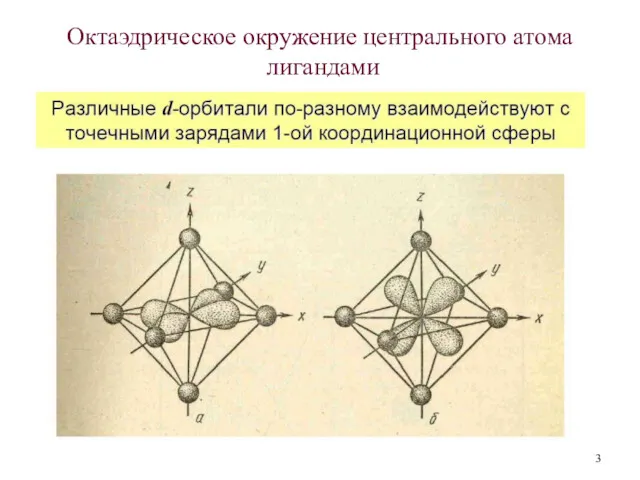
- 3. Октаэдрическое окружение центрального атома лигандами
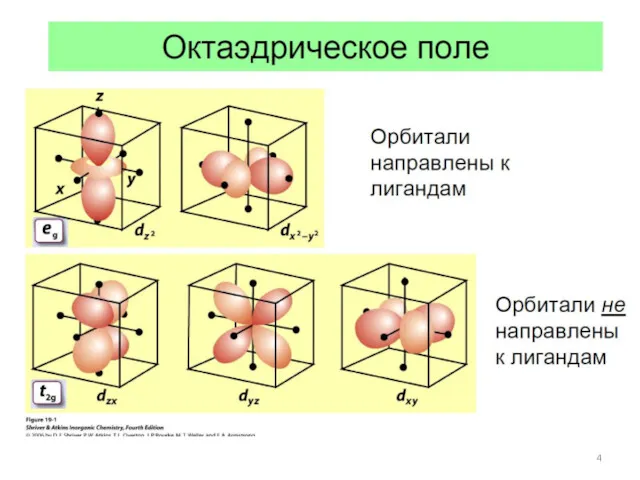
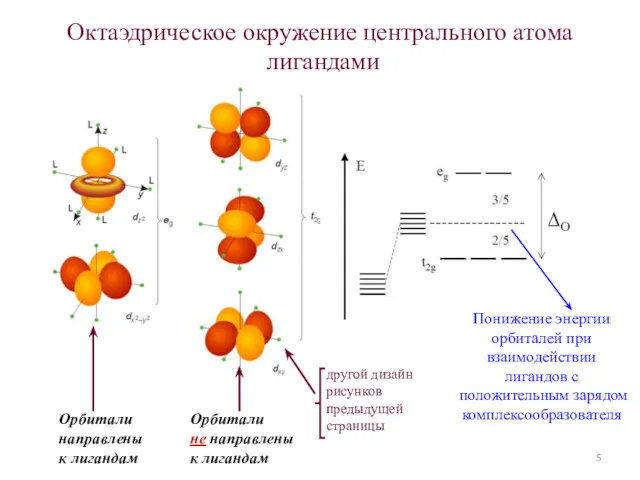
- 5. Октаэдрическое окружение центрального атома лигандами Орбитали направлены к лигандам Орбитали не направлены к лигандам Понижение энергии
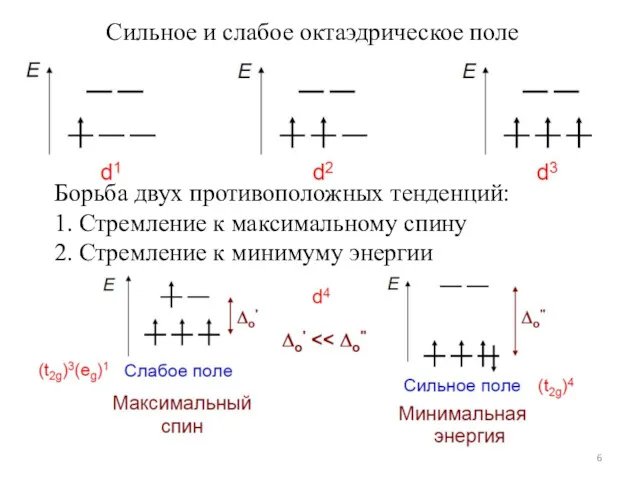
- 6. Сильное и слабое октаэдрическое поле Борьба двух противоположных тенденций: 1. Стремление к максимальному спину 2. Стремление
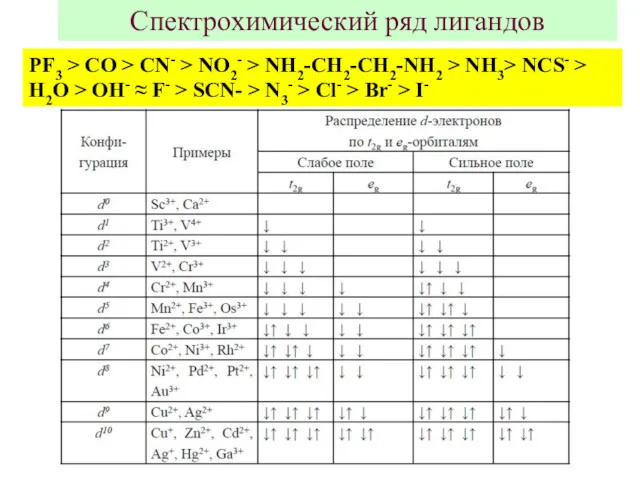
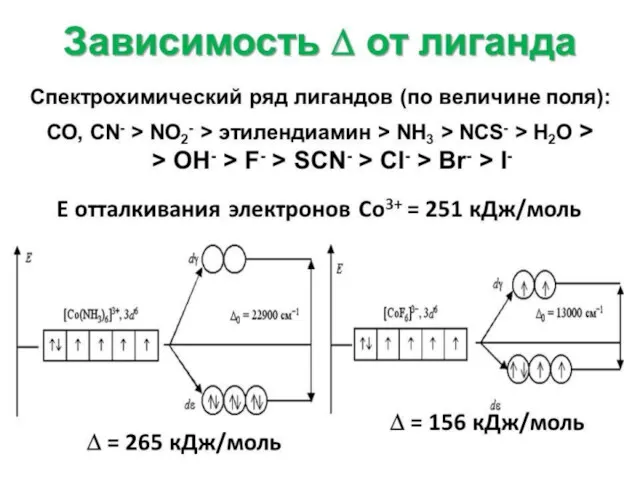
- 7. Спектрохимический ряд лигандов PF3 > CO > CN- > NO2- > NH2-CH2-CH2-NH2 > NH3> NCS- >
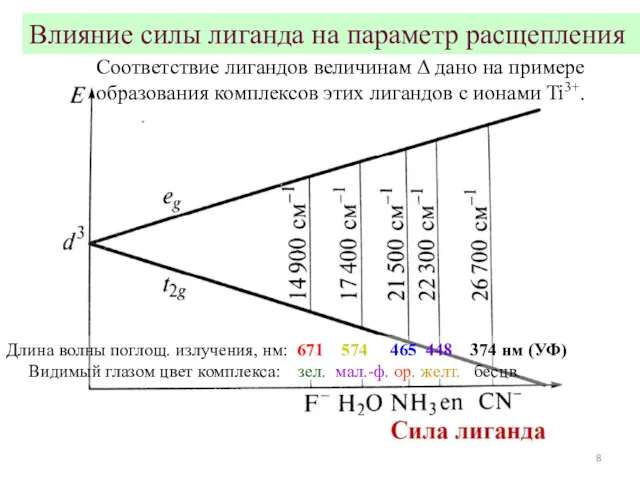
- 8. Влияние силы лиганда на параметр расщепления Длина волны поглощ. излучения, нм: 671 574 465 448 374
- 9. Пример расщепления в октаэдрических комплексах Ni2+ Красный Оранж.-желт. Желтый
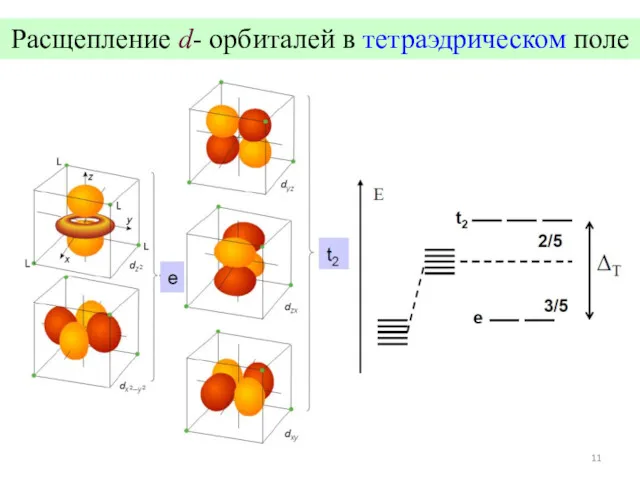
- 11. Расщепление d- орбиталей в тетраэдрическом поле
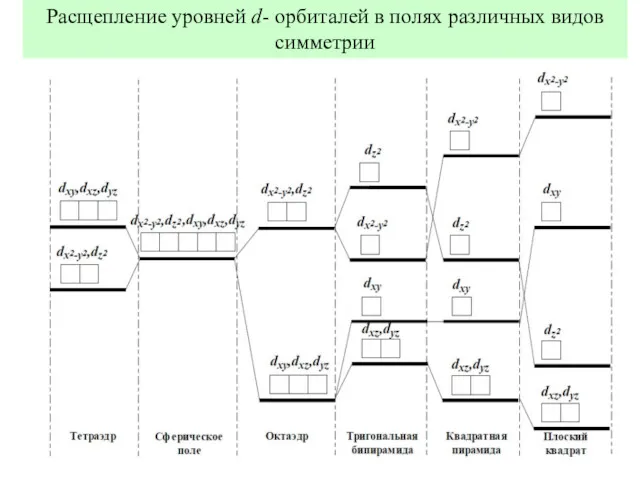
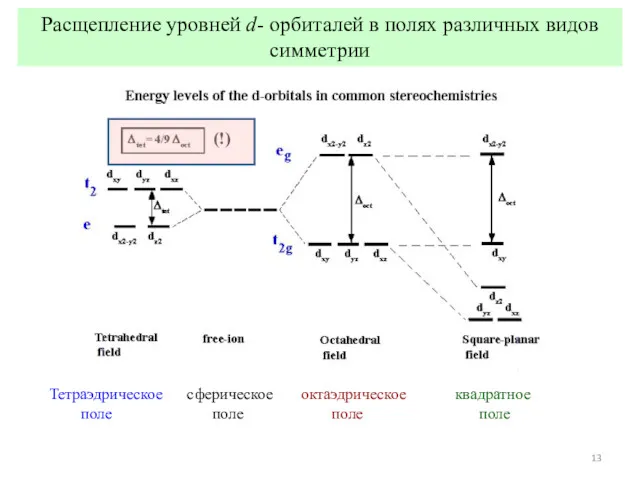
- 12. Расщепление уровней d- орбиталей в полях различных видов симметрии
- 13. Расщепление уровней d- орбиталей в полях различных видов симметрии Тетраэдрическое сферическое октаэдрическое квадратное поле поле поле
- 14. ЭСКП в октаэдре: ЭСКП = [2/5 n(t2g) –3/5 n(eg)]ΔO – nспар.⋅P ΔO – энергия расщепления октаэдрическим
- 15. Расчет ЭСКП -P -P . Для октаэдра:
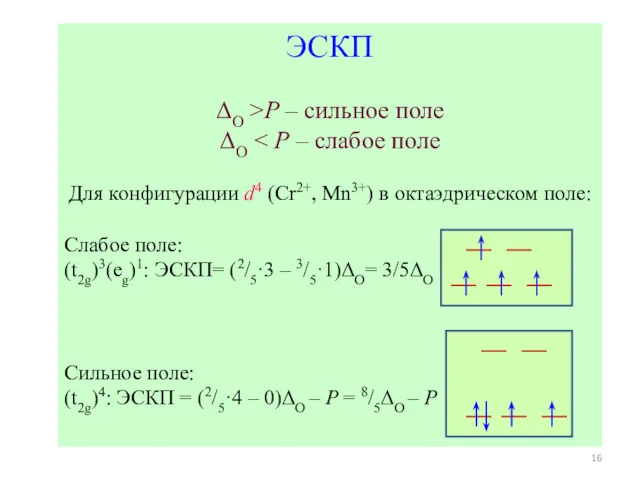
- 16. ЭСКП ΔO >P – сильное поле ΔO Для конфигурации d4 (Cr2+, Mn3+) в октаэдрическом поле: Слабое
- 17. (слайд из лекций х/ф МГУ) Замечания: 1. Справа у меня получилось 38/45 ! Проверить на семинарах!
- 18. f- орбитали и их расщепление
- 19. Расщепление f- орбиталей в октаэдрическом поле (комплексы типа K3[Ln3+Cl6]; Ln = Ce, Pr, …, Lu) Zbiri
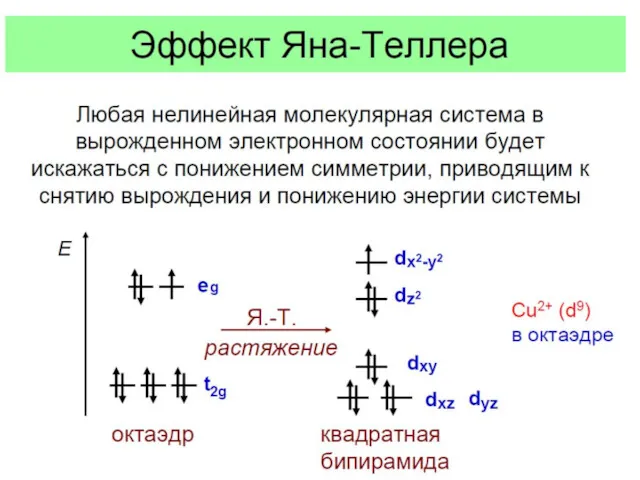
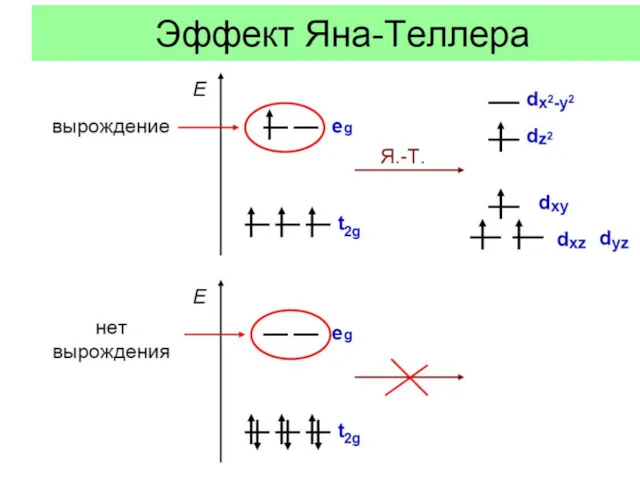
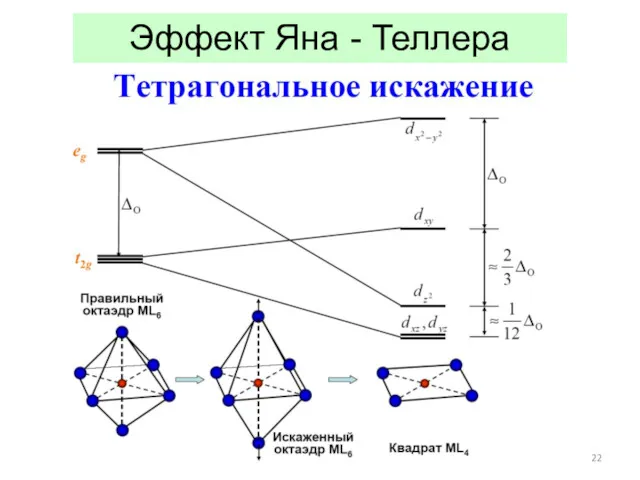
- 22. Эффект Яна - Теллера
- 23. Эффект Яна - Теллера Пример: соединения «1-2-3» типа NdBa2Cu3O6+δ: правильнее Ba2NdCu[O3Cu-CuO3+δ]
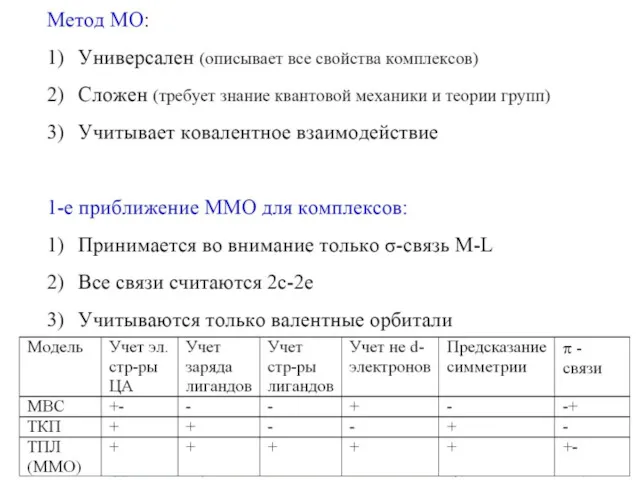
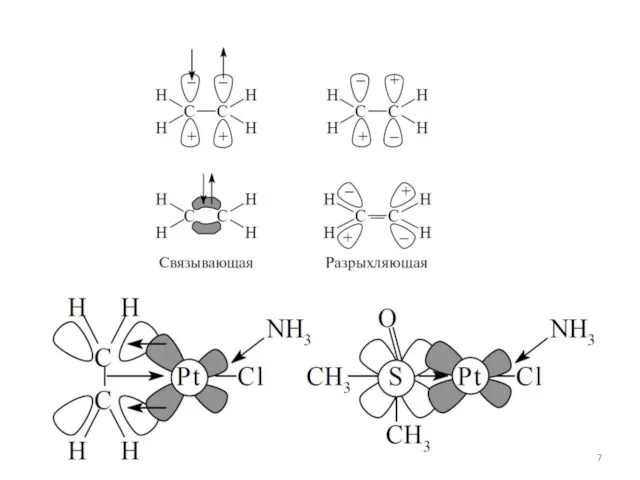
- 24. Основы ММО для комплексов Ван Флек, 30-40 гг. XX в. • Образование комплекса и снятие вырождения
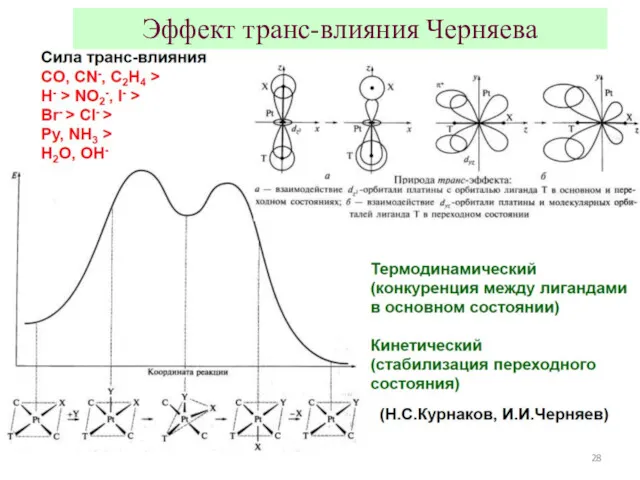
- 26. Эффект транс-влияния Черняева Для квадратных и октаэдрических комплексов, скорость реакции замещения лиганда L определяется природой заместителя
- 28. Эффект транс-влияния Черняева
- 30. Скачать презентацию


![ЭСКП в октаэдре: ЭСКП = [2/5 n(t2g) –3/5 n(eg)]ΔO –](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/136364/slide-13.jpg)



![Расщепление f- орбиталей в октаэдрическом поле (комплексы типа K3[Ln3+Cl6]; Ln](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/136364/slide-18.jpg)
![Эффект Яна - Теллера Пример: соединения «1-2-3» типа NdBa2Cu3O6+δ: правильнее Ba2NdCu[O3Cu-CuO3+δ]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/136364/slide-22.jpg)


 Теоретические основы органической химии
Теоретические основы органической химии Кислоты и их свойства
Кислоты и их свойства Воздух и его свойства
Воздух и его свойства Виды изомерии в органической химии
Виды изомерии в органической химии Современная химия. (Лекция 6)
Современная химия. (Лекция 6) Химическая промышленность
Химическая промышленность Свойства растворов электролитов
Свойства растворов электролитов Роль химии в современной цивилизации
Роль химии в современной цивилизации Электрохимические процессы
Электрохимические процессы Обмен липидов
Обмен липидов Химические свойства воды
Химические свойства воды Экстрагирование в химической промышленности
Экстрагирование в химической промышленности Заключительный урок в 8 классе Тест по химии.
Заключительный урок в 8 классе Тест по химии. Сущность процесса электролитической диссоциации
Сущность процесса электролитической диссоциации Жескость воды
Жескость воды ОВР в органической химии
ОВР в органической химии Чисті речовини і суміші
Чисті речовини і суміші Каталитический риформинг
Каталитический риформинг Кислород как элемент
Кислород как элемент Геохимия. Геохимическая система элементов
Геохимия. Геохимическая система элементов Бордың адам ағзасына әсері
Бордың адам ағзасына әсері Алюминий и его сплавы
Алюминий и его сплавы Кремний и его соединения
Кремний и его соединения Виды химической связи
Виды химической связи Положение металлов в периодической системе химических элементов. Особенности строения их атомов
Положение металлов в периодической системе химических элементов. Особенности строения их атомов Изотопы химических элементов
Изотопы химических элементов Электронные конфигурации атомов
Электронные конфигурации атомов Решение заданий ЕГЭ на составление окислительно-восстановительных реакций
Решение заданий ЕГЭ на составление окислительно-восстановительных реакций