Кислород как элемент.
Кислород является
самым распространённым
элементом нашей
планеты. По весу на
его долю приходится
примерно половина
общей массы всех
элементов земной
коры.
Состав воздуха:
О2 – 20-21 %; N2 – 78%; CO2 – 0,03%,
остальное приходится на инертные газы, пары воды, примеси.
4. В земной коре его 49% по массе,
в гидросфере – 89% по массе.
5. В составе воздуха (в виде простого
вещества) – 20-21% по объёму.
6. Входит в состав большинства минеральных
и горных пород (песок, глины, и др). В составе
воздуха (в виде простого вещества).
7. Жизненно важный элемент для всех
организмов, содержится в большинстве
органических веществ, участвует во многих
биохимических процессах, обеспечивающих
развитие и функционирование жизни.
8. Кислород открыт в 1769-1771 гг. шведским
химиком К.-В. Шееле






 Химическая кинетика и катализ
Химическая кинетика и катализ Реальные газы, жидкости и твердые тела
Реальные газы, жидкости и твердые тела Методика изучения современной теории строения как фундамента курса органической химии в старшей школе
Методика изучения современной теории строения как фундамента курса органической химии в старшей школе Кислород. Общая характеристика, получение и свойства
Кислород. Общая характеристика, получение и свойства Азотжәне Фосфорэлементтерін салыстырыңдар,мәліметтерді кестеге толтырыңдар
Азотжәне Фосфорэлементтерін салыстырыңдар,мәліметтерді кестеге толтырыңдар Свойства воды
Свойства воды Водород - топливо будущего
Водород - топливо будущего Строение атома. Лекция 2
Строение атома. Лекция 2 Биосенсорные системы
Биосенсорные системы Второй закон термодинамики. Биоэнергетика
Второй закон термодинамики. Биоэнергетика Визитка химического элемента. Водород
Визитка химического элемента. Водород Пластмаси. Пластичні маси
Пластмаси. Пластичні маси Др
Др Периодическая система элементов Д. И. Менделеева. IA группа
Периодическая система элементов Д. И. Менделеева. IA группа Електронні і графічні електронні формули атомів s-, p-, d- елементів. Принцип Мінімальної енергії
Електронні і графічні електронні формули атомів s-, p-, d- елементів. Принцип Мінімальної енергії Аминокислоты
Аминокислоты Металлы в природе. Способы получения металлов
Металлы в природе. Способы получения металлов Кислотность и основность органических соединений. (Лекция 3)
Кислотность и основность органических соединений. (Лекция 3) Простые эфиры
Простые эфиры Коллоидные ПАВ
Коллоидные ПАВ Карбоновые кислоты (часть 2)
Карбоновые кислоты (часть 2)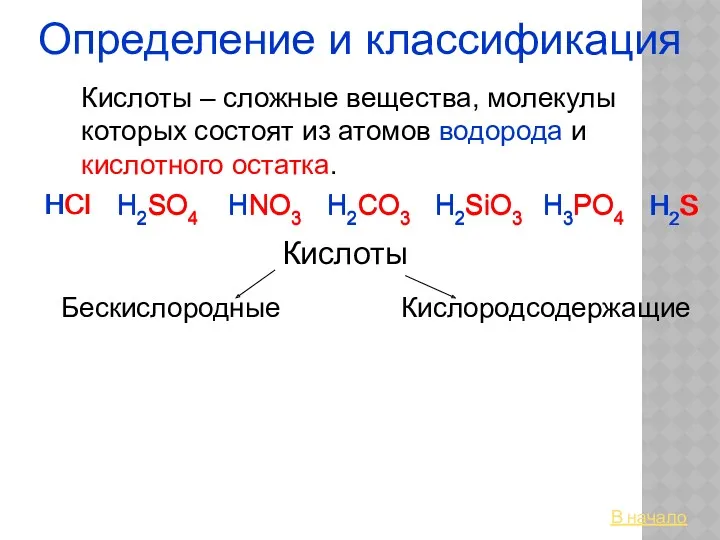 Кислоты. Определение и классификация
Кислоты. Определение и классификация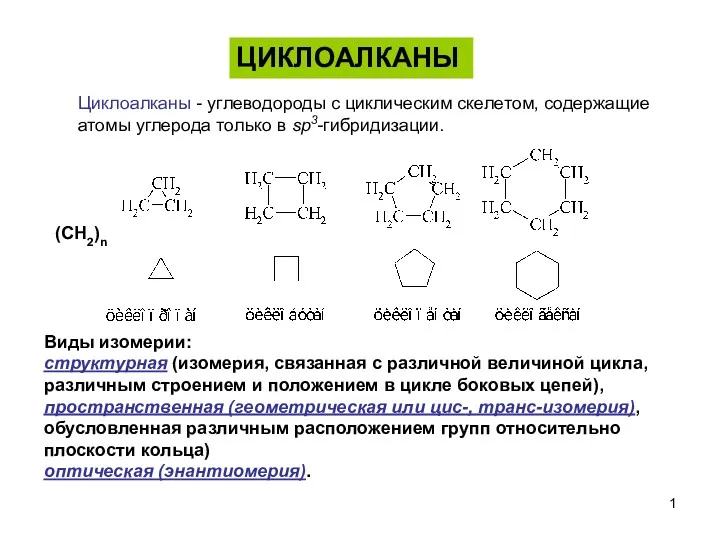 Циклоалканы
Циклоалканы Закон сохранения масс 8 класс
Закон сохранения масс 8 класс Мир запахов
Мир запахов Оксиды
Оксиды Оксиды. Химические свойства. Способы получения
Оксиды. Химические свойства. Способы получения Теория электролитической диссоциации (ТЭД)
Теория электролитической диссоциации (ТЭД)