Содержание
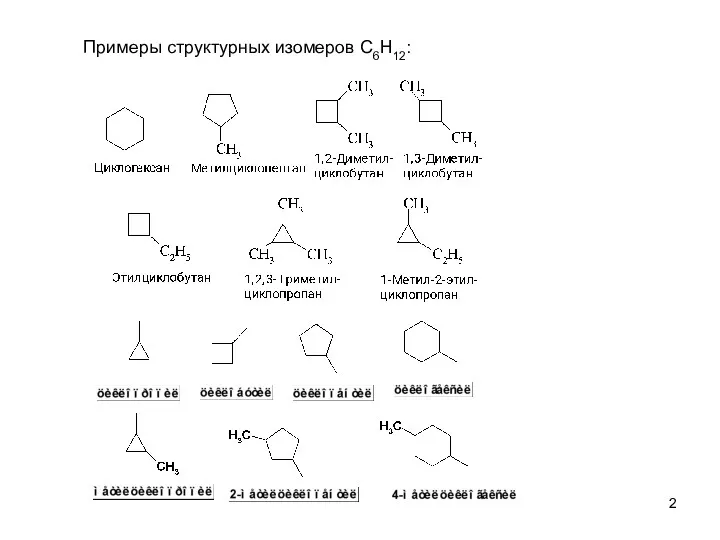
- 2. Примеры структурных изомеров C6H12:
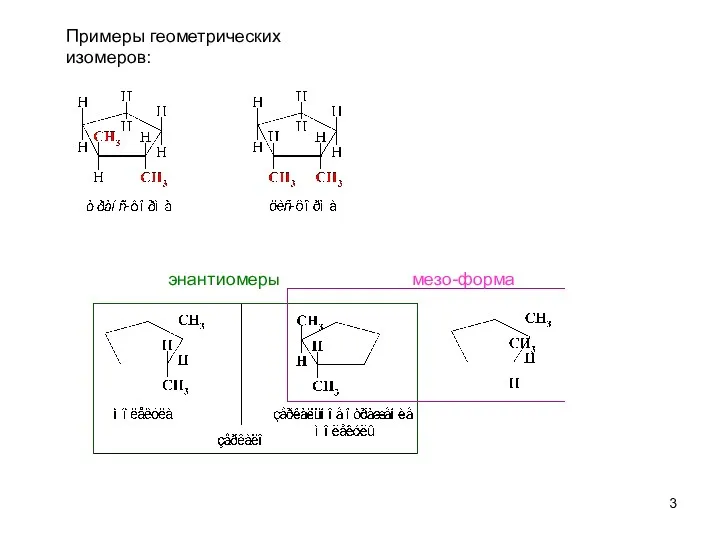
- 3. Примеры геометрических изомеров: энантиомеры мезо-форма
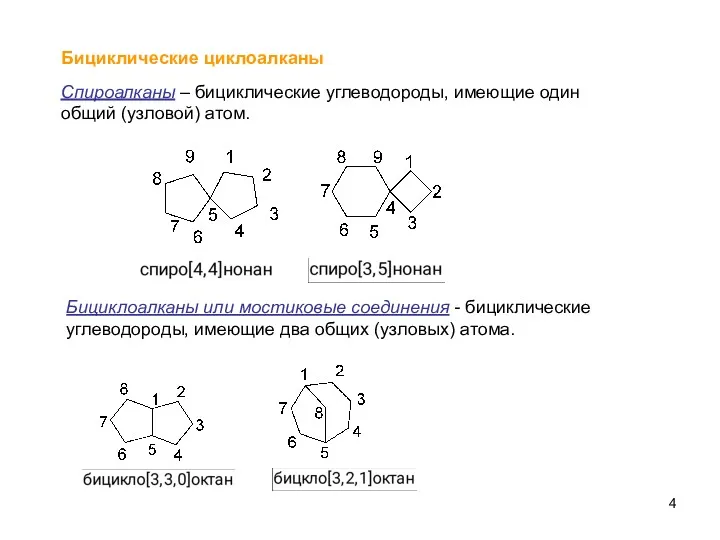
- 4. Бициклические циклоалканы Спироалканы – бициклические углеводороды, имеющие один общий (узловой) атом. Бициклоалканы или мостиковые соединения -
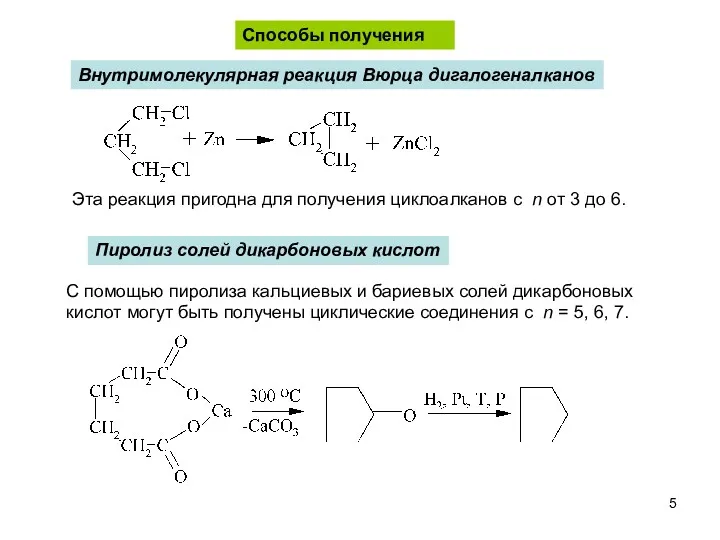
- 5. С помощью пиролиза кальциевых и бариевых солей дикарбоновых кислот могут быть получены циклические соединения с n
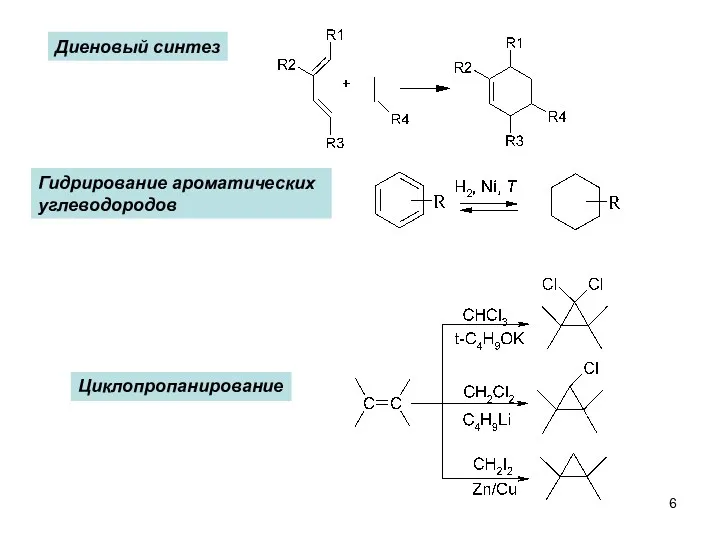
- 6. Диеновый синтез Гидрирование ароматических углеводородов Циклопропанирование
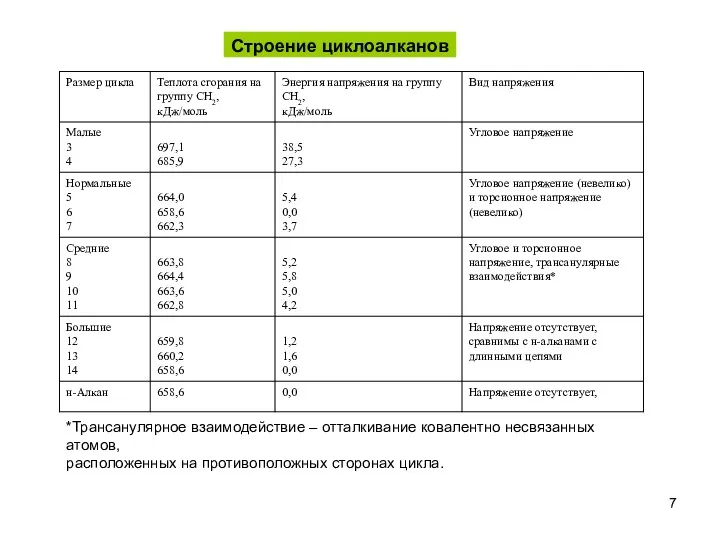
- 7. *Трансанулярное взаимодействие – отталкивание ковалентно несвязанных атомов, расположенных на противоположных сторонах цикла. Строение циклоалканов
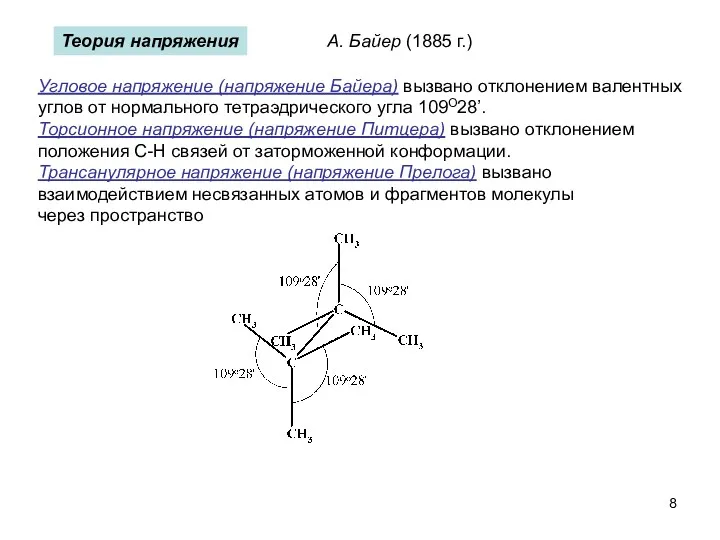
- 8. Теория напряжения Угловое напряжение (напряжение Байера) вызвано отклонением валентных углов от нормального тетраэдрического угла 109О28’. Торсионное
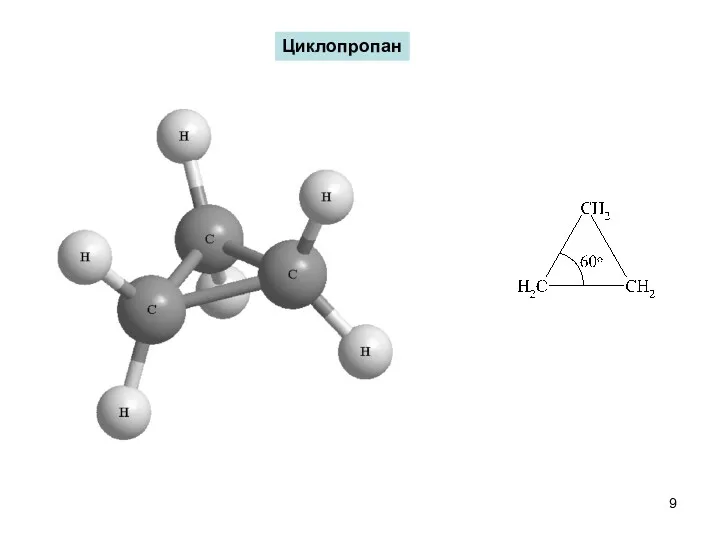
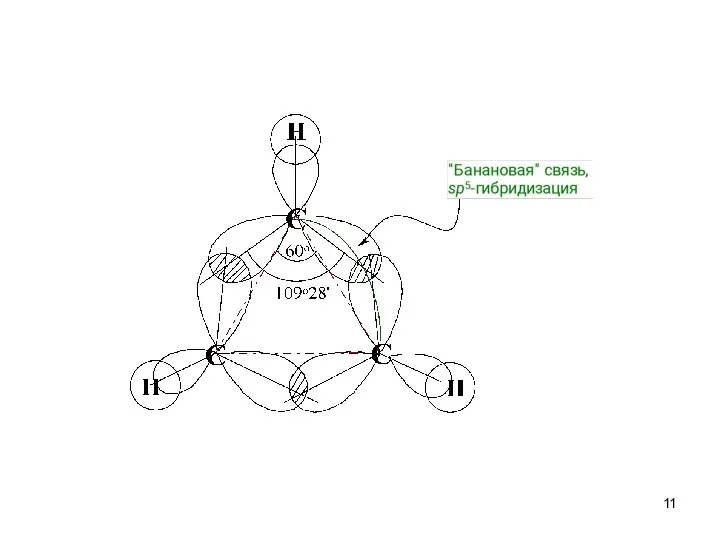
- 9. Циклопропан
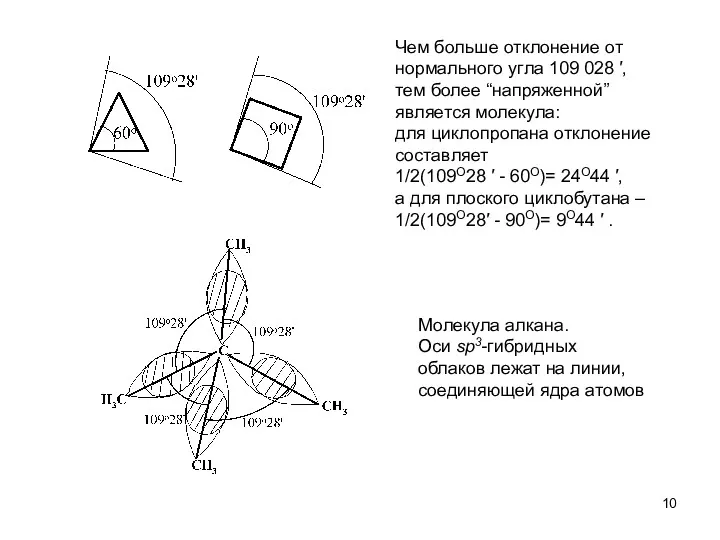
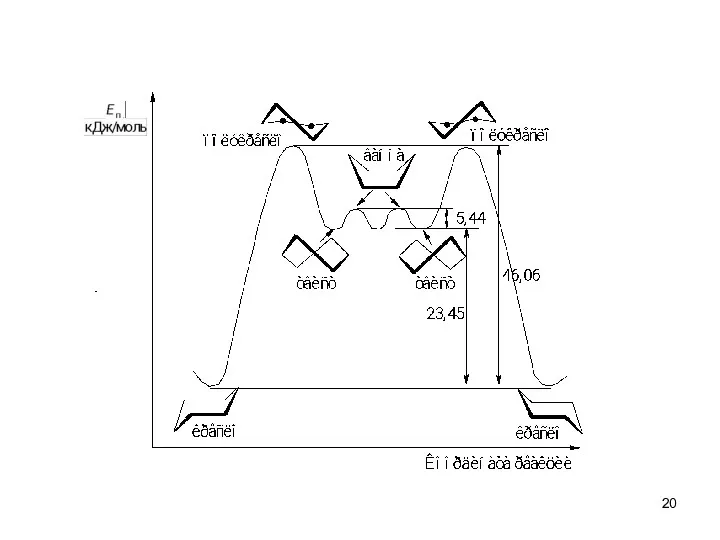
- 10. Чем больше отклонение от нормального угла 109 028 ′, тем более “напряженной” является молекула: для циклопропана
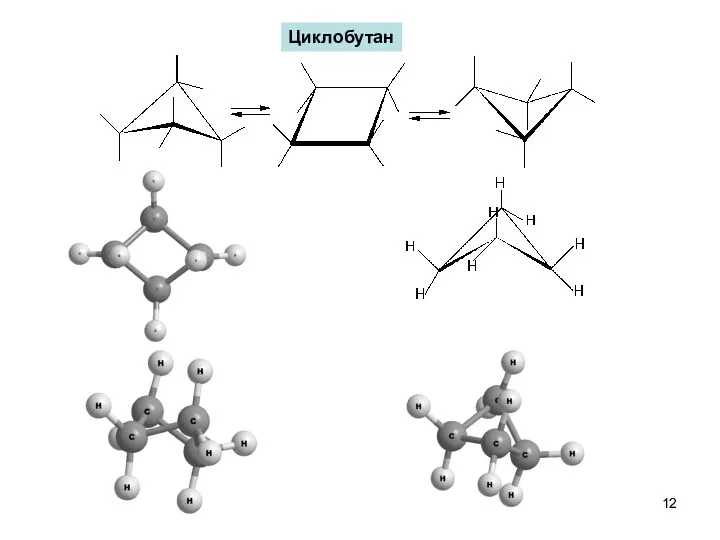
- 12. Циклобутан
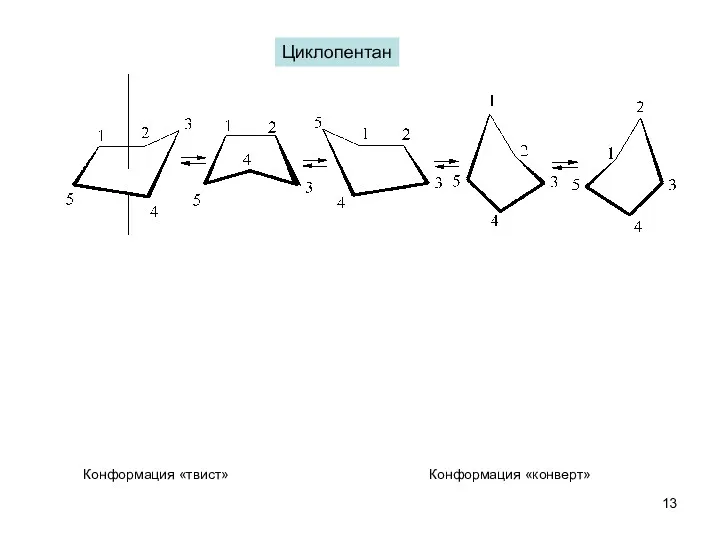
- 13. Циклопентан Конформация «конверт» Конформация «твист»
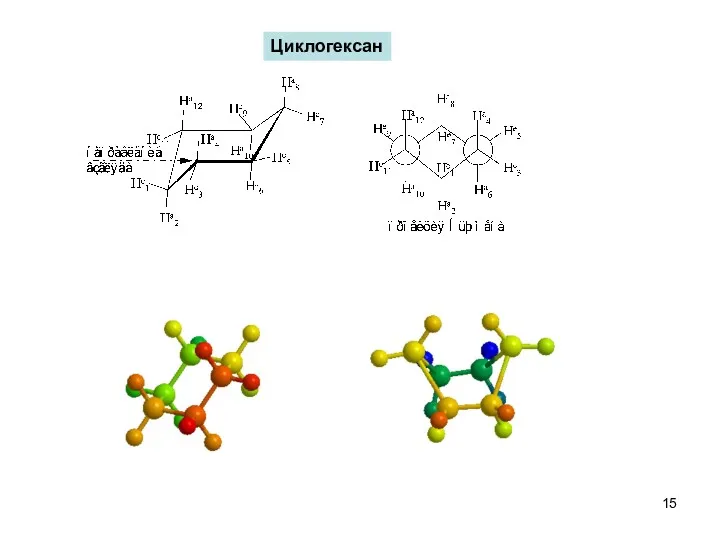
- 15. Циклогексан
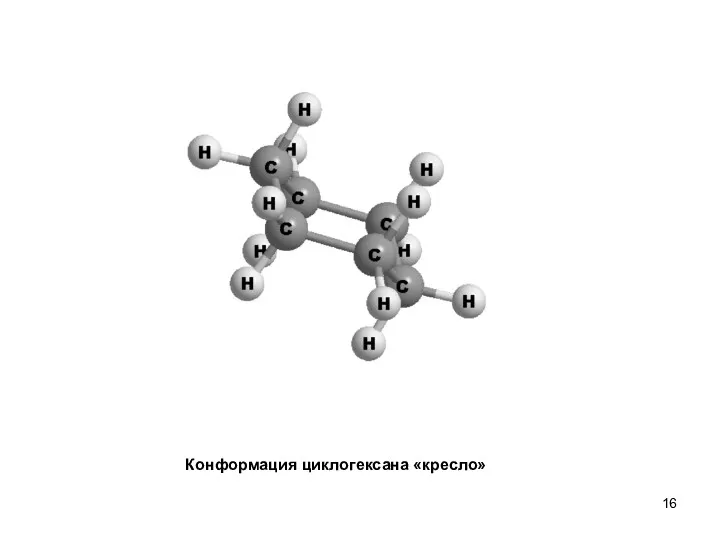
- 16. Конформация циклогексана «кресло»
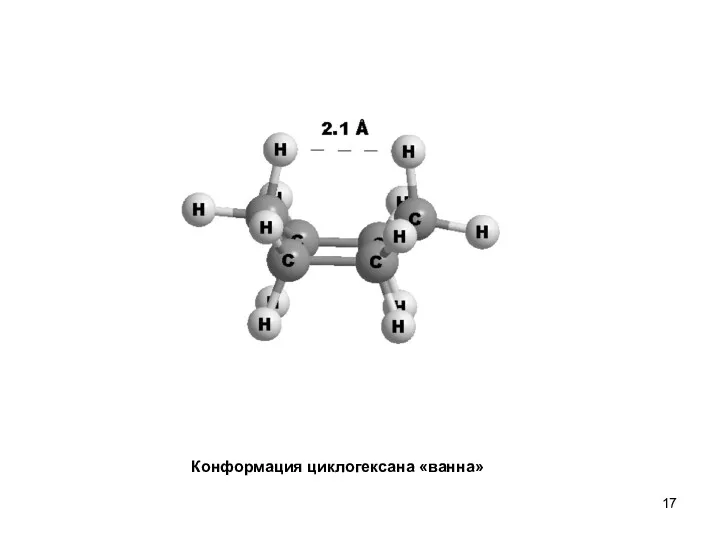
- 17. Конформация циклогексана «ванна»
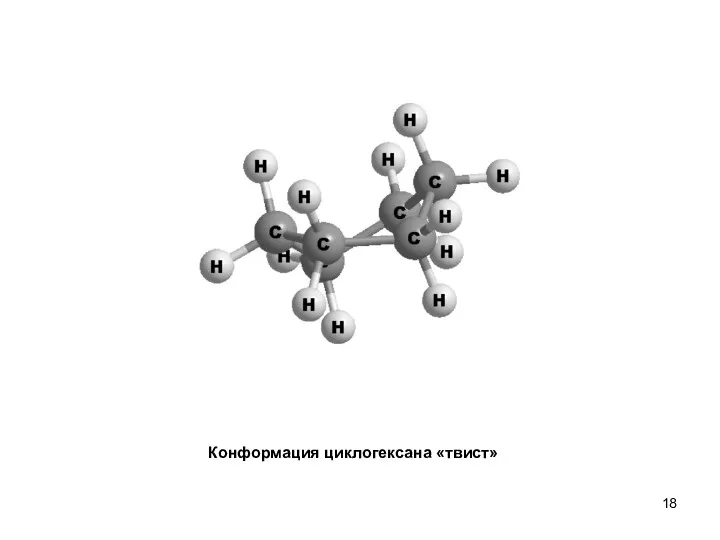
- 18. Конформация циклогексана «твист»
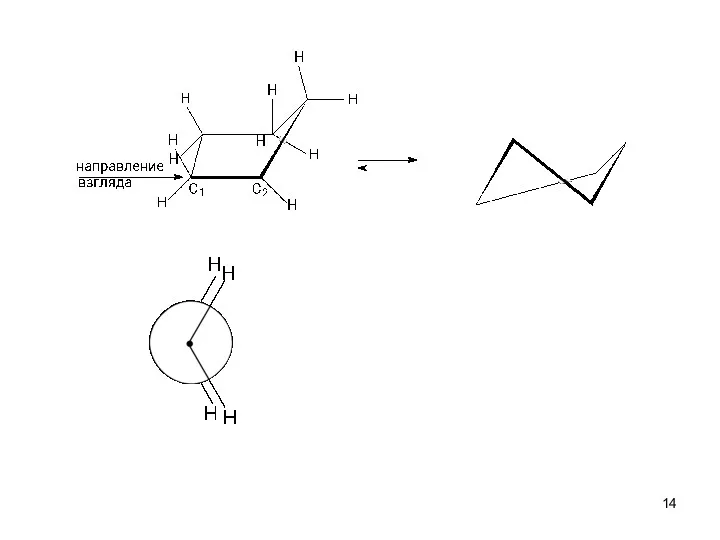
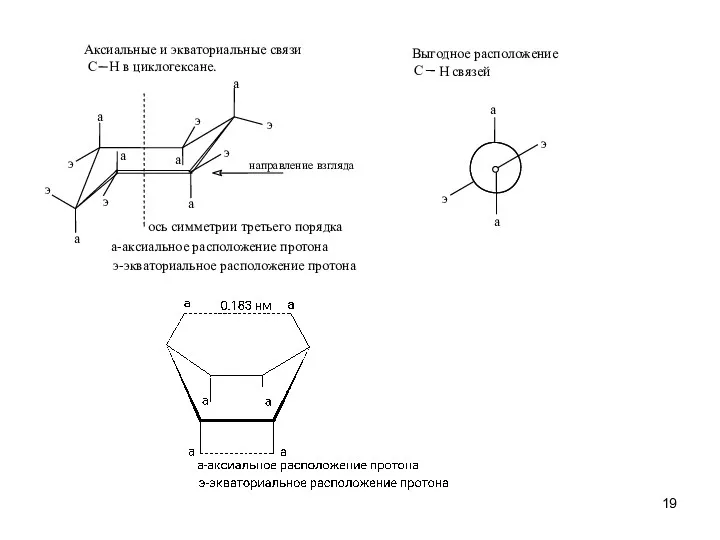
- 19. э а э а H связей Выгодное расположение C H в циклогексане. Аксиальные и экваториальные связи
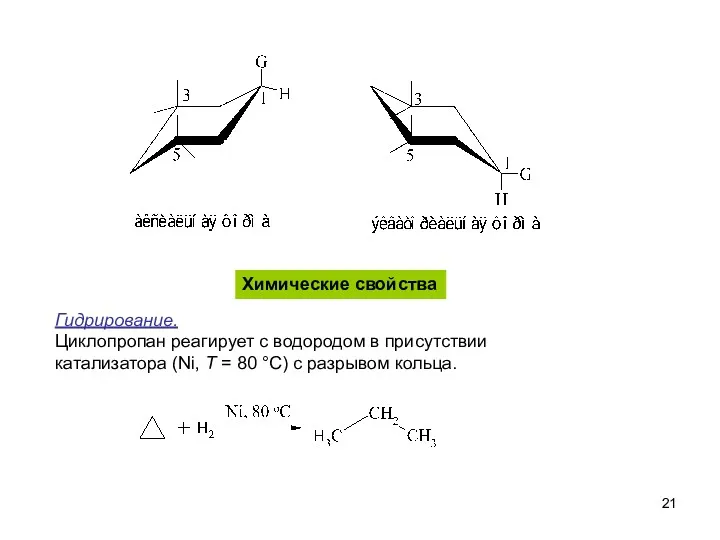
- 21. Химические свойства Гидрирование. Циклопропан реагирует с водородом в присутствии катализатора (Ni, T = 80 °С) с
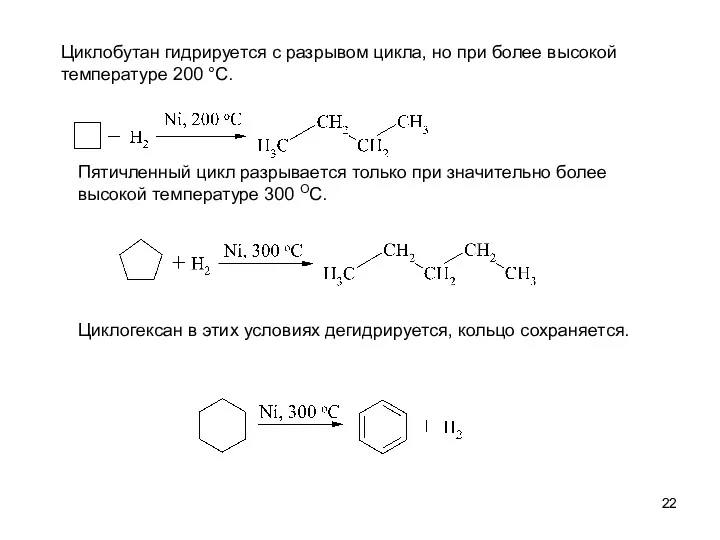
- 22. Циклобутан гидрируется с разрывом цикла, но при более высокой температуре 200 °С. Пятичленный цикл разрывается только
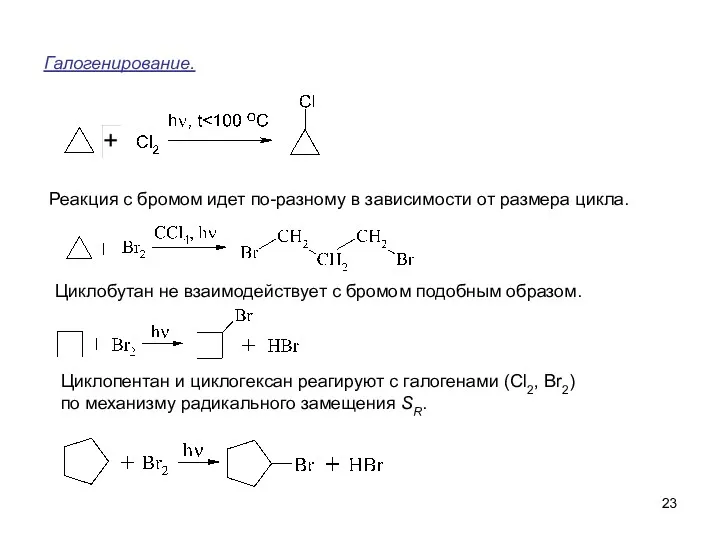
- 23. Галогенирование. Циклобутан не взаимодействует с бромом подобным образом. Циклопентан и циклогексан реагируют с галогенами (Cl2, Br2)
- 25. Скачать презентацию
 Максимально очищенные фитопрепараты. Технология и стандартизация
Максимально очищенные фитопрепараты. Технология и стандартизация Лекарственные средства, производные пиридина и пиперазина
Лекарственные средства, производные пиридина и пиперазина Растворы. Классификация, способы выражения концентрации, свойства растворов
Растворы. Классификация, способы выражения концентрации, свойства растворов Heavy metals
Heavy metals Химические методы выявления потожировых следов
Химические методы выявления потожировых следов Искусственные и трансурановые элементы
Искусственные и трансурановые элементы Карбонові кислоти
Карбонові кислоти Перманганат калия
Перманганат калия АЛКАНЫ Строение молекулы метана.
АЛКАНЫ Строение молекулы метана. Вещественный состав магматических горных пород и петрохимические пересчеты
Вещественный состав магматических горных пород и петрохимические пересчеты Химические свойства основных классов неорганических соединений
Химические свойства основных классов неорганических соединений Периодический закон Менделеева
Периодический закон Менделеева Кислород
Кислород Непредельные углеводороды. Алкины
Непредельные углеводороды. Алкины Аллотропия
Аллотропия Химическая промышленность России входит в авангардную тройку
Химическая промышленность России входит в авангардную тройку Вещества и физические тела
Вещества и физические тела Химическая технология природных энергоносителей и углеродных материалов
Химическая технология природных энергоносителей и углеродных материалов Алканы.Определение. Общая формула класса углеводородов
Алканы.Определение. Общая формула класса углеводородов Уникальная соль (для дошколников)
Уникальная соль (для дошколников) Химические свойства толуола
Химические свойства толуола Окислительно-восстановительные реакции. Основные положения электронной теории ОВР
Окислительно-восстановительные реакции. Основные положения электронной теории ОВР Перегонка с водяным паром
Перегонка с водяным паром Вода
Вода Припекание взаимно растворимых твердых тел
Припекание взаимно растворимых твердых тел 5.Алкины
5.Алкины Циклические углеводороды
Циклические углеводороды Химический элемент водород
Химический элемент водород